STAT3 在猪流行性腹泻病毒感染的作用及机制初步探索
杨丽君,张 健,许嘉宇,张 璐,冯 力,陈洪岩,王玉娥
(中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室 黑龙江省实验动物与比较医学重点实验室,黑龙江 哈尔滨 150069)
猪流行性腹泻(PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的猪的一种急性、高度接触性的肠道传染病,该病在临床上以仔猪的呕吐、腹泻和脱水为主要特征,死亡率高达90%[1-2]。猪流行性腹泻于1971 年在英国首次出现,随后许多国家相继报道了该病的发生[3]。1976 年,我国首次报道该病的存在,而且目前该病的发病率仍呈逐年上升趋势,已成为猪产业中严重的传染性疾病,给我国养猪业造成了巨大的经济损失[4-5]。尽管对该病的研究已有30 多年的历史,但目前以疫苗免疫为主的防治免疫效果不佳,并且免疫失败经常发生[6],因此加强PEDV 与宿主相互作用的基础研究显得非常重要。研究表明,STAT3 通过不同的机制参与病毒的感染过程中,比如丙型肝炎病毒(Hepatitis C virus,HCV)和水痘带状疱疹病毒(Varicella Zoster virus,VZV)等[7-8]。因此本研究通过对HEK293 细胞[9]和IPEC 细胞用STAT3 特异性siRNA处理,开展对PEDV 感染和干扰素(Interferon,IFN)相关分子的研究,为进一步阐明STAT3 参与PEDV 感染引发的免疫应答机制提供了试验依据。
1 材料与方法
1.1 主要试验材料 PEDV CV777 毒株、人胚肾细胞(HEK293 细胞)、猪的小肠上皮细胞(IPEC-J2 细胞)和抗PEDV N 蛋白抗体,均由本实验室保存;Oligo d(T)18、RNA 酶抑制剂和SYBR PremixEx-TaqⅡ(2×),均购自TaKaRa 公司;MLV 反转录酶、RIPA裂解液,购自海基生物有限公司;RNA 提取试剂盒RNeasy Plus Mini Kit,购自QIAGEN 公司;DEPC 水,购自BIOSHARP 公司;STAT3 抗体,购自CST 公司;STAT3 特异性siRNA 和β-actin 单克隆抗体,均购自Sigma-Aldrich 公司;HRP 标记的山羊抗鼠IgG,购自中杉金桥生物技术有限公司;Super ECL 发光液,购自Thermo Scientific 公司。
1.2 引物设计 根据GenBank 中已登录的相应的基因序列,用Oligo 7 软件设计STAT3 和MxA,ISG15,IFN-β,IFN-λ,PEDV ORF3 以及内参β-actin 的定量引物(表1),由吉林库美生物科技有限公司合成。

表1 荧光定量PCR 引物序列
1.3 敲低STAT3 对PEDV 感染影响的检测
1.3.1 STAT3 敲低效率检测 将对应的3 种STAT3 特异性siRNA(siSTAT3)分别转染至HEK293 和IPEC 细胞中,于转染后24 h,收集细胞,通过荧光定量PCR 和Western Blot 试验方法来验证STAT3 的敲低效率。对于荧光定量PCR 方法,按照RNA 提取试剂盒(RNeasy Plus Mini Kit)方法步骤提取总RNA,以反转录产物cDNA 为模板,利用引物STAT3 及内参β-actin,采用本研究室建立的荧光定量PCR 方法进行基因扩增。反应条件为:95 ℃ 30 s;95 ℃ 5 s、55 ℃20 s、72 ℃30 s,总共40 个循环,进行目的基因转录水平的荧光定量PCR 检测。对于Western Blot 方法,在加入RIPA 裂解液裂解后取上清,进行SDS-PAGE 电泳,随后将蛋白转印至PVDF 膜上,采用含5% 脱脂奶粉的TBST 封闭4 ℃过夜,TBST(TBS 中含0.1% Tween-20)漂洗3 次,每次10 min;膜与相应一抗(anti-STAT3:1∶1 000,anti-β-actin:1∶10 000)室 温孵育2 h 或4 ℃过夜,TBST 洗膜3 次;然后利用HRP 标记的山羊抗鼠mAb(1∶10 000)与PVDF 膜室温摇床孵育1 h;再次用TBST 洗膜3 次后,加入适量super ECL 发光液后于暗室进行Western Blot 条带检测。
1.3.2 PEDV ORF3 的RNA 水平检测 将对应的3种STAT3 特异性siRNA 及空白siRNA 对照分别转染至HEK293 和IPEC 细胞中,于转染后24 h,PEDV分别按MOI=0.1 和MOI=1 接种于这2 种细胞,37 ℃、5% CO2中分别培养24 h 和48 h 后,收集细胞,按照RNA 提取试剂盒方法步骤提取总RNA,反转录,利用引物PEDV ORF3 及内参β-actin,采用荧光定量PCR 方法进行基因扩增。反应条件为:95 ℃30 s;95 ℃5 s、55 ℃20 s、72 ℃30 s,总共40 个循环,进行病毒RNA 水平的荧光定量PCR检测。
1.3.3 PEDV N 蛋白水平检测 将对应的3 种STAT3 特异性siRNA 分别转染至HEK293 和IPEC细胞中,于转染后24 h,PEDV 分别按MOI=0.1 和MOI=1 接种于这2 种细胞,37 ℃、5% CO2中分别培养24 h 和48 h 后,收集细胞裂解后取上清,进行SDS-PAGE 电泳,转膜,4 ℃封闭过夜,膜与相应一抗(anti-PEDV N:1∶1000,anti-β-actin:1∶10 000)室温孵育2 h 或4 ℃过夜,然后利用HRP 标记的山羊抗鼠mAb(1∶10 000)与PVDF 膜室温摇床孵育1 h,加入适量super ECL 发光液后于暗室进行Western Blot鉴定。
1.4 STAT3 对IFN 相关基因影响的检测 将3 种STAT3 特异性siRNA 混合后转染至HEK293 和IPEC-J2 细胞中,同时siRNA 空白组作为对照,于37 ℃、5% CO2中培养24 h,收集细胞后直接按照RNA 提取试剂盒的方法步骤提取总RNA,以Oligo d(T)18为引物反转录获得cDNA,以其为模板,利用引物MxA,ISG15,IFN-β和IFN-λ,采用荧光定量PCR 方法进行基因扩增。反应条件为:95 ℃30 s;95 ℃5 s、58 ℃20 s、72 ℃30 s,总共40 个循环,进行相关基因转录水平的荧光定量PCR 检测。
2 结果
2.1 敲低STAT3 对PEDV 感染的影响2.1.1 STAT3 敲低效率检测结果 将STAT3 特异性siRNA 转染24 h 后的HEK293 和IPEC-J2 细胞收集后利用荧光定量PCR 和Western Blot 方法进行STAT3 敲低处理后的RNA 水平和蛋白水平的检测,结果发现,与siRNA 空白对照组相比,特异性siRNA转染组中STAT3 目的基因RNA 水平(图1A,1C)和蛋白水平(图1B,1D)显著降低(P<0.05),表明该siRNA 是有效果的,可以用于后续试验。
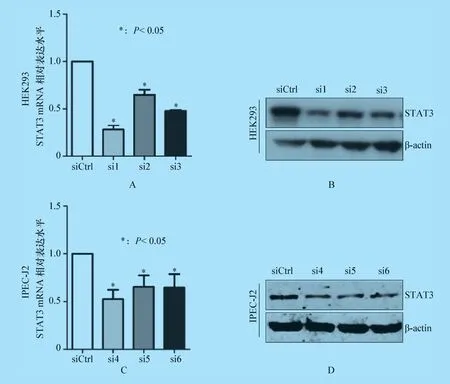
图1 荧光定量PCR 和Western Blot 检测STAT3 敲低效率
2.1.2 PEDV ORF3 的RNA 水平检测结果 将MOI=0.1 和MOI=1 的PEDV 分别接种于STAT3特异性siRNA 转染24 h 后的HEK293 和IPEC-J2 细胞中,分别感染24 h 和48 h 后收集细胞提取总RNA,利用荧光定量PCR 方法进行病毒RNA 水平的检测。检测结果显示,与siRNA 空白对照组相比,STAT3 siRNA 转染组PEDV ORF3 的RNA 水平显著降低(P<0.05)(图2)。表明在HEK293 和IPEC-J2 细胞中,降低STAT3 内源性表达能够显著抑制PEDV 的感染。
2.1.3 PEDV N 蛋白水平检测结果 将MOI=0.1和MOI=1 的PEDV 分别接种于STAT3 特异性siRNA 转染24 h 后的HEK293 和IPEC-J2 细胞中,分别感染24 h 和48 h 后收集细胞裂解后取上清,经SDS-PAGE 后转印至PVDF 膜,Western Blot 检测结果发现与对照组相比,敲低STAT3 后PEDV N 蛋白表达量明显降低(图3)。表明在HEK293 和IPEC-J2细胞中,敲低STAT3 能够显著抑制PEDV 的复制。
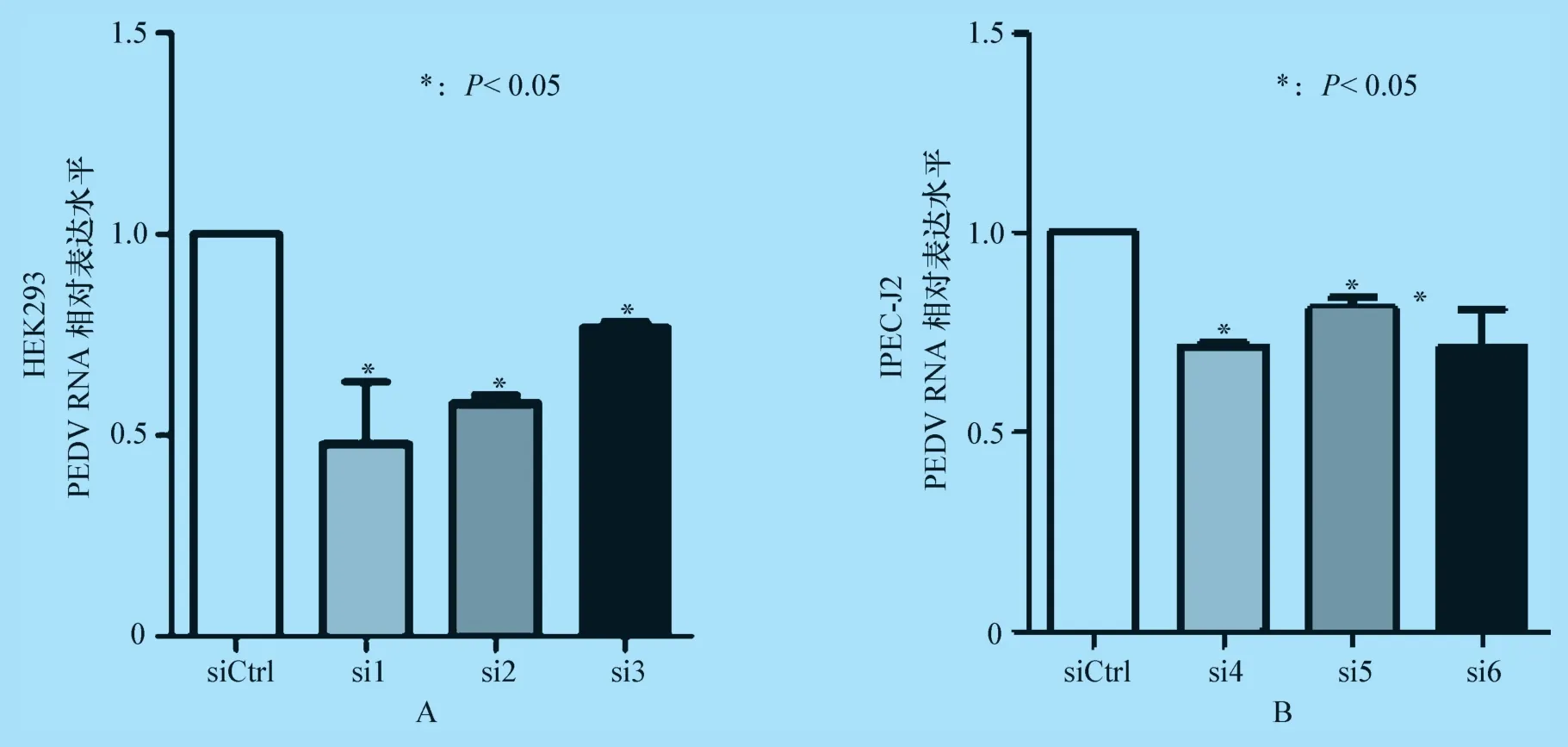
图2 荧光定量PCR 检测PEDV ORF3 的RNA 水平
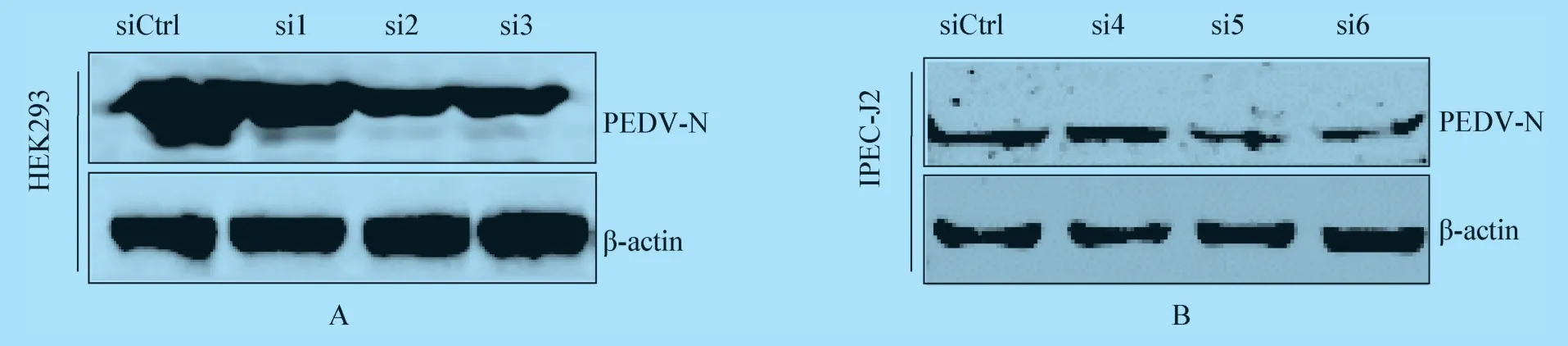
图3 Western Blot 鉴定敲低STAT3 对PEDV 的影响
2.2 STAT3 对IFN 相关基因的影响检测结果 为进一步研究STAT3 的作用机制,将三个STAT3 特异性siRNA 混合后转染至HEK293 和IPEC-J2 细胞中,同时siRNA 空白作为对照,利用荧光定量PCR 方法测定目的基因的变化情况。结果显示,与空白对照组相比,在HEK293 和IPEC-J2 细胞中,敲低内源性STAT3 表达水平后可以明显促进MxA,ISG15,IFN-β以及IFN-λ的mRNA 水平(P<0.05)(图4)。表明在HEK293 和IPEC-J2 细胞中,STAT3 负调控IFN抗病毒活性。
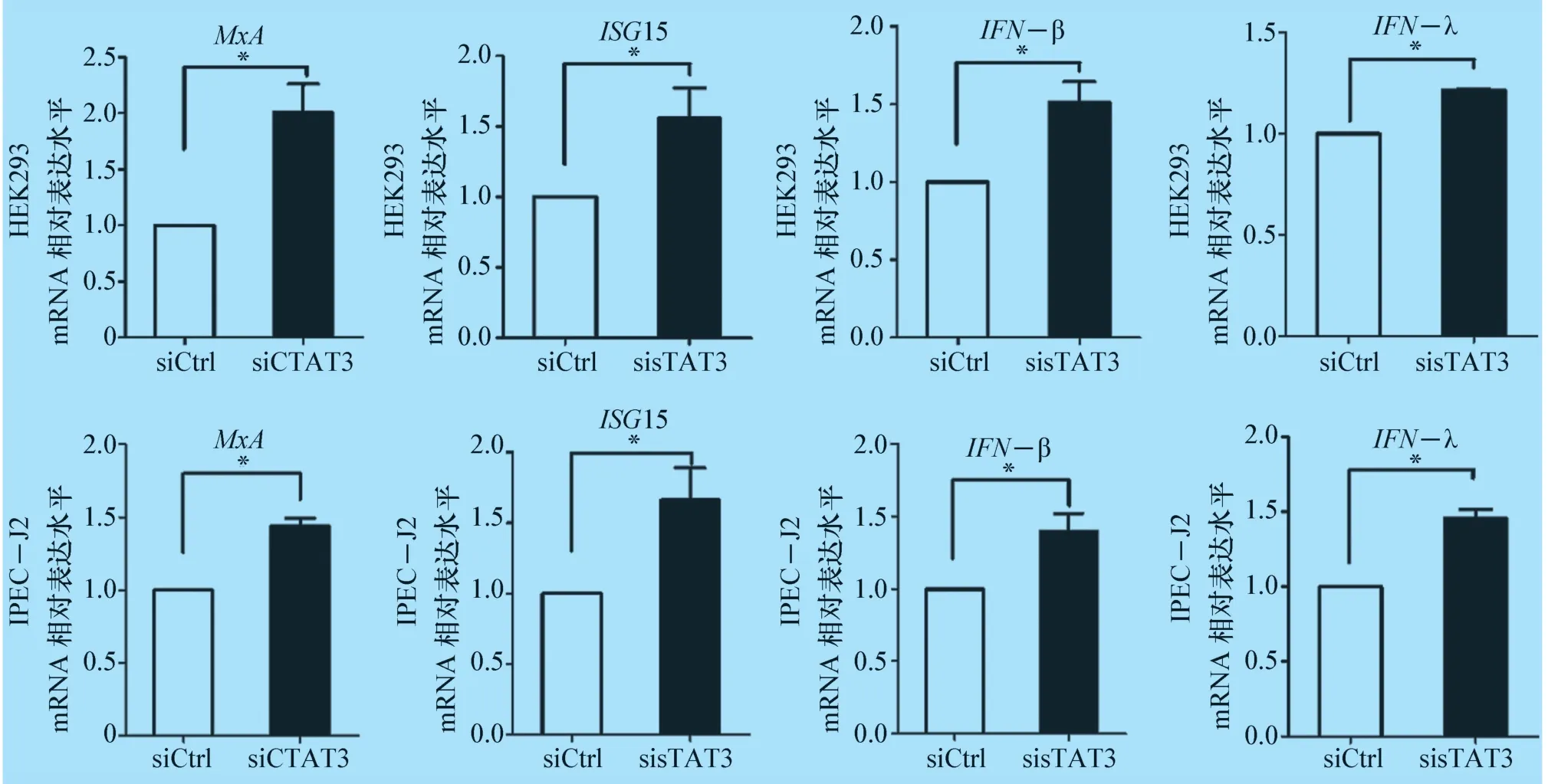
图4 荧光定量PCR 检测MxA, ISG15, IFN-β 和IFN-λ 的mRNA 水平
3 讨论
干扰素是先天性免疫的重要组成部分,病毒感染细胞会分泌大量的Ⅰ型干扰素(IFN-I),当IFN-I作用于其他细胞时产生抗病毒蛋白从而抵抗病毒的感染。IFN-I 与其受体结合后会激活STAT 蛋白,包括STAT1,STAT2 和STAT3。虽然已经有大量文献表明STAT1 和STAT2 参与到I 型干扰素抗病毒反应中,但是STAT3 在该反应中的作用却不明确。近年来,有研究表明,HCV 感染过程中STAT3 会发生磷酸化,促进HCV 的感染[7];在人胚胎肺成纤维细胞中过表达STAT3,能够明显抑制IFN-I 对VZV感染引起的抑制作用,促进VZV 复制[8];当STAT3沉默时会抑制病毒复制,即STAT3 负调控IFN-I 的信号转导作用[10];在小鼠胚胎成纤维细胞和骨髓巨噬细胞中也发现STAT3 蛋白对IFN 及其下游基因起负调节作用[11];而在新型肠道病毒71 型(EV71)感染时可以明显抑制STAT3 发生磷酸化,活化的磷酸化的STAT3 可抑制病毒复制,即敲低STAT3 蛋白可以促进病毒复制,提高STAT3 表达量则抑制病毒感染[12]。这也表明STAT3 蛋白影响病毒复制的过程是一种对病毒特异性的应答过程。本研究的试验结果表明,在降低STAT3 蛋白的内源性表达时接种PEDV,通过蛋白水平和mRNA 水平检测证明,STAT3 表达量降低可以明显抑制病毒在细胞内的复制;进一步探究发现STAT3 siRNA 转染组能够显著升高IFN 相关基因MxA,ISG15,IFN-β以及IFN-λ的mRNA 水平。本研究对于进一步阐明STAT3 参与PEDV 感染引发的免疫应答机制提供了试验依据。

