基于高分辨T2WI的影像组学对直肠癌术前分期的应用价值
王进,李智慧,沈浮,陆建平
直肠癌是世界范围内最常见的恶性肿瘤之一。在我国,随着人们生活习惯的改变及人口的老龄化,直肠癌发病率逐年增高,全国结直肠癌发病率及死亡率均位列第五位[1]。直肠癌患者最佳治疗方案的选择是一个非常复杂的过程,准确的术前评估是指导治疗决策的重要依据。肿瘤的精确分期可以提示患者治疗后的局部复发和远处转移风险,从而制定合理的治疗方案,达到最佳的个体化治疗策略。但目前传统影像学方法一般仅在形态学上对肿瘤进行术前评估,缺乏定量评估。基于精准医疗的要求,传统的影像医学模式亟待改变,必须与分子生物学、分子病理学结合,必须与新型治疗模式、预后判断和康复结合[2]。放射组学(radiomics)应用大量的自动化数据特征化算法,将影像兴趣区(region of interest,ROI)的影像数据转化为具有高分辨率的、可发掘的特征空间数据,具有数据维度高、定量分析等优点,可与传统影像学与分子生物学、分子病理学、信息科学相整合,采用大数据分析方法将其用于影像诊断、疗效评估、预后预测等,有望成为精准影像医学的重要基石[3-5]。因此本研究基于磁共振高分辨率T2WI图像,结合影像组学的方法,希望得到直肠癌术前T分期的影像组学特征,探讨基于高分辨率T2WI的影像组学方法对直肠癌特定病理特征的应用价值,并建立和验证影像组学直肠癌术前诊断模型。
材料与方法
1.患者资料
回顾性分析2017年1月-2018年12月在上海长海医院经手术病理证实且术前行直肠高分辨率T2WI检查的直肠癌患者的病例资料,获取原始DICOM数据并记录术后病理报告结果。排除标准:①图像质量差,如明显的伪影导致病灶显示欠清,无法准确勾画VOI;②患者手术前或MRI检查前后接受过任何的全身或局部治疗。根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第七版的分类标准进行病理诊断,记录患者术后病理T分期,将T1~T2期分为未突破肌层组,T3~T4期分为突破肌层组。
2.检查方法
磁共振扫描采用Siemens MAGNETOM Skyra 3T磁共振成像系统。所有患者检查前4 h禁食。检查前嘱患者使用一支开塞露(20 mL甘油)清洁肠道。采用腹部相控阵线圈。扫描序列均采用常规直肠MRI及高分辨率T2WI序列。常规序列包括矢状面T2WI脂肪抑制序列,横轴面T1WI及增强扫描、DWI。高分辨T2WI为斜横断面,扫描平面垂直于病灶所在肠管的长轴。扫描参数:TR 4000 ms,TE 108 ms,FOV 18 cm,矩阵320 × 320,层厚3 mm,层间距0,层数28层,反转角度150°,带宽108 Hz/像素。无脂肪抑制,GRAPPA并行采集模式,加速因子为3,平均累加次数2,回波链长度16,扫描时长为4分10秒。
3.影像组学方法
①病灶VOI分割和特征提取:将获取到的高分辨率T2WI原始DICOM图像导入后处理平台(大数据智能分析云平台,慧影医疗科技有限公司,北京),一名放射科医师采用手动方式在T2WI图像上沿病变边缘逐层勾画兴趣区(region of interest,ROI),计算机自动生成病灶的三维容积兴趣区(volume of interest,VOI),另一名高年资放射科医师检查勾画结果。将VOI使用上述平台自动提取影像组学特征,分为强度统计特征(19个)、形状特征(15个)、纹理特征,其中纹理特征包括灰度共生矩阵(gray level co-occurrence matrix,GLCM)27个、灰度游程矩阵特征(gray level run length matrix,GLRLM)16个及灰度区域矩阵(gray level size zone matrix,GLSZM)16个;以及对图像进行对数滤波、指数滤波、平方滤波、平方根滤波、小波变换(wavelet)等8种方式处理后再提取强度特征和纹理特征,共1029个放射组学特征。
②特征选择及降维:将上述获取到的全部特征采用LASSO算法(Least absolute shrinkage and selection operator,即最小绝对收缩算子)进行特征值降维,筛选各个特征在最佳平均最小误差时的变量系数(图1),选择对直肠癌术后T分期诊断有价值的特征。
③机器学习:将特征降维所获得的影像组学特征与术后T分期构建支持向量机(support vector machine,SVM)分类器模型。将全部样本分为训练集和验证集,随机选取70%病例作为训练集进行机器学习(machine learning,ML),并采用5折交叉验证方式进行验证以得出稳定的结果,利用剩余的30%病例作为验证集进行验证。使用受试者工作曲线(receiver operating characteristic curve,ROC)曲线下面积(area under the curve,AUC)以及敏感度和特异度评估机器学习模型的预测能力。
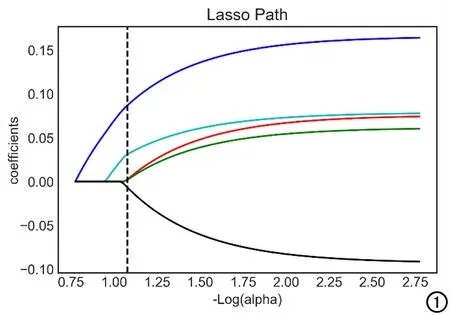
图1 LASSO算法系数解路径图。
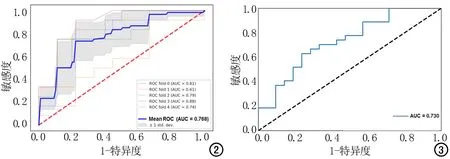
图2 SVM分类器训练集ROC曲线(5折交叉验证)。 图3 SVM分类器验证集ROC曲线。
1.临床资料
共纳入154例患者,男92例,女62例,年龄32~78岁,平均(56.5±10.2)岁,其中T1期26例,T2期41例,T3期76例,T4期11例。未突破肌层组共67例,突破肌层组共87例。经组织病理证实直肠腺癌142例,黏液腺癌10例,印戒细胞癌2例。全部手术病例均为单发病灶,环周切缘(circumferential resection margin,CRM)均为阴性。按7:3的比例随机分为训练集和验证集,其中训练集106例(其中未突破肌层组46例,突破肌层组60例),验证集48例(其中未突破肌层组21例,突破肌层组27例)。
2.影像组学特征
本组病例共生成的VOI为154个,共提取到1029个影像组学特征。通过LASSO算法筛选后,最终得到与T分期鉴别相关的特征5个:original_shape_size、waveletHLH_firstorder_medianvalue、waveletLLL_glszm_SZE、waveletLLL_glszm_SZLGE和waveletHHL_glcm_svarh。
3.分类器预测表现
上述5个影像组学特征与T分期构建的SVM分类器,训练集的平均ROC曲线的AUC、95% CI、敏感度及特异度为0.768、0.696~0.860、73.3%和73.9%(图2);验证集的AUC、95%CI、敏感度及特异度为0.730、0.583~0.848、73.1%和66.7%(图3)。
讨 论
直肠癌的术前诊断对于临床制定合理的个体化治疗决策是尤为重要的依据,依赖于精准的术前分期,包括肿瘤的浸润深度(T分期)等反应肿瘤侵袭性及影响预后的因素。术前推荐采用MRI进行评估,但目前依靠传统影像学方法一般仅在形态学上进行评估,有一定的主观性,缺乏定量评估。T2期/T3期的分期错误是较为常见的,通常T3期提示较高的局部复发及远处转移风险,因此很多文献强调T2期与T3期鉴别诊断[6]。两者在MRI上最重要的鉴别标准是病灶是否突破固有肌层,周围系膜脂肪是否受到侵犯,而肠周线状或索条状的信号因局部纤维化或炎症也可有类似的表现,文献认为有时很难区分真正的肿瘤浸润与结缔组织增生性反应[7],因此对T2期和早期T3期肿瘤常常很难鉴别。
现有研究证实影像组学可以为影像诊断提供新的思路和工具[8],影像组学(radiomics)方法是指对 CT、MRI和PET等大量医学图像高通量的提取定量影像学特征并进行分析,找到疾病的影像学标识物,从而实现对疾病的精准预测、诊断及预后评估等[4]。非侵入性的影像组学对于肿瘤的整体评估具有巨大的潜能,可对患者进行无损伤和可重复性检查[5]。目前,国内外学者对结直肠肿瘤的研究主要集中在病灶纹理特征提取、肿瘤与非肿瘤性病变的鉴别、结直肠癌术前分期、淋巴转移评估等方面[9-12]。
本研究对154例直肠癌病变的T2WI高分辨率图像进行特征提取,初始共1029个特征,包含两类特征。基于特征类:①一阶统计量特征(first order statistic),描述与ROI内的体素强度分布有关的特征,不包含它们之间相互的空间作用。②形状特征(shape based),包括描述VOI大小、形态等特征,例如体积、表面积、直径、致密度、偏心度、球形度等。③纹理特征(texture),是描述体素空间分布强度等级的特征,被视为一个灰度级,是一种视觉感知的图像局部特征的综合,描述同质性与异质性之间关系,包括:灰度级共生矩阵(gray level co-occurrence matrix,GLCM)、灰度级长度矩阵(gray level run length matrix,GLRLM)、灰度级形状矩阵(gray level size zone matrix,GLSZM)和领域灰度差分矩阵(neighborhood gray-tone difference matrix,NGTDM)。基于过滤器类:小波变换(wavelets)、拉普拉斯转换(laplacian transforms)、平方根(square root)、平方值(square)、对数特征(logarithm)、指数特征(exponential)等,表示通过不同滤波器的变换,可以表现出一些原图无法表现出的特征。
针对肿瘤是否侵犯突破肌层的判断,本研究根据术后病理结果将T1~T2期分为未突破肌层组,T3~T4分为突破肌层组,经LASSO算法降维后最终得到与直肠癌T分期鉴别相关的特征5个。机器学习结果显示SVM分类器验证集的AUC为0.730,敏感度73.1%,特异度66.7%,表明该分类器有优秀的判断肿瘤浸润是否突破肌层的能力。
SVM属于监督式学习,在对给定的数据进行逼近的精度与逼近函数的复杂性相结合来寻求最佳比例,以便取得最好的泛化能力。SVM算法简单地说,就是升维和线性化。升维有可能会引起“维数灾难”,人们很少问津,但是SVM方法通过应用核函数的展开定理巧妙地解决了因低维空间向高维空间做映射而增加计算复杂性这个难题:不需要知道非线性映射的显式表达式;由于是在高维特征空间中建立线性学习机,所以与线性模型相比,不仅几乎不会增加计算的复杂性,还会在某种程度上规避了“维数灾难”,这一方面核函数的展开和计算理论功不可没。
目前文献报道该模型应用于不同类型肺腺癌的鉴别[13]、膀胱癌分级评估[14]以及前列腺癌的检测[15]等方面。基于MRI的影像组学技术,通过提取医学图像中的大量影像学特征并进行高通量数据分析,建立分类模型,不仅规避了观察者本身对于图像解读的主观偏向,还能深度挖掘并整合图像中大量的人眼无法识别和区分的数字化信息,从而提高术前直肠癌分期的诊断效能,拥有了能够量化分析肿瘤异质性的能力。
本研究的局限性主要在于:第一,影像组学特征是从手动勾画的VOI中提取,很难避免肠壁形变对VOI产生的影响,且容易出现主观错误,这可能会影响纹理特征的准确性;第二,本研究属于回顾性研究,可能存在选择偏倚,没有纳入部分未行手术无病理结果的患者,这导致建立模型的样本量仍不够大且分布欠均衡,需扩大样本量以减少数据量对模型准确性的影响;第三,本研究是利用影像组学SVM模型对直肠癌的初步探索,尚未对N分期及远处转移进行分析,今后还需进一步研究。
综上所述,基于磁共振高分辨T2WI的影像组学SVM模型有助于判断肿瘤浸润是否突破固有肌层,对直肠癌术前T分期的诊断具有价值,可以作为直肠癌术前评估的有效手段。

