3D酰胺质子转移成像用于宫颈鳞癌和正常宫颈基质的鉴别诊断研究
何泳蓝,林澄昱,戚亚菲,王小奇,周海龙,李源,杨隽钧,孙昊,向阳,薛华丹,金征宇
酰胺质子转移(amide proton transfer,APT)成像2003年由Zhou等首次提出,作为化学交换饱和转移(chemical exchange saturation transfer,CEST)技术的发展及应用,能够无创性地检测内源性、位于细胞质内的游离蛋白质及多肽分子,从而间接反映活体细胞内部的代谢变化和病理生理信息[1-3]。大多数相关研究集中在中枢神经系统[2-3]。截止至今,APT技术在女性生殖系统领域的应用,国际上仅有5篇文献报道[4-8],国内尚未见相关文献。本文旨在探讨APT技术鉴别宫颈鳞癌与正常宫颈基质的价值,并将其与对宫颈癌有公认诊断价值的扩散加权成像(diffusion weighted imaging,DWI)进行比较。
材料与方法
1.临床资料
本研究获得伦理委员会批准,所有参与者均签署知情同意书。2017年9月-2018年9月前瞻性纳入27例宫颈鳞癌患者(年龄29~73岁,中位年龄45岁)及27例年龄匹配的正常志愿者(年龄26~72岁,中位年龄44岁)行盆腔MR成像。入组标准:①2018 FIGO IB期及以上,有肉眼可见肿瘤;②TCT或阴道镜病理证实为宫颈鳞癌;③MR检查前未接受相关治疗;④无合并影响宫颈区域的疾病。排除标准包括:①有MR检查禁忌,如体内金属植入物、幽闭恐惧症等;②图像伪影严重,影响参数测量。
2.MR检查
采用Philips Ingenia 3.0T CX磁共振成像系统进行盆腔MR扫描。检查前半小时使用10 mL开塞露灌肠以减少乙状结肠及直肠内的气体,扫描前排空膀胱。扫描序列包括T2WI、T1WI、DWI、APT、T1WI增强扫描。APT序列扫描参数包括:3D TSE横轴面采集,TR 7188 ms,TE 5.4 ms,FOV 300 mm×243 mm,矩阵120×96,空间分辨率2.5 mm×2.5 mm,层厚5 mm,层间距0 mm,层数9,TSE factor 158,SENSE factor 2,扫描时间7分33秒。DWI序列扫描参数包括:EPI横轴面采集,TR 4656 ms,TE 82 ms,视野300 mm×218 mm,矩阵100×72,空间分辨力3.0 mm×3.0 mm,层厚4 mm,层间距1 mm,层数25,EPI factor 55,SENSE factor 1.8,b值0、800 s/mm2。
3.图像分析
将原始数据导入Philips图像工作站(Intellispace Portal,v.10.1.0.64190)进行后处理。由两名经验丰富的放射科医生采用盲法分别参照T2WI、DWI及T1WI增强图像,在APT及ADC mapping图上选取宫颈鳞癌病灶最大层面及正常宫颈基质最大层面勾画兴趣区(ROI),计算机自动算出APT值及ADC值。APT值计算公式为[5]:
其中S(-3.5 ppm)corrected和S(+3.5 ppm)corrected是Z-spectrum上相对水峰位置在±3.5 ppm处进行饱和后测量到的影像信号,S(off resonance)是为了消除MT等现象的影响在远离±3.5 ppm的位置进行饱和后的信号,APT值表示为酰胺质子转移带来的相对水峰位置的Z-spectrum不对称程度。
4.统计学分析
采用SPSS 23及Prism 7数据分析软件。首先对各组数据进行正态分布检验和方差齐性分析。数据以平均值±标准差表示。采用观察者间组内相关系数(intraclass correlation coefficient,ICC)评价观察者间的测量一致性,ICC>0.75认为一致性良好。对于正态分布数据,采用独立样本t检验比较宫颈鳞癌和正常宫颈基质的APT值及ADC值。以P<0.05为差异有统计学意义。以ROC曲线评估APT值及ADC值鉴别宫颈鳞癌与正常宫颈基质的诊断效能。
结 果
1.宫颈癌患者病理分期
27例宫颈癌患者2018 FIGO分期为:Ⅰ期共8例(ⅠB1期3例,ⅠB2期4例,ⅠB3期1例),Ⅱ期共12例(ⅡA1期2例,ⅡB期10例),Ⅲ期共6例(ⅢC1期6例),Ⅳ期共1例(ⅣB期1例)。MR T2WI示病灶最大径为16~76 mm,平均(37.9±14.2) mm。
2.宫颈鳞癌及正常宫颈基质的APT值
宫颈鳞癌及正常宫颈基质APT值观察者间测量一致性良好(宫颈鳞癌:观察者间ICC为0.931,95%CI:0.855~0.968,正常宫颈基质:观察者间ICC为0.985,95%CI:0.968~0.993)。宫颈鳞癌APT测量ROI面积为(642.9±517.9) mm2,宫颈鳞癌平均APT值为2.80±0.36。正常宫颈APT测量ROI面积为(586.5±280.9) mm2,正常宫颈基质平均APT值为1.81±0.38。宫颈鳞癌APT值显著高于正常宫颈基质APT值(P<0.0001,95%CI:0.784~1.188,表1,图1~2)。
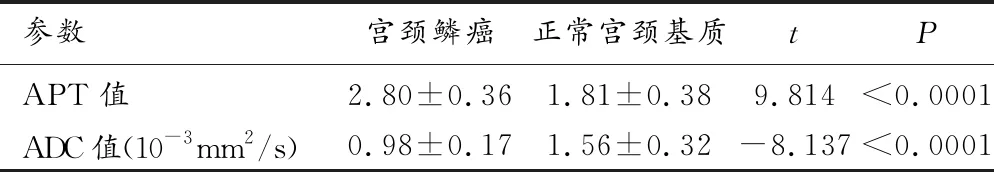
表1 宫颈鳞癌与正常宫颈基质的APT值及ADC值
3.宫颈鳞癌及正常宫颈基质的ADC值
宫颈鳞癌及正常宫颈基质ADC值观察者间测量一致性良好(宫颈鳞癌:观察者间ICC为0.980,95%CI:0.957~0.991;正常宫颈基质:观察者间ICC为0.997,95%CI:0.994~0.999)。宫颈鳞癌ADC测量ROI面积为(662.6±506.5)mm2,宫颈鳞癌平均ADC值为(0.98±0.17)×10-3mm2/s (表1,图1)。正常宫颈基质ADC测量ROI面积为(598.6±265.3)mm2,正常宫颈基质平均ADC值为(1.56±0.32)×10-3mm2/s(表1,图2)。宫颈鳞癌ADC值显著低于正常宫颈基质ADC值(P<0.0001,95%CI:-0.714~0.430)(表1,图3)。

图1 47岁,宫颈鳞癌。a) T2WI-APT融合图像,其宫颈鳞癌病灶APT值为2.68; b) ADC mapping图像,其宫颈鳞癌病灶ADC值为0.660×10-3mm2/s。 图2 45岁,正常志愿者的宫颈基质。a) T2WI-APT融合图像,其正常宫颈基质APT值为1.59; b) ADCmapping图像,其正常宫颈基质ADC值为1.74×10-3mm2/s。

图3 宫颈鳞癌与正常宫颈基质的APT值和ADC值比较。宫颈鳞癌APT均值显著高于正常宫颈基质APT值(P<0.0001),宫颈鳞癌ADC均值显著低于正常宫颈基质ADC值(P<0.0001)。 图4 APT值和ADC值鉴别宫颈鳞癌与正常宫颈基质的ROC曲线。APT值的AUC为0.996,稍高于ADC值的AUC 0.963。
4.APT值及ADC值鉴别宫颈鳞癌与正常宫颈基质的ROC曲线分析
APT值鉴别宫颈鳞癌与正常宫颈基质的ROC曲线下面积AUC为0.996,当阈值为2.228时,其鉴别诊断的敏感度和特异度分别为96.3%和100%(图4)。ADC值鉴别宫颈鳞癌与正常宫颈基质的ROC曲线下面积AUC为0.963,当阈值为1.22×10-3mm2/s时,鉴别两者的敏感度和特异度分别为100%和95%(图4)。
讨 论
APT成像是基于体内水分子与内源性酰胺质子的化学转移成像,能够间接反映肿瘤细胞中游离的蛋白质和多肽[9]。随着技术的不断发展优化,APT成像在肿瘤领域的临床价值被逐步认可,其研究热点除颅内肿瘤以外,研究者们相继报道了APT技术在乳腺肿瘤、前列腺癌、胸部肿瘤、头颈部肿瘤、直肠肿瘤等领域的应用[1-3,10-14]。
2018年3月日本学者Takayama等[4]首次报道了2D APT技术在女性生殖系统的应用,发现10例低分化子宫内膜样腺癌的APT信号强度显著高于11例高分化子宫内膜样腺癌的APT信号强度(P=0.01),其中38%(20/52)的病例因图像伪影严重而出组。基于Philips Ingenia 3.0T CX磁共振成像系统,北京协和医院团队报道了3D APT技术在64例宫颈癌的详细可行性研究,81.25%(52/64)病例APT图像质量良好,可用于APT值的定量评估[5]。同期,盛京医院团队报道10例低分化宫颈鳞癌的APT信号强度显著高于9例高分化鳞癌(P=0.0001)和12例中分化鳞癌(P=0.009),APT信号强度与宫颈鳞癌组织学分级中度相关(Spearman相关系数为0.684),优于SUVmax及SUVmin(Spearman相关系数分别为0.318和0.261)[6]。本研究同样采用3D TSE APT序列,侧重点在APT成像与成熟且公认的DWI成像对比,探究APT技术在宫颈鳞癌MR诊断中的额外临床价值。研究发现,宫颈鳞癌APT值显著高于正常宫颈基质APT值,在APT伪彩图中二者存在肉眼可见色阶差异,提示宫颈癌组织中活跃的游离蛋白和多肽增加,与既往类似研究结论一致[5]。并且,基于本研究样本鉴别宫颈鳞癌与正常宫颈基质,APT值展现出了稍高于ADC值的ROC曲线下面积。宫颈癌与正常宫颈基质ADC值的部分重叠,是目前宫颈癌MR诊断中的难点[15],而APT成像的应用有望为这部分疑难病例提供额外的诊断信息。
本研究存在以下局限性:①作为初步的探索,本研究样本量共计54例,研究结果有待后期大样本量数据的进一步验证。本研究纳入标准为肉眼可见的宫颈癌病灶,关注APT于更小的宫颈癌病灶的应用价值是下一步研究的方向。②受现有后处理软件所限,APT值和ADC值的测量只选择最大层面勾画ROI,未进行全体积评估,这是下一步的研究方向。③正常对照组选择了志愿者的正常宫颈基质,而未选择同一患者残瘤的正常宫颈基质,其原因主要是多数患者宫颈癌病灶较大(平均ROI 642.9 mm2),甚至整个宫颈区域均为病变占据,勾画残余正常宫颈基质在实际操作难度较大,故以年龄匹配的正常志愿者替代。
综上所述,APT值在宫颈鳞癌与正常宫颈基质的鉴别中展现了与ADC值近似的诊断效能。APT成像在宫颈鳞癌MR诊断领域具备潜在额外的临床价值。

