MR放射组学预测直肠腺癌患者神经周围侵犯的研究
杨彦松,冯峰,傅爱燕,段书峰,陈瑜凤,葛亚琼
直肠癌是男性和女性均较常见的恶性肿瘤[1],年龄小于50岁的人群患病率逐年增加,且在低年龄组中死亡率每年增加1%[2]。全直肠系膜切除术(total mesorectal excision,TME)是用于直肠癌治疗的标准经腹手术[3]。肿瘤神经周围侵犯(perineural invasion,PNI)是直肠癌患者转移扩散的可能途径[4],与预后不良有关[4-9]。因此术前准确预测评估PNI至关重要[3]。目前评估直肠癌PNI的影像学研究较少,本研究旨在探讨术前MR放射组学模型预测直肠癌患者PNI的价值。
材料与方法
1.一般资料
回顾性分析本院2016年12月-2019年7月经TME手术病理证实为直肠癌的患者136例。入组标准:①手术病理证实为直肠腺癌;②MR检查前未行放化疗、新辅助治疗等相关治疗;③术前1周内在本院行高分辨率直肠MR扫描。排除标准:①术后病理为粘液腺癌、肿瘤病灶含粘液分泌或其他病理类型的腺癌;②术前检查提示远处转移或患者身体不佳未行TME手术;③MR检查图像伪影较大,无法勾画病灶。136例直肠癌患者中,排除16例粘液腺癌,4例含分泌粘液的腺癌,3例神经内分泌肿瘤,3例腺瘤,最终共计110例患者入组,其中男76例,女34例,平均年龄(64.2±9.7)岁。
2.MR检查及方法
患者检查前禁食4h,检查前使用开塞露清洁肠道,采用Siemens Magnetom verio 3.0超导MR扫描仪及8通道体部表面相控阵线圈。患者取仰卧位,足先进。扫描范围设置为两侧髂棘到两侧腹股沟下缘。扫描方案参照文献报道方法[10],依次行脂肪抑制T2WI矢状面及冠状面、DWI扫描,然后在垂直于直肠肿瘤长轴方向行高分辨率轴位T2WI 扫描,最后行VIBE系列T1WI平扫和动静脉期增强扫描,扫描参数见表1。
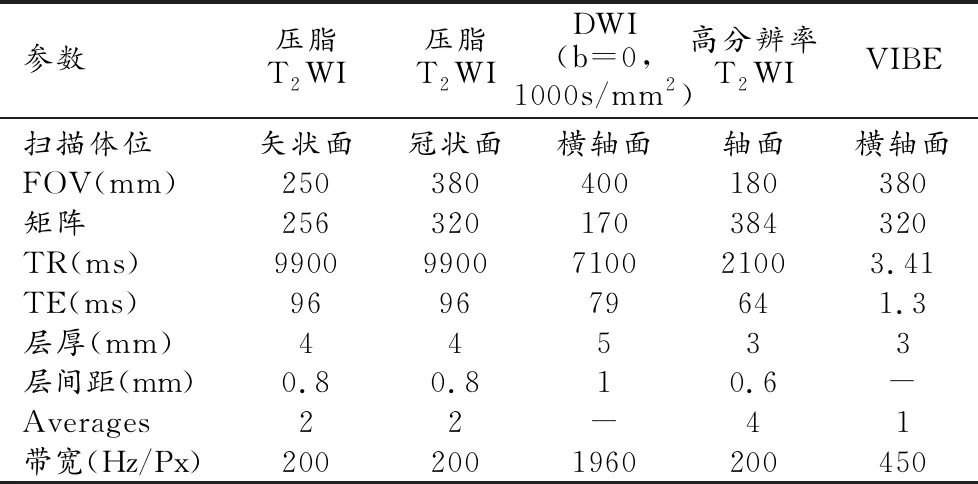
表1 直肠癌MR扫描参数
3.图像勾画
选取高分辨率T2WI横轴面病灶最大截面所在层面[11],使用ITK-SNAP3.8软件勾画病灶。
4.建立影像组学特征模型[12-14]
使用AK软件(GE healthcare,version 3.2.0)从图像中提取396特征,包括42个直方图特征,20个形态特征,334个纹理特征,将患者按13:7的比例分为训练集(72例)和验证集(38例)。训练集用于影像特征的筛选与建模,验证集用来评估模型的稳定性及可行性。首先采用最大相关最小冗余的方式对组学特征进行初步筛选,保留10个有最大预测效能的特征,然后将剩余的影像特征作LASSO回归分析,通过10折交叉验证筛选LASSO回归模型的最优超参数lambda值,在最优lambda值下,特征系数不为0的参数作为最终构建影像组学评分(Radscore)的特征。Radscore为最终所保留的特征与各自对应系数乘积的和,其公式为Radscore=截距+βi·Xi,按这个公式分别计算每一个样本的Radscore;并由样本的Radscore根据阈值对样本进行分类,评分大于阈值的样本归为一类,小于阈值的样本归为另一类,采用wilcoxon检验比较两组间Radscore的差异。ROC曲线分析用于评价模型的预测能力。首先得到训练集的ROC曲线,根据约登指数选择最优的判别阈值,进而得到模型在训练集上的效能。决策曲线分析用于分析模型的临床应用价值。在验证集中,根据影像组学评分公式计算出每个被测试的评分,得出验证集ROC曲线,利用训练集中所得到的阈值,判断模型在验证集上的预测效能。
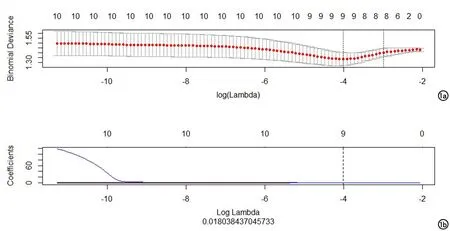
图1 采用LASSO 10折交叉验证图。a)用10倍交叉验证的方法寻找LASSO的超参数lambda,模型偏差最低点对应的横坐标为最优的lambda值,即第一个虚线所在位置;b)图中每条彩色的线代表特征的系数随lambda值的变化曲线,通过图a寻找到的lambda值(虚线代表的位置)来确定哪个参数的系数不为0,则该参数用于最后的模型构建。

表2 LASSO降维为最后保留的特征表
5.统计分析
本研究采用R语言(Version 3.5.1,www.R-project.org)进行统计学分析,“mRMRe”程序包采用最大相关最小冗余的方式对组学特征进行初步筛选,保留10个有最大预测效能的特征,“glmnet”程序包用于选择最佳的特征集合并进行LASSO回归分析,构建影像组学模型。ROC分析是基于“pROC”程序包来评估模型预测PNI的效能。“ModelGood”程序包用来进行模型的校准分析。“rmda”程序包用于绘制决策曲线,验证模型的临床价值。采用独立样本t检验、χ2检验及秩和检验比较训练集、验证集和PNI组和无PNI组年龄、性别、CEA的差异。以P< 0.05为差异具有统计学意义。
结 果
1.患者一般资料分析
训练集72例,验证集38例,两组年龄(65.6±9.7岁,64.4±9.8岁,t=0.363,P=0.719)、性别(男女比例50:22和26:12,χ2=0.012,P=0.912)、CEA[2.86(1.49,4.84)ng/mL,3.20(2.14,6.37)ng/mL,Z=-0.0990,P=0.322]差异均无统计学意义。术后病理提示有PNI的患者24例,无PNI的患者86例,PNI组和无PNI组两组间年龄(63.9±12.1岁,64.9±9.0岁,t=0.423,P=0.673)、性别(男女比例57:27和9:7,χ2=0.253,P=0.615)、CEA[3.20(1.94,4.88)ng/mL,2.90(1.68,6.12)ng/mL,Z=-0.004,P=0.997]差异无统计学意义。
2.构建放射组学预测模型
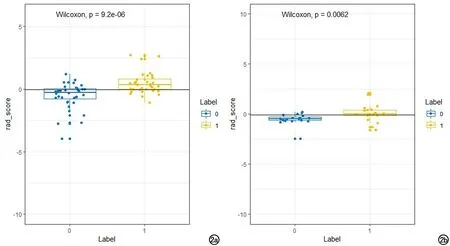
图2 wilcoxon检验。两组P值均<0.05,两组差异具有统计学意义。
首先采用最大相关最小冗余的方式对组学特征进行初步筛选,保留10个有最大预测效能的特征,然后将剩余的影像特征作LASSO回归分析,通过10折交叉验证筛选LASSO回归模型的最优超参数lambda值(图1)。LASSO降维为最后保留的特征见表2,特征系数绝对值越大,表明该特征与PNI之间的关系越大,预测价值越大。
3.计算影像组学模型的预测效能
Radscore是由模型构建的特征乘以对应的系数之和所得到,其公式为“Radscore=截距+βi·Xi”,按这个公式分别计算每一个样本的Radscore;并由样本的Radscore根据阈值对样本进行分类,评分大于阈值的样本归为一类,小于阈值的样本归为另一类,wilcoxon检验两组P值均<0.05,两组分类差异具有统计学意义(图2)。
Radscore=0.163*Correlation_angle135_offset7+-0.299*HighGreyLevelRunEmphasis_AllDirection_offset7_SD+0.339*LongRunLowGreyLevelEmphasis_AllDirection_offset1_SD+0.331*RunLengthNonuniformity_AllDirection_offset7_SD+-0.334*InverseDifferenceMoment_AllDirection_offset7_SD+0.448*ClusterProminence_angle135_offset7+0.282*LongRunHighGreyLevelEmphasis_AllDirection_offset1_SD+-0.647*ClusterShade_AllDirection_offset1_SD+-0.109*RunLengthNonuniformity_AllDirection_offset4_SD+-0.028
绘制该模型预测PNI的ROC曲线(图3),计算阈值时训练集和验证集的效能,训练集曲线下面积(area under the curve,AUC)为0.79,验证集AUC为0.76。
该模型的临床应用价值,决策曲线分析(decision curve analysis,DCA)显示阈值在0. 2~1较大的范围内,模型的净收益较大(图4),在这个阈值范围内使用模型来预测PNI相对安全。
讨 论
直肠癌术后病理提示PNI是术后病理诊断的一个内容,多项研究证实直肠癌患者PNI与较差的预后相关[4-9]。有PNI的直肠癌患者较无PNI的直肠癌患者总生存率(overall survival,OS)降低,无病生存率(disease free survival,DFS)降低,局部复发率(local recurrence,LR)增高。
一项纳入269例直肠癌切除术后生存分析的单中心回顾性研究发现,无PNI的患者较PNI患者的5年生存率提高了4倍[8]。Quah等[9]对448例II期直肠癌患者进行长期随访,中位随访时间约53个月,多变量分析显示PNI患者的5年DFS显著低于无PNI的患者(29% vs. 82%,P=0.0005)。III期的直肠癌患者有与上述研究类似的结果[7]。
一项纳入58项研究的22900例直肠癌患者的Meta分析[4]结果表明PNI与LR增加、5年无病生存率(5-year disease free survival,5yDFS)减少、5年癌症特异性生存率(5-year cancer-specific survival,5yCSS)减少和5年总生存率(5-year overall survival,5yOS)减少相关,多因素分析显示PNI是5yDFS,5yCSS和5yOS的独立预后因素。

图3 该模型预测PNI的ROC曲线。a)验证集;b)训练集。

图4 该模型的DCA。横坐标为阈值概率,绿色曲线表示所有样本都为阳性,都接受干预,黑色水平线表示所有样本都为阴性,不做任何干预;蓝色曲线表示阈值在0. 2~1较大的范围内,模型的净收益大于其它两种情况。
目前术前用现有的影像方法评估预测PNI相关研究较少。放射组学是目前新兴的研究热点,通过提取高通量的影像特征,分析其与疾病异质性的相关性,构建预测疾病异质性的模型[12-15]。如Park等[12]将294例接受术前MRI检查的浸润性乳腺癌患者随机分为训练组(n=194)和验证组(n=100),基于训练集中的弹性网络回归生成Rad-score,最终构建了结合Rad-score、MRI及临床病理学特征的放射组学列线图,结果显示在训练组和验证组中,较高的Rad评分与较差的DFS显著相关(P分别为0.002和0.036)。放射组学列线图估计DFS(C指数0.76,95%CI为0.74~0.77)优于临床病理学(C指数0.72,95%CI为0.70~0.74)或仅有Rad评分的列线图(C指数0.67,95%CI为0.65~0.69)[12]。Chen等研究回顾性分析487例病理诊断为非小细胞肺癌的增强CT图像,每个患者提取了511个放射组学特征,最终构建了基于9放射学特征的Rad-score,用于区分非小细胞肺癌的组织分化水平(训练集AUC=0.763,验证集AUC=0.782)[13]。Xu等[14]通过回顾性分析提取495名肝细胞癌患者的CT影像特征和临床特征,建立一个在肝细胞癌术前预测微血管侵犯(microvascular invasion,MVI)的模型,训练集AUC为0.909,验证集AUC为0.889,多因素回归分析显示Radscore计算的MVI概率、组织学MVI、肿瘤大小和Edmondson-Steiner等级与疾病特异性复发和死亡率独立相关。通过对诸如上述放射组学文献的阅读与思考,我们试图通过构建放射组学模型预测直肠癌PNI。本研究通过提取高通量的放射组学数据,成功构建有效稳定可行的预测直肠癌PNI的模型,能较好的预测PNI,训练集AUC为0.79,验证集AUC为0.76。
本研究有以下不足之处,首先样本量相对较少,尚待后期扩充样本量进行进一步研究;其次本研究中因所有入选患者均行TME,无T4期患者纳入,无法评估该模型在T4期患者中预测价值;最后本研究选取高分辨率T2WI轴位最大截面勾画病灶,非全体积,数据可能存在一定偏差。
总之,通过提取高通量的放射组学数据,建立预测直肠癌PNI的模型,能较好的预测PNI,早期评估预后。

