硬化性肺泡细胞瘤MRI表现一例
李扬, 时高峰,邓会岩
病例资料患者,女,51岁,5年前无明显诱因出现四肢凹陷性水肿,伴胸闷、气短。2月前症状加重,伴咳嗽、咳痰,为白色粘痰。7天前患者外院胸部CT检查示右肺下叶内侧基底段肿块,不除外恶性,建议穿刺活检。本院MRI检查示:右肺下叶内侧基底段肿块,大小3.0 cm×3.0 cm×2.5 cm,边缘光滑,反相位T1WI呈高信号(图1),T2WI呈稍高信号(图2),DWI呈不均匀高信号(图3),ADC值约(1.41~2.01)×10-3mm2/s,多期增强扫描呈渐进性明显强化(图4~6)。MRI诊断:右肺下叶内侧基底段肿块,考虑良性肿瘤,建议穿刺活检。3天后行CT引导下右肺肿块穿刺活检:患者取俯卧位,使用18G穿刺活检针,背侧入路,进针长度约8 cm,取完整组织条3条,穿刺过程顺利。穿刺病理诊断:硬化性肺泡细胞瘤,伴少量异型细胞。多学科会诊讨论建议手术切除。胸腔镜手术所见:肿块位于右肺下叶内基底段,大小约4.0 cm×3.5 cm×3.0 cm,质地较硬,邻近胸膜皱缩不明显,无法行局部切除,因此行右肺下叶切除术。术后病理诊断:硬化性肺泡细胞瘤(图7)。免疫组化结果:AE1/AE3(上皮细胞+),Vim(间质细胞+),TTF-1(+),EMA(+),P63(-),CD34(+),CK7(+),PR(间质细胞+),Ki-67(阳性细胞数3%)。
讨论硬化性肺泡细胞瘤(pulmary sclerosing pneumocytoma,PSP)是肺部的良性肿瘤,最早由Hubbell和Liebow于1956年报道[1]。最初,它被认为是血管起源,因此并被命名为肺硬化性血管瘤。于2015年,世界卫生组织正式将其命名为硬化性肺泡细胞瘤[2],并重新将其归类为“腺瘤”类别。随着免疫组化和病理学的发展,PSP被认为是起源于原始呼吸道上皮细胞,最可能起源于Ⅱ型肺泡肺细胞。病理上PSP的组织学形态由多种结构组成,主要包括实性区、硬化区、乳头区及血管瘤样区,病变多由不同结构按照不同比例混合组成[3]。
PSP好发于50岁以上中年人,常见于女性,女性与男性患病比例为5:1。大部分患者无特异性的临床表现,仅少部分患者有咳嗽、胸痛、痰中带血等症状。有文献报道,病灶越大或者部位越靠近肺门者,越有可能引起胸部不适症状。
虽然PSP是一种良性肿瘤,但是有个别报道发现其可发生淋巴结转移[4],但转移并不影响预后。手术切除是首选的治疗方法[5],而CT则是诊断PSP的主要影像学检查方法。大部分PSP的CT表现具有一般肺良性肿瘤的影像学特征,即表现为肺内边缘光滑、边界清楚的孤立性肿块或结节,可伴有钙化、囊变。PSP典型的CT征象有血管贴边征、空气新月征、肺动脉为主征、尾征、晕征等[6-9]。增强扫描后,根据病灶大小、组织成分比例的不同,早期可出现不同程度的强化,渐进性、延时持续性强化是其特征性表现[9-10]。
本例患者为中年女性,CT扫描可见右肺下叶肿块,影像表现为良性肿瘤的特征,但无法除外恶性,因此建议行CT引导下穿刺活检。MRI增强扫描能够一定程度反映病变组织的血流动力学特性[11],DWI成像能够间接反映肿瘤组织微观结构和功能状态的改变[12],两者结合可以明确穿刺活检取材的最佳部位。
有关PSP的MRI表现的研究罕见,国外仅见少数个案报道,国内暂无相关研究或个案报道。Fujiyoshi等[13]总结了2例PSP的MRI表现,并与术后病理进行对照,发现其MRI信号特点与其病理结构有关。其中1例PSP在T1WI序列上呈不均匀信号,与肌肉相比呈等信号或稍高信号;在T2WI序列上,与脂肪相比病变中心区域呈稍高信号,而边缘呈稍低信号。在抑脂T1WI增强图像上,病变局部区域可见明显强化,此明显强化的区域,与T2WI序列呈高信号的区域相一致,对应于病理切片上为丰富的血管瘤样腔隙结构。在T2WI序列上病变边缘的低信号,对应于病理上的纤维化和含铁血黄素相对丰富的区域。另外1例在T1WI序列上,病变的信号强度与脂肪组织接近,在T2WI序列上病变的信号强度稍高于脂肪组织,内可见点状低信号。在抑脂T1WI增强图像上,病变可见全瘤样明显强化,对应的病理为均匀分布的血腔样结构;T2WI序列上点状低信号对应的病理为含铁血黄素或纤维组织。Nakanishi等[14]对1例PSP行MRI多期增强扫描,病变于T1WI序列呈稍低信号,于T2WI序列呈稍高信号,增强扫描病变呈全瘤样强化,强化峰值出现在注射对比剂后2分钟。Kim等[15]使用1.5T MRI对1例PSP行动态增强扫描,于T1WI序列病变呈等或稍高信号,高信号区域对应病理上富含大量透明细胞的实性硬化区;于抑脂T2WI序列呈高信号,动态增强扫描此区域表现为早期强化,于2分钟后出现平台样持续强化,并未出现明显的强化峰值,此区域的强化方式与肿瘤内血管瘤样结构相对应,提示其为良性肿瘤。
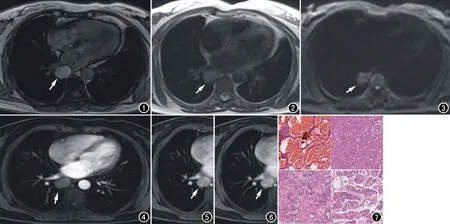
图1 反相位T1WI序列示右肺下叶内基底段肿块以高信号为主(箭),内可见局灶等或低信号。图2 T2WI序列示病变以为稍高为主(箭)。 图3 DWI序列示病变呈不均匀稍高信号(箭)。 图4 增强扫描动脉期病变轻度强化(箭)。 图5 增强扫描静脉期病变明显强化(箭)。 图6 增强扫描延时期病变进一步强化(箭)。 图7 术后病理切片示肿瘤内血管瘤样区、硬化区、实性区及乳头状区(×20,HE)。
本例PSP扫描使用3.0T MR,平扫T1WI上呈稍高信号,对应于病变的富含透明细胞的硬化区,于反相位信号无降低,提示病变高信号区域不含脂肪成分,据此可以排除错构瘤的诊断。T2WI上呈等或稍高信号,对应于病理上富含血管腔隙的血管瘤样结构;T2WI上的散在低信号对应于病理上的少量含铁血黄素及纤维成分。DWI上病变呈不均匀的高信号,此区域为肿瘤活性成分较高的区域,为CT引导下穿刺活检的最佳靶点。当b值为800 s/mm2时,其ADC值较高,约为(1.41~2.01)×10-3mm2/s,提示为良性病变,此与穿刺病理及术后病理结果相一致。增强扫描动脉期病变轻度强化,静脉期及延时期可见渐进性明显强化,提示PSP为富血供良性肿瘤,明显强化的区域对应于病理上的血管瘤样结构。本例PSP的MRI表现典型,信号特点及强化方式与PSP的病理结构有关,与国外文献报道基本相一致。
综上所述,PSP的MRI表现具有一定特征性,其信号特点与病理结构有关。MRI能够一定程度上反映肿瘤内部的不同病理结构及成分,从而精确定位穿刺活检的部位,以提高活检阳性率、明确病理诊断,为临床干预提供精确指导。目前,有关PSP的MRI表现的研究极少,因此我们还需要更多的病例总结和进一步的深入研究,以更准确的揭示PSP的MRI特征。

