NF-Y调控KLF4转录对乳腺癌细胞增殖、迁移的影响
曹晓智,高恬媛,汪俊茹,张根葆
(1 皖南医学院第二附属医院,安徽芜湖241000;2 皖南医学院病理生理学教研室)
近年来,我国乳腺癌的发病率呈明显上升趋势,已经成为严重威胁女性健康的恶性肿瘤之一。乳腺癌细胞的恶性增殖与迁移是造成患者死亡的最主要原因[1]。但目前对乳腺癌恶性生物学行为的分子机制仍不十分清楚。有研究通过转录组测序发现,在乳腺癌发生、发展过程中一系列基因的转录水平发生明显改变,而转录因子在基因的转录调控中发挥重要作用[2]。核因子Y(NF-Y)是一种普遍存在于高等真核生物中的转录因子,可通过结合到基因启动子上的Y-box来调节基因转录,从而促进肿瘤细胞的增殖、侵袭和迁移等[3]。有研究报道,乳腺癌组织NF-Y表达上调,其表达上调与患者预后不良密切相关[4]。Kruppel样因子4(KLF4)是一种含锌指修饰结构的蛋白,在转录起始复合物形成过程中具有先导分子的作用,能够促进转录起始复合物在启动子上的组装[5]。KLF4能够促进肿瘤细胞的恶性增殖和迁移,作为癌基因发挥相应的生物学功能[6]。有研究发现,KLF4基因启动子上存在一段Y-box序列,是NF-Y潜在的结合位点[7]。由此推测,NF-Y能够通过调控KLF4转录,从而促进乳腺癌细胞的恶性增殖和迁移。但目前缺少相应的研究证实。2018年2~12月,本研究对NF-Y通过调控KLF4转录来促进乳腺癌细胞的增殖和迁移进行验证。现报告如下。
1 材料与方法
1.1 材料 人乳腺癌细胞MCF-7、人胚胎肾上皮细胞HEK293T(以下分别称MCF-7细胞、HEK293T细胞),美国ATCC全球生物资源中心。PGL3-KLF4p、pCDH-NF-Y质粒,由本实验室构建。siNF-Y#1、siNF-Y#2、shCON慢病毒,由上海生工生物工程股份有限公司设计合成。7900HT型荧光定量PCR仪,美国ABI公司;ImageQuant LAS 4000化学发光成像分析仪,美国GE公司;Elx800酶标仪,美国Bio-Tek公司。逆转录试剂盒,美国Bio-Rad公司;Power SYBR Green PCR Master Mix,美国ABI公司;5-溴-2-脱氧尿嘧啶(EdU)细胞增殖检测试剂盒,赛默飞世尔科技(中国)有限公司。NF-Y、KLF4、Histone3、Sp1、IgG抗体,美国Abcam公司。proteinA/G琼脂糖珠,上海翊圣生物科技有限公司。
1.2 乳腺癌组织NF-Y表达与KLF4表达的关系分析 从TCGA数据库中下载乳腺癌的RNA-seq数据集,调取乳腺癌组织NF-Y、KLF4 mRNA表达数据,并分析二者的相关性。
1.3 稳定沉默NF-Y的乳腺癌细胞构建 pSIH慢病毒载体由三质粒表达系统构成,包括2个包装质粒和1个表达质粒,包装质粒为psPAX2、pMD2G质粒,在稳定沉默NF-Y的MCF-7细胞中用到的表达质粒为pSIH-shNF-Y#1或pSIH-shNF-Y#2,而在对照MCF-7细胞中用到的表达质粒为pSIH-shCON。将2个包装质粒及相应的表达质粒通过脂质体转染法共转染HEK293T细胞。转染72 h,收集培养上清液,获得shNF-Y#1、shNF-Y#2、shCON三种慢病毒。取3种慢病毒各1 mL,分别与1×106个MCF-7细胞混合,置于37 ℃、5% CO2的细胞培养箱中培养48 h,获得MCF-7-shNF-Y#1、MCF-7-shNF-Y#2、MCF-7-shCON细胞。
1.4 乳腺癌细胞NF-Y、KLF4 mRNA和蛋白表达检测 ①NF-Y、KLF4 mRNA表达检测:收集MCF-7-shNF-Y#1、MCF-7-shNF-Y#2、MCF-7-shCON细胞各1×106个,采用TRIzol法提取细胞总RNA,按逆转录试剂盒说明将总RNA逆转录为cDNA,按Power SYBR Green PCR Master Mix说明进行PCR扩增;引物序列:NF-Y上游引物5′-ACACGACCGGTAACGCTTAGAA-3′、下游引物5′-CCTCAACCCTGCACGCACACACT-3′,KLF4上游引物5′-CACATAAACCTTCCTTCTCT-3′、下游引物5′-TGTCCTCCCTGGCTGTTATCTACG-3′,GAPDH上游引物5′-GGTGAAGGTCGGAGTCAACG-3′、下游引物5′-TGGGTGGAATCACCGTGCTG-3′;以GAPDH为内参,采用2-ΔΔCT法计算目的基因相对表达量,实验重复3次,取平均值。②NF-Y、KLF4蛋白表达检测:收集MCF-7-shNF-Y#1、MCF-7-shNF-Y#2、MCF-7-shCON细胞各5×105个,经细胞裂解液裂解提取蛋白,蛋白定量合格后,加入上样缓冲液,100 ℃水浴充分变性,SDS-PAGE分离蛋白;电泳结束,将蛋白电泳产物转印至PVDF膜;3%脱脂牛奶封闭1 h,加入NF-Y、KLF4、GAPDH一抗,4 ℃孵育过夜;次日加入鼠源或兔源二抗,室温孵育1 h,ECL显影、曝光,Image J软件分析各蛋白电泳条带灰度值;以GAPDH为内参,以目的蛋白电泳条带灰度值与内参蛋白电泳条带灰度值的比值作为目的蛋白相对表达量,实验重复3次,取平均值。
1.5 细胞增殖能力检测 ①EdU插入法。选择MCF-7-shNF-Y#1、MCF-7-shNF-Y#2、MCF-7-shCON细胞接种于EdU检测配套专用培养板上,置于37 ℃、5% CO2的细胞培养箱中培养。培养24 h,吸弃培养基,3.7%多聚甲醛室温固定30 min,0.5% TritonX-100破膜处理30 min。按EdU细胞增殖检测试剂盒说明,先加入Click-iT reaction cocktail溶液避光反应30 min,再加入Hoechst溶液避光孵育30 min。在培养板中轴线上以中央点作为起点,每隔0.5 cm选取一个100倍视野,共选取5个视野,荧光显微镜下拍照。EdU阳性细胞呈绿色荧光,而Hoechst阳性细胞呈蓝色荧光。统计每视野中EdU阳性细胞和Hoechst阳性细胞,计算EdU阳性率。②磺酰罗丹明B(SRB)法。选择MCF-7-shNF-Y#1、MCF-7-shNF-Y#2、MCF-7-shCON细胞,以3×103个/孔接种于96孔板,置于37 ℃、5% CO2的细胞培养箱中培养。分别于培养24、48、72 h收集细胞,10%三氯醋酸室温固定1 h,蒸馏水冲洗,充分晾干。0.4% SRB于摇床上反应30 min,吸弃SRB,1%乙酸冲洗,充分晾干,Tris缓冲液溶解20 min,酶标仪于530 nm波长处检测各孔的光密度(OD)值。以OD530值代表细胞增殖能力。
1.6 细胞划痕愈合率检测 采用划痕实验。取MCF-7-shNF-Y#1、MCF-7-shNF-Y#2、MCF-7-shCON细胞各1×106个,接种于6孔板,置于37 ℃、5% CO2的细胞培养箱中培养。培养24 h,于6孔板底部划“十”字线,PBS轻轻冲洗,去除漂浮细胞,加入无血清培养基后立即拍照,测量此时划痕宽度。加入无血清培养基培养12 h,再次拍照测量划痕宽度。计算细胞划痕愈合率。
1.7 NF-Y对KLF4启动子的调节作用检测 ①采用染色质免疫共沉淀(ChIP)实验验证NF-Y能够结合到KLF4启动子上。取MCF-7细胞1×107个,3.7%多聚甲醛固定10 min,加入细胞裂解液裂解30 min,4 ℃下7 500×g离心10 min,吸弃上清液,向沉淀中加入核裂解液裂解30 min,超声破碎10~20 min。取4支离心管分别加入Histone3、Sp1、NF-Y、IgG抗体各10 μg(分别作为Histone3组、Sp1组、NF-Y组、IgG组),各组均加入proteinA/G琼脂糖珠50 μL和超声破碎后样品100 μL,4 ℃孵育过夜。另取1支离心管加入超声破碎后样品50 μL,作为Input组,4 ℃孵育过夜。次日,PBS清洗proteinA/G琼脂糖珠6~8次,Elution缓冲液洗脱,以Input组、Histone3组、Sp1组、NF-Y组、IgG组洗脱液作为PCR反应的模板进行PCR扩增,Marker选择1 kb plus DNA ladder。扩增程序:95 ℃ 5 min,95 ℃ 20 s、60 ℃ 40 s、 72 ℃ 1 min共35个循环,最后72 ℃ 10 min。取扩增产物10 μL行琼脂糖凝胶电泳,显微镜下拍照观察。②采用双荧光素酶报告基因实验验证NF-Y能够激活KLF4启动子。选择HEK293T细胞,随机分为PGL3-Basic+vector组、PGL3-Basic+NF-Y组、PGL3-KLF4p+vector组、PGL3-KLF4p+NF-Y组,PGL3-Basic+vector组转染PGL3-Basic、vector质粒,PGL3-Basic+NF-Y组转染PGL3-Basic、NF-Y质粒,PGL3-KLF4p+vector组转染PGL3-KLF4p、vector质粒,PGL3-KLF4p+NF-Y组转染PGL3-KLF4p、NF-Y质粒。转染48 h后,用1×Passive Lysis Buffer裂解15 min,12 000 r/min离心10 min,弃沉淀,吸取上清液20 μL,置于黑色96孔板中,应用酶标仪自动上样检测荧光素酶活性。
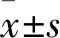
2 结果
2.1 乳腺癌组织NF-Y mRNA表达与KLF4 mRNA表达的关系 从TCGA数据库下载的乳腺癌RNA-seq数据集中随机抽取100例份,乳腺癌组织NF-Y、KLF4 mRNA相对表达量分别为12.50±1.49、8.22±2.51。Pearson相关分析显示,乳腺癌组织NF-Y mRNA表达与KLF4 mRNA表达呈正相关关系(r=0.444,P<0.05)。
2.2 三种乳腺癌细胞NF-Y、KLF4表达比较 见表1。
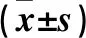
表1 三种乳腺癌细胞NF-Y、KLF4 mRNA和蛋白相对表达量比较
注:与MCF-7-shCON比较,*P<0.05。
2.3 三种乳腺癌细胞增殖能力比较 EdU插入法结果显示,MCF-7-shCON、MCF-7-shNF-Y#1、MCF-7-shNF-Y#2细胞EdU阳性细胞数分别为(38.42±5.91)、(24.51±3.77)、(21.32±3.28)个,Hoechst阳性细胞数分别为(52.81±8.12)、(54.63±8.40)、(55.67±8.56)个,EdU阳性率分别为73.08%、44.45%、38.18%,MCF-7-shNF-Y#1、MCF-7-shNF-Y#2细胞EdU阳性率均低于MCF-7-shCON细胞(P均<0.05),而MCF-7-shNF-Y#1细胞与MCF-7-shNF-Y#2细胞比较P>0.05。三种乳腺癌细胞SRB法增殖能力比较表2。
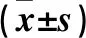
表2 三种乳腺癌细胞培养不同时间增殖能力比较
注:与MCF-7-shCON培养同时间比较,*P<0.05;与同细胞培养24 h比较,#P<0.05;与同细胞培养48 h比较,△P<0.05。
2.4 三种乳腺癌细胞划痕愈合率比较 MCF-7-shCON、MCF-7-shNF-Y#1、MCF-7-shNF-Y#2细胞0 h划痕宽度分别为(97.81±15.05)、(99.24±15.27)、(98.49±15.08)μm,12 h划痕宽度分别为(11.73±1.83)、(61.82±9.57)、(64.58±9.68)μm,划痕愈合率分别为88.67%、38.39%、34.69%。MCF-7-shNF-Y#1细胞和MCF-7-shNF-Y#2细胞划痕愈合率均低于MCF-7-shCON细胞(P均<0.05),而MCF-7-shNF-Y#1细胞与MCF-7-shNF-Y#2细胞比较P>0.05。
2.5 NF-Y与KLF4启动子的关系验证 ChIP实验结果显示,在Input组、Histone3组、Sp1组、NF-Y组均检测到相应的PCR产物,表明MCF-7细胞中存在KLF4启动子的序列,并且Histone3、Sp1、NF-Y能够结合到KLF4启动子上;IgG组则未检测到相应的PCR产物,表明实验过程无蛋白非特异性结合。双荧光素酶报告基因实验结果显示,PGL3-Basic+vector组、PGL3-Basic+NF-Y组、PGL3-KLF4p+vector组、PGL3-KLF4p+NF-Y组荧光素酶活性分别为0.12±0.09、0.54±0.15、0.15±0.11、2.78±0.79。荧光素酶活性PGL3-Basic+NF-Y组高于PGL3-Basic+vector组,PGL3-KLF4p+NF-Y组高于PGL3-KLF4p+vector组,PGL3-KLF4p+NF-Y组高于PGL3-Basic+NF-Y组(P<0.05);PGL3-Basic+vector组与PGL3-KLF4p+vector组荧光素酶活性比较P>0.05。
3 讨论
乳腺癌是女性最常见的恶性肿瘤,也是导致女性癌症死亡的重要原因[8]。有研究报道,乳腺癌的高病死率和预后不良在很大程度上与肿瘤细胞的恶性增殖、侵袭和迁移有关[1]。但目前对乳腺癌恶性生物学行为的分子机制仍不十分清楚[9,10]。因此,探索乳腺癌恶性生物学行为的分子机制对其靶向治疗和预后评估具有重要意义。
NF-Y是一种普遍存在于高等真核生物中的转录因子,最早在肝癌中发现。在肝癌细胞中,NF-Y通过与FGF4的启动子区域结合,从而调控FGF4基因的转录,继而促进肝癌细胞的恶性增殖[11]。高通量测序结果显示,NF-Y的主要结合区域位于基因启动子上的Y-box序列,Y-box序列存在于少数基因的启动子区域,如VEGF、MKP-1等,这类基因在肿瘤细胞的增殖、侵袭和迁移等恶性生物学行为中具有重要作用[12]。KLF4是一种含锌指修饰结构的蛋白,是转录起始复合物的重要成分,在p53的转录过程中发挥重要作用,而p53是一种重要的肿瘤抑制基因[13]。KLF4能够被MKP-1磷酸化,磷酸化修饰后的KLF4可进入细胞核并结合到p53上,抑制YB1、YY1、BCL6等转录因子结合到p53基因的启动子上,从而抑制p53表达,进而促进恶性肿瘤细胞增殖[14]。有研究报道,KLF4的启动子区域存在一段典型的Y-box序列,是NF-Y潜在的结合位点[15]。由此推测,NF-Y能够通过结合到KLF4基因启动子上的Y-box区域来调控KLF4基因的转录,从而促进乳腺癌细胞的恶性增殖和迁移。但目前缺少相应的研究证实。
本研究首先从TCGA数据库中下载乳腺癌的RNA-seq数据集,调取乳腺癌组织NF-Y、KLF4 mRNA表达数据,并分析二者的相关性。结果发现,乳腺癌组织NF-Y mRNA表达与KLF4 mRNA表达呈正相关关系,提示在乳腺癌中NF-Y与KLF4确实存在一定的相互联系。为进一步验证NF-Y对KLF4表达具有调控作用,本研究沉默MCF-7细胞NF-Y表达,结果发现,MCF-7-shNF-Y#1、MCF-7-shNF-Y#2细胞KLF4 mRNA和蛋白表达均明显下调,表明NF-Y能够在转录水平上调控KLF4表达。为证实NF-Y在乳腺癌细胞的增殖与迁移中具有一定作用,本研究采用EdU插入法、SRB实验和划痕实验检测了三种乳腺癌细胞的增殖和迁移能力,结果发现,MCF-7-shNF-Y#1、MCF-7-shNF-Y#2细胞的增殖和迁移能力均低于MCF-7-shCON细胞,提示NF-Y表达与乳腺癌细胞的增殖和迁移密切相关。基因转录主要通过转录因子、增强子、超级增强子和组蛋白甲基化等调控[16]。有研究报道,KLF4可通过调控一系列与细胞周期相关基因的表达来影响细胞周期进程,进而调控细胞增殖[17]。有研究还发现,KLF4能够调控黏附相关分子的表达,从而影响乳腺癌转移[18]。但NF-Y是否通过调控KLF4转录来促进乳腺癌细胞的增殖和迁移尚不清楚。为进一步证实NF-Y对KLF4转录调控的分子机制,本研究通过ChIP实验和双荧光素酶报告基因实验来验证NF-Y能够结合到KLF4的启动子上并激活KLF4启动子。ChIP实验结果显示,Input组、Histone3组、Sp1组、NF-Y组均检测到相应的PCR产物,而IgG组未检测到相应的PCR产物,提示Histone3、Sp1、NF-Y能够结合到KLF4启动子上;双荧光素酶报告基因实验结果显示,荧光素酶活性PGL3-Basic+NF-Y组高于PGL3-Basic+vector组,PGL3-KLF4p+NF-Y组高于PGL3-KLF4p+vector组,PGL3-KLF4p+NF-Y组高于PGL3-Basic+NF-Y组,而PGL3-Basic+vector组与PGL3-KLF4p+vector组荧光素酶活性比较差异无统计学意义,表明NF-Y通过激活KLF4启动子进而上调KLF4转录。Testa等[12]研究发现,NF-Y能够结合到一系列基因的启动子上对基因的转录进行调控。NF-Y还能够与Histone3、Sp1等与乳腺癌相关的转录因子相互作用,影响这些转录因子的活性[19]。NF-Y结合到KLF4启动子上,通过与其他蛋白的相互作用将转录复合体的蛋白组分招募到KLF4启动子附近,并组装成相应的转录起始复合物,转录起始复合物结合到KLF4启动子上从而激活KLF4基因转录,继而促进乳腺癌细胞的增殖和迁移。
综上所述,NF-Y能够通过调控KLF4转录促进乳腺癌细胞的增殖和迁移。

