不同品种猕猴桃果实的抗氧化活性研究
赵燕妮, 李 悦, 雷 靖, 张俊杰, 张 坤,陈 丹,任嘉敏, 庞子远, 陈雪峰,4, 王 勇,4
(1.陕西科技大学 食品与生物工程学院, 陕西 西安 710021; 2.陕西省农村科技开发中心 陕西省猕猴桃工程技术研究中心, 陕西 西安 710054; 3.山西大学 大型科学仪器中心, 山西 太原 030006; 4.陕西农产品加工技术研究院, 陕西 西安 710021)
0 引言
自由基是一类在机体氧化反应过程中产生的具有强氧化性的有害物质,会损害机体的组织和细胞,而且自由基的损伤会随着年龄的增长而加剧,加速衰老,并伴随一些慢性疾病如癌症、心血管疾病、动脉硬化、炎症等的发生[1].降低人体内自由基的含量,不仅要靠自身的清除系统,还要靠外部抗氧化剂的帮助,由于化学合成的抗氧化剂对人体健康具有潜在危害,所以对植物中的天然抗氧化活性研究逐渐受到国内外学者的青睐[2].研究表明,许多水果中有丰富的抗氧化活性物质(如维生素E、维生素C、黄酮、多酚类物质等),这些天然的抗氧化物质能有效清除体内自由基,延缓机体衰老,增强机体免疫力[3].
猕猴桃属猕猴桃科(Actinidia arguta Sieb Zucc.),又名狐狸桃、藤梨、羊桃、毛木果等.猕猴桃营养价值丰富,其味道鲜美、深受人们喜爱.猕猴桃被誉为天然维C之冠,每100 g新鲜猕猴桃维生素C的含量是甜橙的2~8倍,柑橘的3~14倍,苹果的20~84倍,梨的30~140倍[4].此外,猕猴桃还富含多种矿物质和各类氨基酸,有清热利水、散瘀止血、降血脂和抗肿瘤的作用[5].猕猴桃中含有的多糖、黄酮、多酚等活性物质有很强的抗氧化能力,已有研究表明,多酚类物质具有预防癌症、抑郁症、心血管疾病以及减肥健美、增强免疫功能等功效[6].
我国是猕猴桃种植大国,陕西周至是猕猴桃的重要产区,周至县环境适宜、猕猴桃栽培面积至今已达到3 000亩[7],有徐香、华优、哑特、海沃德等不同品种.不同猕猴桃之间营养成分存在差异,所以不同品种猕猴桃抗氧化活性的差异值得关注.
本次实验选用周至县产量较大的三个品种:徐香、哑特和海沃德为研究对象,分别测定其DPPH·自由基、羟基自由基(·OH)、ABTS+·自由基的清除能力以及对铜离子的螯合能力,为研究不同品种猕猴桃体外抗氧化活性差异,为进一步筛选优良品种及开发天然抗氧化剂提供理论依据.
1 材料与方法
1.1 材料与仪器
(1)主要材料与试剂
三个猕猴桃品种(海沃德、徐香、哑特)于2017年10月采自陕西周至县陕西佰瑞猕猴桃研究院,采摘猕猴桃时选用八成熟且大小统一的猕猴桃果实.
过硫酸钾、磷酸二氢钠、硫酸亚铁、过氧化氢、抗坏血酸、硫酸铜、氯化亚铁、甲醇、乙醇,购自天津市科密欧化学试剂有限公司.DPPH、ABTS、水杨酸、邻苯二酚紫、菲咯嗪,购自上海瑞永生物科技有限公司.
(2)主要仪器设备
JA2003型电子分析天平,赛多利斯科学仪器有限公司;真空冷冻干燥机,美国西蒙公司;冷冻高速离心机,德国Eppendorf公司;组织捣碎机,陕西环宇仪器公司;UV-2401PC型紫外可见分光光度计,日本SHIMADZU公司;水浴锅,北京科伟永兴仪器有限公司;移液器,德国Eppendorf公司;PHS-25型数显pH计,上海仪电科学仪器股份有限公司.
1.2 实验方法
1.2.1 DPPH·自由基清除能力的测定[8-10]
(1)标准曲线的制作
准确称取2 mg抗坏血酸标准品并溶解于8 mL去离子水中,得浓度为0.25 mg/mL的抗坏血酸溶液.用去离子水分别稀释成0.225 mg/mL、0.2 mg/mL、0.15 mg/mL、0.125 mg/mL、0.1 mg/mL、0.075 mg/mL、0.05 mg/mL、0.025 mg/mL的系列标准溶液.称取2 mg的DPPH·溶解到70 mL无水甲醇中,浓度为28 mg/L,现配现用.分别取100μL标准溶液与3.9 mL的DPPH·甲醇溶液于10 mL离心管中,涡旋10 s,在室温条件下避光反应30 min,在517 nm处测吸光度(As),以蒸馏水为空白,测定吸光度(Ac),根据公式(1)计算DPPH·自由基清除率,重复三次.以抗坏血酸浓度为横坐标,自由基清除率为纵坐标,绘制标准曲线.
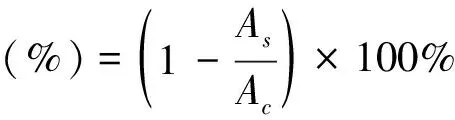
(1)
式(1)中:As为试验组值;Ac为空白组值.
(2)样品清除DPPH·自由基能力的测定
取出样品猕猴桃,解冻1 h,在组织捣碎机中打碎,抽滤得滤液,将滤液于4 ℃,14 000 rpm条件下离心10 min,吸取上清液,用去离子水稀释5倍后,取100μL样品稀释液加到3.9 mL的DPPH·甲醇溶液中,避光反应30 min后在517 nm波长处测定吸光度(As),以蒸馏水做空白对照,测得其吸光度(Ac),自由基清除率计算方法同式(1).三种猕猴桃以同样的方法处理,并且每组做三次平行.
1.2.2 ABTS+·自由基清除能力的测定[11,12]
(1)标准曲线的制作
准确称取2 mg抗坏血酸标准品并溶解于5 mL去离子水,得到浓度为0.4 mg/mL的抗坏血酸溶液.再分别用去离子水稀释成0.4 mg/mL、0.3 mg/mL、0.2 mg/mL、0.1 mg/mL、0.05 mg/mL、0.01 mg/mL的系列标准溶液.称取ABTS+·0.096 0 g和过硫酸钾0.0116 g,用去离子水定容至25 mL容量瓶中,用锡箔纸包裹摇匀,室温避光条件下反应12~16 h,得到ABTS+·储备液.使用前用10 mmol/L磷酸盐缓冲液(pH=7.4)稀释,其在734 nm处的吸光度为0.700(±0.020),作为ABTS+·工作液.准确吸取30μL抗坏血酸稀释液与2970μL ABTS+·工作液充分混匀.记录时间,反应10 min后,734 nm处测定吸光度值(As),以水作为空白对照,测定其吸光度(Ac).ABTS+·自由基清除能力计算方法同1.2.1中公式(1).
(2)样品清除ABTS+·自由基能力的测定
猕猴桃样品前处理同1.2.1,得到的上清液稀释10倍.准确吸取30 μL样品稀释液与2 970μL的ABTS+·工作液充分混匀,反应10 min后在734 nm处测吸光度值(As),以蒸馏水做空白对照测得吸光度(Ac),自由基清除率计算方法同1.2.1中式(1).三种猕猴桃用同样的方法处理,并且每组做三次平行.
1.2.3 羟自由基(·OH)清除能力的测定[13]
(1)标准曲线的制作
准确称量4 mg抗坏血酸标品,用10 mL去离子水溶解,得到0.4 mg/mL的抗坏血酸溶液.分别用去离子水稀释成0.4 mg/mL、0.375 mg/mL、0.35 mg/mL、0.325 mg/mL、0.3 mg/mL、0.275 mg/mL、0.25 mg/mL的系列标准溶液.加不同浓度的抗坏血酸稀释液于各离心管中,再依次加入1 mL FeSO4(9 mmol/L)溶液,1 mL水杨酸-乙醇(9 mmol/L)溶液,最后加入1 mL的H2O2(8.8 mmol/L)启动反应,充分混匀后在37 ℃条件下水浴20 min,以水为参比在510 nm处测吸光度(As),以蒸馏水做空白对照,测其吸光度值(Ac),羟基自由基(·OH)清除率计算方法同1.2.1中公式(1).
(2)样品中羟基自由基(·OH)清除能力的测定
从-20 ℃冰箱取出样品猕猴桃,样品前处理方法同1.2.1得到上清液,稀释10倍.加1 mL样品于10 mL离心管中,再依次加入1 mL的FeSO4(9 mmol/L),1 mL水杨酸-乙醇(9 mmol/L),最后加入1 mL的H2O2(8.8 mmol/L)启动反应,充分混匀后在37 ℃水浴锅内水浴20 min,冷却,以水为参比在510 nm处测吸光度(As),以蒸馏水做空白对照,测其吸光度值(Ac),计算方法同1.2.1中公式(1).三种猕猴桃用同样的方法处理,并且每组做三组平行.
1.2.4 Cu2+螯合能力的测定[14,15]
(1)标准曲线的制作
称取100 mg抗坏血酸,加入10 mL去离子水溶解,得到浓度为10 mg/mL的抗坏血酸溶液.用去离子水稀释成10 mg/mL,8 mg/mL,6 mg/mL,5 mg/mL,2 mg/mL,1 mg/mL的系列标准溶液.在通风橱下,佩戴一次性手套,用移液枪准确吸取1 mL吡啶(10%)试剂于10 mL试管中,分别加入20μL邻苯二酚紫试剂(0.1%)和1 mLCuSO4溶液(2 mmol/L)充分混匀,再加入1 mL不同浓度的抗坏血酸溶液涡旋,测定632 nm处吸光度值,同时做空白对照.Cu2+螯合能力(%)计算公式如式(2)所示:
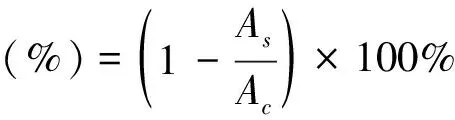
(2)
式(2)中:As为试验组值;Ac为空白组值.
(2)样品Cu2+螯合能力的测定
取出样品猕猴桃,解冻1 h后打碎、抽滤得滤液,将滤液在4 ℃,14 000 rpm条件下离心10 min,吸取上清液为样品液.加1 mL吡啶(10%)试剂于10 mL试管中,依次加入20μL邻苯二酚紫试剂(0.1%)和1 mL CuSO4溶液(2 mmol/L),1 mL样品液涡旋混匀,测定632 nm处吸光度值(As).以1 mL纯水作为空白对照,测定其吸光度(Ac).Cu2+螯合能力(%)用式(2)计算.三种猕猴桃用相同的方法处理,每组做三次平行.
1.2.5 统计学分析
所有试验均重复三次,计算平均值,试验数据表示:平均值±标准偏差.
2 结果与讨论
对于猕猴桃的抗氧化活性,发挥作用的主要是其含抗坏血酸和多酚等抗氧化剂[16].因反应机理的不同特性、组成的复杂性,每种方法有一定的局限性,水果、蔬菜和其他植物的抗氧化活性不能仅通过一种自由基清除实验进行评估[17].从方法的角度而言,DPPH·、ABTS+·和·OH自由基清除试验被推荐为评定水果、果汁和蔬菜提取物自由基清除活性的简单而准确的方法.因此,本实验以DPPH·、ABTS+·和·OH自由基清除能力为指标,对不同猕猴桃品种的抗氧化活性进行研究.
2.1 不同猕猴桃品种清除DPPH·自由基能力
2.1.1 DPPH·自由基清除率的变化趋势
DPPH·是一种有机自由基,自由基清除剂能使DPPH·溶液褪色,通过吸光度的变化可对其进行定量分析[18].试验结果如图1(a)所示,在DPPH·自由基清除实验中不同浓度的抗坏血酸都具有一定的自由基清除能力,并且自由基清除率在抗坏血酸浓度小于0.2 mg/mL范围内随着抗坏血酸浓度的增高而增加,但是当抗坏血酸浓度高于0.2 mg/mL后,DPPH·自由基清除率趋于平缓.本实验采用线性变化范围内的7个浓度点(0.025~0.2 mg/mL)绘制标准曲线,求得相关系数R2=0.997,如图1(b)所示,回归方程为:
y=4.798x+0.020 7
(3)
式(3)中:y—自由基清除率;x—抗坏血酸浓度,mg/mL.
因此抗坏血酸浓度在0.025~0.2 mg/mL范围内与DPPH·自由基清除率具有良好的线性关系.
采用相同的实验方法,依照标准曲线求得不同品种的猕猴桃果实DPPH·自由基清除率,如图1(b)所示,其中红、蓝和黄色分别代表海沃德、哑特及徐香三个品种的猕猴桃果实.
由图1可知,三个品种猕猴桃果实的DPPH·自由基清除率的范围在20%~80%之间.其中海沃德样品的DPPH·自由基清除率为24.88%,代入式(3)得到对应的抗坏血酸浓度为0.05 mg/mL;同理,哑特样品的DPPH·自由基清除率和对应的抗坏血酸浓度分别为52.23%和0.10 mg/mL;徐香样品的DPPH·自由基清除率和对应的抗坏血酸浓度为69.88%和0.14 mg/mL.结果表明不同品种猕猴桃果实对DPPH·自由基的清除率差异较大,且DPPH·自由基清除率强弱顺序为徐香>哑特>海沃德.
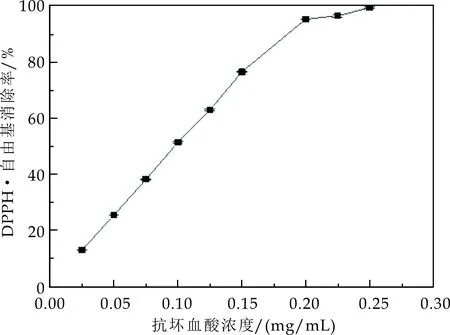
(a)DPPH·自由基清除率随抗坏血酸浓度变化趋势
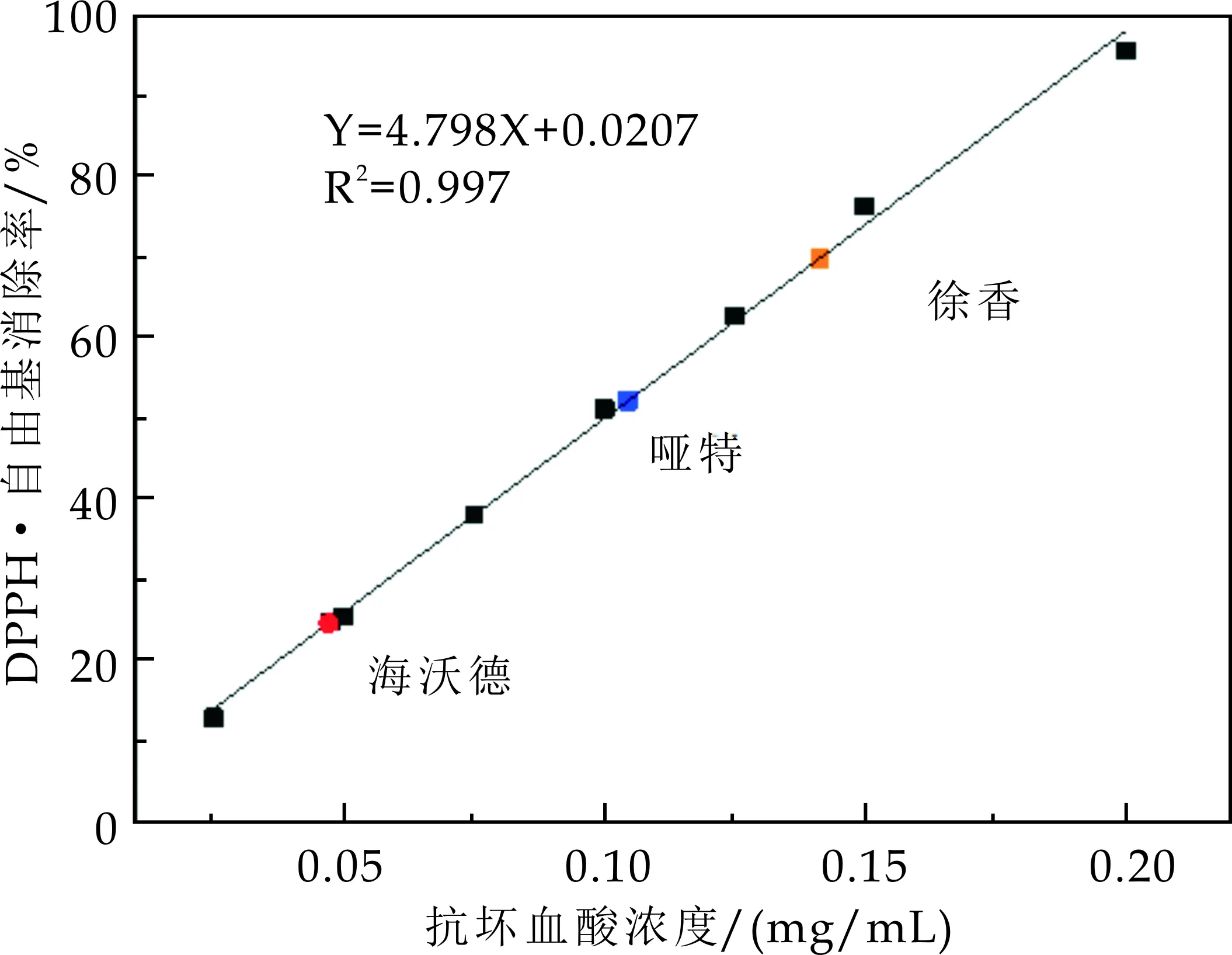
(b)DPPH·自由基清除率标准曲线图1 不同浓度抗坏血酸对DPPH·自由基清除
2.1.2 不同品种猕猴桃DPPH·自由基清除能力
将不同品种猕猴桃果实的自由基清除率转换为抗坏血酸当量,抗坏血酸当量越大,说明抗氧化能力越强[19].抗坏血酸当量的计算公式为式(4),结果如图2所示.

图2 不同品种猕猴桃清除DPPH·自由基能力(*表示具有显著性差异,p<0.05)
由图2可见,海沃德、哑特、徐香品种的抗坏血酸当量分别为0.45μmol/100 g、0.99μmol/100 g、1.34μmol/100 g.哑特的抗坏血酸当量是海沃德的2.20倍,徐香的抗坏血酸当量是海沃德的2.98倍,徐香的抗坏血酸当量是哑特的1.34倍.因此,三个品种猕猴桃果实的抗氧化能力顺序是徐香>哑特>海沃德,此结论与对抗坏血酸浓度测定结论一致.用T-text进行统计学分析,结果表明三个品种两两之间均具有显著性差异.
抗坏血酸当量计算公式如下:
(4)
式(4)中:A—通过标准曲线计算的抗坏血酸浓度,mg/mL;B—加入样品的体积,mL;C—样品的稀释倍数;D—抗坏血酸当量,μmol/100 g;E—抗坏血酸的相对分子量.
2.2 不同品种猕猴桃清除ABTS+·自由基能力
2.2.1 ABTS+·自由基清除率的变化趋势
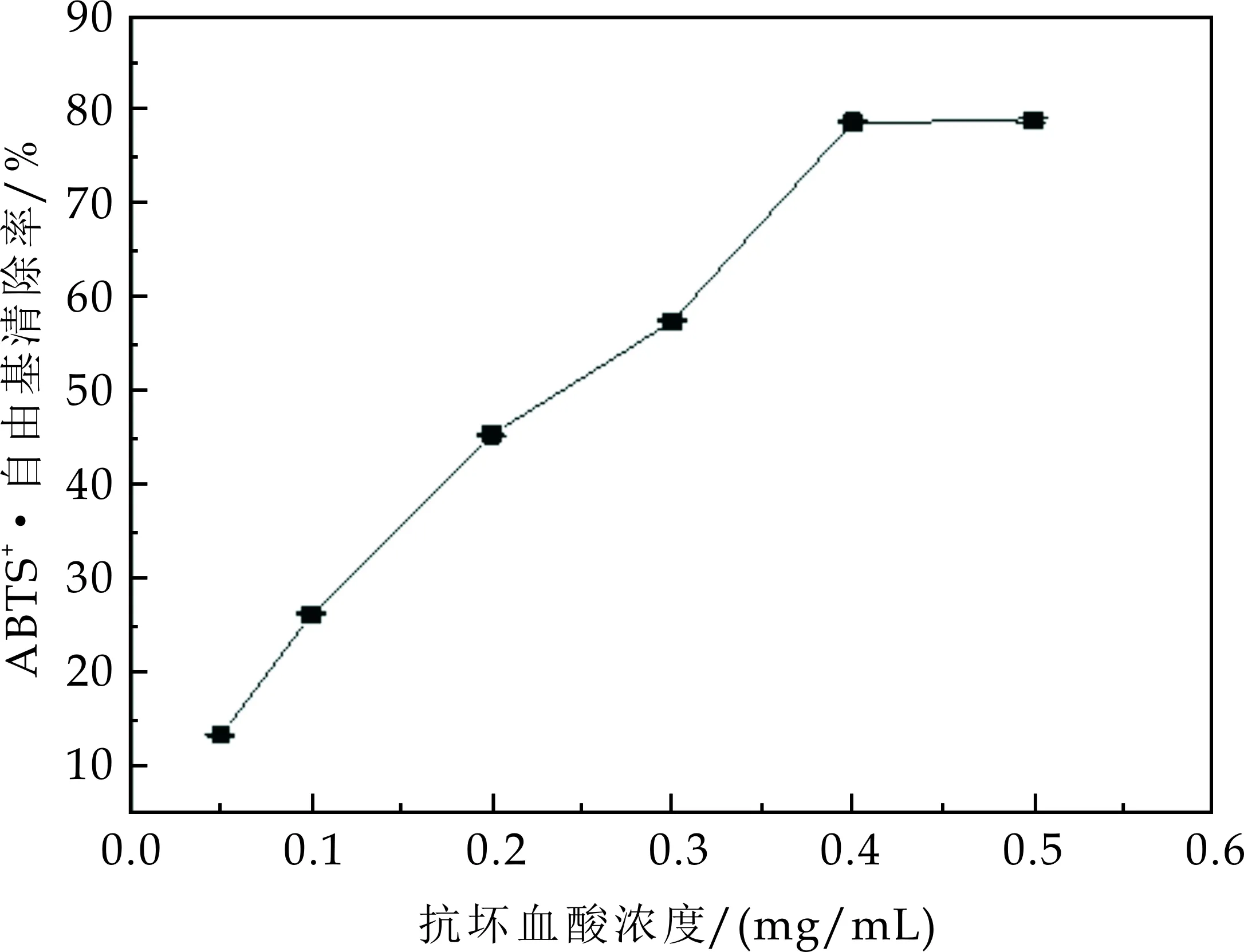
在ABTS+·自由基清除实验中不同浓度的抗坏血酸都具有一定的自由基清除能力.由图3(a)可知,在抗坏血酸浓度小于0.4 mg/mL的范围内自由基清除率随着抗坏血酸浓度的增高而增加,但是当其浓度大于0.4 mg/mL时,ABTS+·自由基清除率变化趋于平缓.
采用线性变化范围内的5个抗坏血酸浓度点(0.05~0.4 mg/mL)绘制标准曲线如图3(b)所示,回归方程为:
y=1.79x+0.065 6
(5)
式(5)中:y—自由基清除率;x—抗坏血酸浓度,mg/mL.
不同品种的猕猴桃果实的ABTS+·自由基清除率如图3(b)所示,其中红、蓝和黄色分别代表海沃德、哑特、徐香.由图3可知,三个品种的猕猴桃果实的ABTS+·自由基清除率的范围在20%~40%之间.其中海沃德样品的ABTS+·自由基清除率为22.45%,代入式(5)得到对应的抗坏血酸浓度为0.08 mg/mL;同理,哑特样品的ABTS+·自由基清除率和抗坏血酸浓度分别为35.62%和0.16 mg/mL;徐香样品的ABTS+·自由基清除率和对应的抗坏血酸浓度为38.05%和0.17 mg/mL.因此,不同品种猕猴桃果实的ABTS+·自由基清除率差异较大,且徐香品种的自由基清除率最高,综上得对ABTS+·自由基清除率顺序依次为徐香>哑特>海沃德.
(a)ABTS+·自由基清除率随抗坏血酸浓度变化趋势

(b)ABTS+·自由基清除率标准曲线图3 ABTS+·自由基清除率的变化趋势
2.2.2 不同品种猕猴桃清除ABTS+·自由基能力
方法同上,用抗坏血酸当量表示猕猴桃的抗氧化能力.抗坏血酸当量的计算公式同2.1.2中式(4),结果如图4所示.海沃德、哑特、徐香三个品种样品的抗坏血酸当量分别为0.25μmol/100g、0.46μmol/100g、0.51μmol/100g,对所得数据采用T-text进行统计学分析,结果表明三个品种两两之间均具有显著性差异,对其抗坏血酸当量测定得到三个品种猕猴桃清除ABTS+·自由基能力顺序从大到小为徐香>哑特>海沃德.
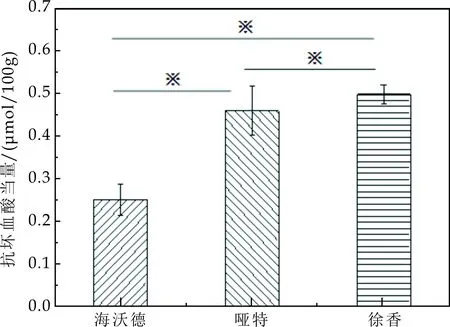
图4 不同品种猕猴桃清除ABTS+·自由基能力(*表示具有显著性差异,p<0.05)
2.3 不同品种猕猴桃果实清除·OH自由基能力
2.3.1 ·OH自由基清除率的变化趋势
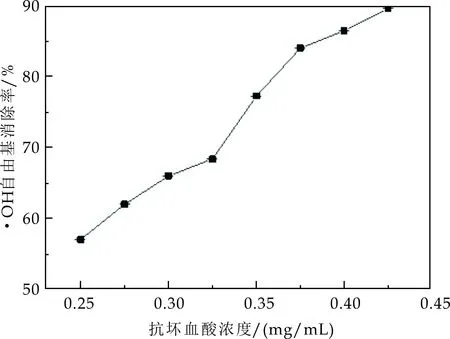
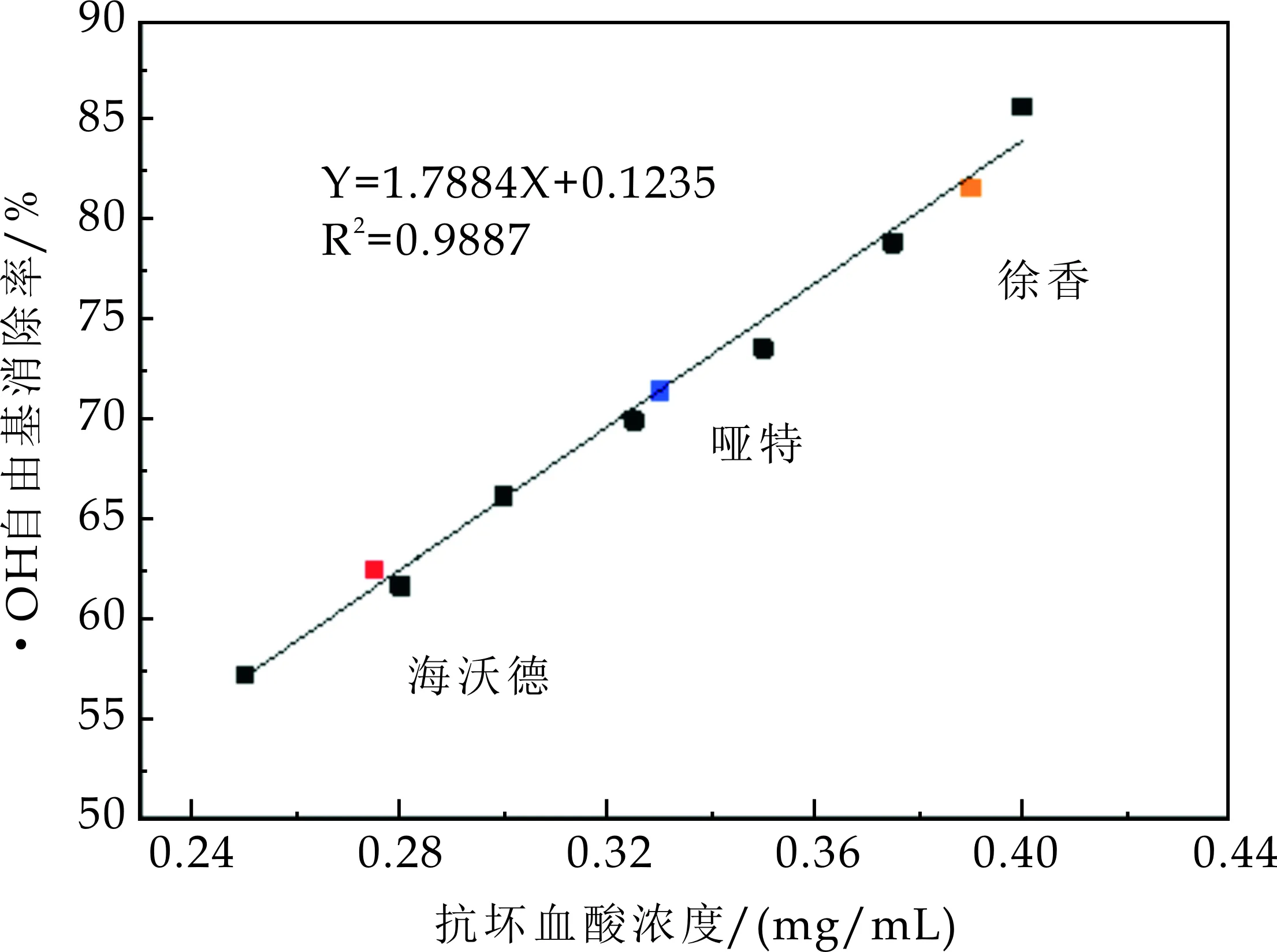
由图5(a)可知,随着抗坏血酸(Vc)浓度的升高,对·OH自由基清除能力几乎呈线性增加.但是当Vc浓度高于0.4 mg/mL后,·OH自由基的清除率随着浓度的升高逐渐趋于平稳.采用线性变化范围的7个抗坏血酸浓度点(0.25~0.4 mg/mL)绘制标准曲线如图5(b)所示,回归方程为:
y=1.788x+0.123 5
(6)
式(6)中:y—·OH自由基清除率;x—抗坏血酸浓度,mg/mL.
三个品种的猕猴桃果实对·OH自由基清除率如图5(b)所示,其中红、色和黄色分别代表海沃德、哑特和徐香,三种样品的·OH自由基清除率范围在60%~85%之间.其中海沃德样品的·OH自由基清除率为61.60%,由2.1.2中式(4)求得对应的抗坏血酸浓度为0.28 mg/mL;同样方法得到哑特样品的·OH自由基清除率及对应的抗坏血酸浓度为71.36%和0.33 mg/mL;徐香样品为81.47%和0.39 mg/mL.结果表明,不同品种猕猴桃果实对·OH自由基的清除率差异较大,三个品种对·OH自由基清除率强弱顺序为徐香>哑特>海沃德.
(a)·OH自由基清除率随抗坏血酸浓度变化趋势
(b)·OH自由基清除率标准曲线图5 ·OH自由基清除率的变化趋势
2.3.2 不同品种猕猴桃果实清除·OH自由基能力
对抗坏血酸当量进行计算,公式同2.1.2中式(4),结果如图6所示.海沃德品种、哑特品种、徐香的抗坏血酸当量分别为26.10μmol/100 g、31.22μmol/100 g、36.58μmol/100 g.哑特的抗坏血酸当量是海沃德的1.20倍,徐香的抗坏血酸当量是海沃德的1.40倍,徐香的抗坏血酸当量是哑特的1.17倍.三个品种猕猴桃果实的抗坏血酸当量相差倍数较小,其中徐香猕猴桃果实的抗坏血酸当量最高,海沃德猕猴桃果实的最低.三个品种猕猴桃果实的抗氧化能力由强到弱分别是徐香>哑特>海沃德.采用T-text对三个品种之间进行统计学分析,差异显著.
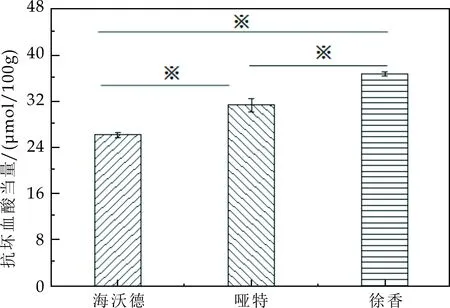
图6 不同品种猕猴桃对·OH自由基清除率能力(*表示具有显著性差异,p<0.05)
2.4 不同品种猕猴桃果实的Cu2+螯合能力
2.4.1 Cu2+螯合能力变化趋势
抗坏血酸对铜离子螯合有明显的趋势性,随着抗坏血酸浓度的提高,铜离子的螯合能力越来越强.采用线性变化范围的6个抗坏血酸浓度点(1 ~ 10 mg/mL)的为x轴,Cu2+螯合能力为y轴绘制标准曲线.得回归方程:
y=0.032 4x+0.551 9
(7)
式(7)中:y—Cu2+螯合能力;x—抗坏血酸浓度,mg/mL.
由图7(b)可知,不同浓度抗坏血酸对Cu2+螯合能力不同,在所选的抗坏血酸浓度范围内,抗坏血酸浓度与Cu2+螯合能力呈现明显的线性关系.求得海沃德对铜离子的螯合能力和抗坏血酸浓度分别为57.6%和0.73 mg/mL,哑特样品为65.1%和3.06 mg/mL,徐香样品为77.3%和6.83 mg/mL.综上,三个品种猕猴桃果实对Cu2+的螯合能力强弱顺序是徐香>哑特>海沃德.
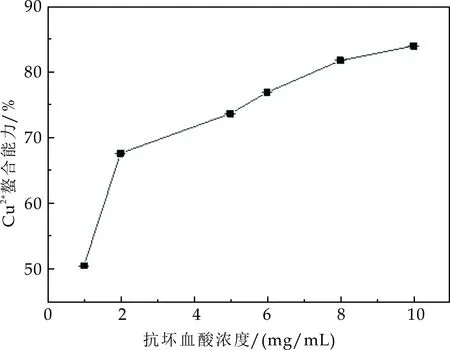
(a)对Cu2+螯合能力随抗坏血酸浓度变化趋势

(b)Cu2+螯合能力标准曲线图7 不同抗坏血酸浓度对Cu2+螯合能力变化趋势
2.4.2 不同品种猕猴桃果实的Cu2+螯合能力
同上,结果如图8所示,海沃德、哑特、徐香的抗坏血酸当量分别为0.73μmol/100 g、3.06μmol/100 g、6.83μmol/100 g.哑特的抗坏血酸当量是海沃德的4.19倍,徐香的抗坏血酸当量是海沃德的9.36倍,徐香的抗坏血酸当量是哑特的2.23倍.再次验证三个品种猕猴桃果实对Cu2+的螯合能力强弱顺序是徐香>哑特>海沃德.采用T-text对三个品种之间进行统计学分析,差异显著.
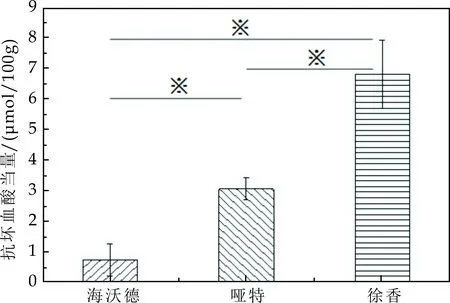
图8 不同品种猕猴桃对Cu2+的螯合能力(*表示具有显著性差异,p<0.05)
3 结论
结果表明,在一定抗坏血酸浓度范围内,随着抗坏血酸浓度的增加,抗坏血酸清除三种自由基(DPPH·、ABTS+·和·OH)的能力以及铜离子螯合能力会增强.到达一定浓度后,趋势会慢慢趋于平缓.此外,海沃德、哑特、徐香三种猕猴桃对·OH自由基的清除能力是最强的,其次是铜离子的螯合能力,最弱的是对DPPH·和ABTS+·自由基的清除能力.
三个品种猕猴桃之间也有显著差异,徐香猕猴桃DPPH·自由基清除能力是海沃德猕猴桃的2.98倍,是哑特猕猴桃的1.34倍.徐香猕猴桃ABTS+·自由基清除能力是海沃德猕猴桃的2.02倍,是哑特猕猴桃的1.10倍.徐香猕猴桃·OH自由基清除能力是海沃德猕猴桃的1.40倍,是哑特猕猴桃的1.17倍.徐香猕猴桃的铜离子螯合能力是海沃德猕猴桃铜离子螯合能力的9.35倍,是哑特猕猴桃的2.23倍.
从以上实验结果中可以得知,样品的抗氧化能力有显著差异,三个品种的抗氧化能力顺序依次为徐香>哑特>海沃德.该研究为猕猴桃资源的进一步开发和利用提供了技术支撑,也为筛选天然高效的药物和食品抗氧化剂奠定了基础.

