基于JAK-STAT信号通路的药物研究进展
王学川, 李 霄, 梁承远
(1.陕西科技大学 轻工科学与工程学院 轻化工程国家级实验教学示范中心, 陕西 西安 710021; 2.陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
0 引言
细胞之间的通信对于细胞的增殖、成熟、分化以及凋亡等生命活动至关重要.JAK-STAT(Janus kinase-signal transducer and activator of transcription)信号通路是一组普遍存在于脊椎动物中的信号通路,主要由受体、JAK蛋白以及信号转导和转录激活因子三部分组成[1].许多重要细胞因子包括白介素、干扰素、粒细胞 /巨噬细胞集落刺激因子、红细胞生成素以及促血小板生成素都通过JAK-STAT信号通路传导信号.因此该信号通路与机体的血液系统以及免疫系统息息相关.同时JAK-STAT信号通路协同其他关键信号通路(磷酸酯肌酶3激酶/蛋白激酶B/雷帕霉素靶蛋白phosphatidylinositol3-kinase/protein kinase B/mammalian target of rapamycin,PI3K/AKT/ mTOR和 丝裂原活化蛋白激酶/胞外信号调节激酶mitogen-activated protein kinase/extracellular regulated protein kinase,MAPK/ERK)共同参与调节多项生物活动.该信号通路出现紊乱会引起多种免疫相关疾病(类风湿关节炎、强直脊柱炎、红斑狼疮和牛皮癣等)或血液相关疾病(红细胞增多症、血小板增多症和骨髓纤维化等)的发生[2,3].因此了解JAK-STAT信号通路的结构组成、作用原理以及药物开发有着重要的研究意义.
1 JAK、STAT家族成员
1.1 JAK家族成员
JAK家族成员属于非受体酪氨酸激酶,分子量从120~140 kDa不等[4],有7个部分(JH1-JH7),按照各部分功能差异又分为四个结构域,依次为激酶结构域、伪激酶结构域、Src同源结构域2(SH2)结构域和FERM结构域,如图1所示.激酶结构域由JH1区组成,大约由250个氨基酸残基组成,主要负责底物的磷酸化[5];伪激酶结构域由JH2组成,大约包含300个氨基酸残基,该结构域和激酶结构域在三维结构上相似[6],但是该结构域激酶活性丧失,其主要参与调控JH1的催化活性[7,8];JH3、JH4结构域和Src同源结构域2具有同源性,因此被称为JAK激酶的SH2结构域;激酶的氨基末端部分被称为FERM结构域,由JH5-JH7区域组成,大约包含400个氨基酸残基,主要与细胞因子结合受体的能力相关[9].

图1 JAK蛋白结构域图
JAK激酶家族成员:主要由JAK1、JAK2、JAK3、TYK2 四个成员组成.JAK家族中,每一个成员与人类健康均息息相关,靶点抑制特定的JAK成员可用于治疗相关的疾病.对人的JAK家族蛋白氨基酸序列对比显示(如表1所示):其中JAK1与TYK2、JAK2与JAK3之间同源性较高,选择性抑制JAK1/TYK2、JAK2/ JAK3比较困难,并且通过序列对比发现,其中激酶结构域的同源性相对于全长序列对比更大,JAK抑制剂作用靶点主要是JAK蛋白的激酶部分,这也是靶点JAK蛋白开发抑制剂最大的问题.

表1 JAK家族序列对比
1.2 STAT家族成员
STAT蛋白质家族有七个成员分别为:STAT1、STAT2、 STAT3、 STAT4、STAT5A、 STAT5B 和 STAT6,大多数STAT家族成员主要由750~800个氨基酸组成,然而其中STAT2和STAT6大约由850个氨基酸组成.STAT蛋白由6个结构域组成,分别为:氮端结构域、卷曲螺旋结构域、DNA结合结构域、连接结构域、SH2结构域和转录活化结构域,如图2所示.不同结构域的作用各不相同,例如DNA结合结构域负责识别特定的DNA序列并与之结合;SH2结构域主要负责STAT与受体分子的对接以及STAT二聚体的形成;转录活化结构域是保守性最差的结构域,主要负责招募DNA转录相关的原件[10].STAT家族成员也与众多疾病相关,主要是参与细胞免疫、增殖、凋亡和分化多种生物信号[11,12].

图2 STAT蛋白结构域图
[13,14]
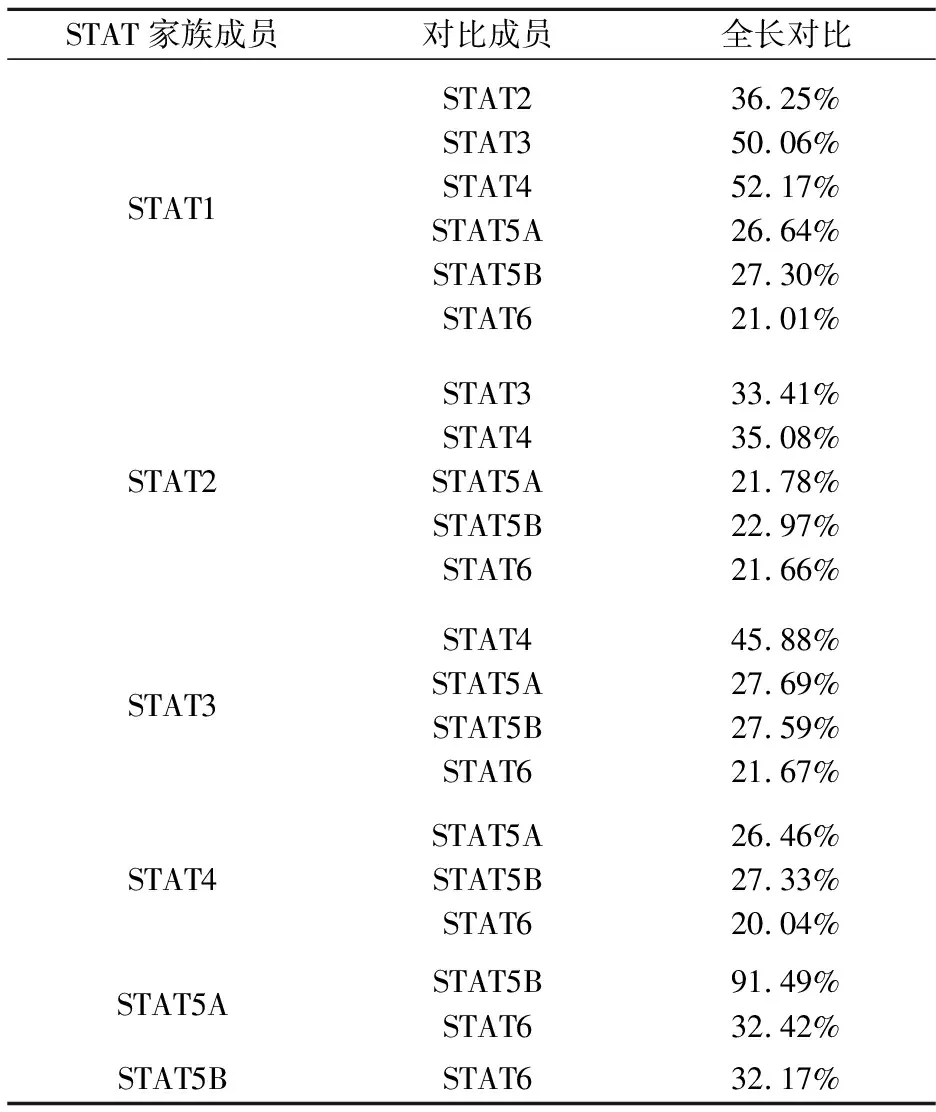
表2 STAT家族序列对比
2 JAK-STAT信号通路的原理
2.1 JAK-STAT信号通路传递过程
许多细胞因子包括白介素、干扰素、粒细胞/巨噬细胞集落刺激因子、红细胞生成素以及促血小板生成素等通过膜受体、JAK蛋白、STAT蛋白最后传递到细胞核使目的基因得到表达[15].首先,细胞因子与细胞膜上的受体结合促使受体二聚或多聚化,由于JAK蛋白结合在受体上,所以受体的二聚或多聚化作用使JAK蛋白彼此靠近并互相活化,JAK蛋白再对STAT蛋白进行磷酸化从而促使STAT二聚体的形成,STAT二聚体进入到细胞核中后可以识别特定的DNA序列并与之相结合,最后STAT招募基因转录相关的原件调节基因的表达[16](图3).在此过程中JAK蛋白可以与其自身组合例如JAK2蛋白,也可以与其它JAK蛋白组合.STAT蛋白根据信号的不同也可以形成同源二聚体或异源二聚体[17,18],如图3所示.
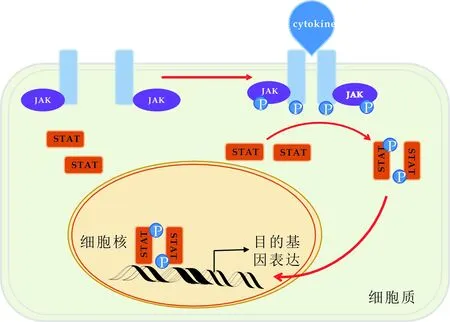
图3 JAK-STAT信号通路机理过程
细胞因子通过JAK-STAT信号通路传递的过程中,细胞因子分为Ⅰ类型细胞因子(IFNα/β)和Ⅱ类细胞因子(IFNγ),其中Ⅰ类型细胞因子主要刺激连接JAK1、TYK2蛋白的受体,Ⅱ类型细胞因子主要是刺激连接JAK1、JAK2蛋白的受体.STAT蛋白随后连接到磷酸化的受体上也发生磷酸化作用,STAT连接磷酸化受体时具有特异性,例如同源二聚物STAT1蛋白通常连接Ⅰ类型细胞因子刺激的信号通路,异源二聚物(STAT1/STAT2)通常连接Ⅱ类型细胞因子刺激的信号通路,并且特定的信号通路靶点不同类型的疾病,如图4所示.
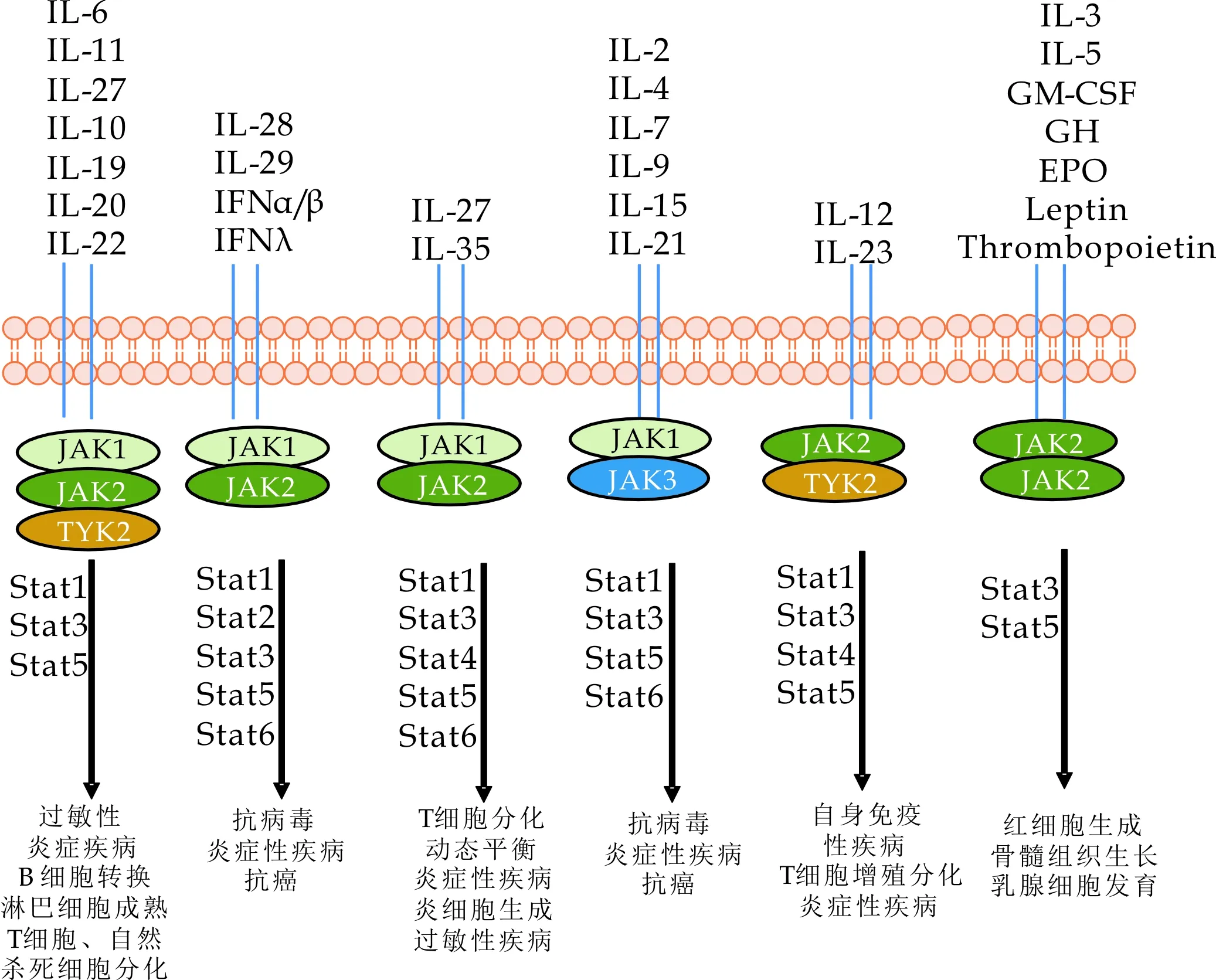
图4 JAK-STAT信号通路与相关疾病作用图
2.2 JAK-STAT与其他关键信号通路之间的关系
JAK-STAT信号通路是细胞内蛋白质之间的相互作用的主链,参与众多人体生物功能,信号通路发挥作用的过程中,不是单独作用的一条信号通路,与其他信号通路共同作用,例如JAK-STAT信号通路与PI3K/AKT/mTOR信号通路协同发挥作用[19].当JAK-STAT信号通路的JAK蛋白被激活,受体上的酪氨酸残基被磷酸化时, STAT2蛋白上的SH2结构域与受体上的酪氨酸残基结合实现相应的功能,同样PI3K蛋白结构也有SH2结构域,因此也能够结合到这些磷酸化的受体上发挥作用,PI3K/AKT/mTOR中的PI3K蛋白与JAK-STAT中的STAT2具有协同作用,共同调节细胞之间信号传递[20];第二个方面是JAK-STAT信号也可以与MAPK/ERK信号通路相互结合发挥作用,一个名为Grb2的蛋白质对于MAPK/ERK信号通路作用很重要,具有SH2结构域,因此同样是能够结合JAK磷酸化的受体.类似于PI3K/AKT/mTOR 信号通路中的PI3K蛋白,也与JAK-STAT中的STAT2具有协同作用,能够共同调节细胞之间信号传递[21],除此之外,当名为MAPK的蛋白被MAPK/ERK信号通路激活后,可以磷酸化STAT,通过STAT提高基因转录表达量,从而进一步调节目的基因的表达[22].
3 JAK-STAT与疾病的关系
由于JAK-STAT通路在细胞凋亡、细胞增殖分化和炎症发展等许多基础生物信号中起着重要作用,所以该通路中的功能蛋白的失调可能导致多种疾病,主要包括血液相关疾病和自身免疫疾病等[23].血液性疾病主要与JAK-STAT信号通路中JAK2激酶相关, JAK2参与多种细胞因子作用信号通路,和其他激酶家族成员一样具有伪激酶结构域(JH2)和酪氨酸激酶结构域(JH1),虽然JH2激酶结构域调节JH1结构域催化功能的机理还不能完全被解析,但是研究发现,当JAK2激酶的JH1结构域突变会导致骨髓增值性肿瘤,因此JAK-STAT信号通路对于骨髓细胞的发育、增殖和存活,以及免疫反应的初始阶段有着重要的关系[24].
JAK家族成员中,靶点JAK1主要与急性淋巴细胞白血病、急性骨髓性白血病、实体器官恶性肿瘤这些疾病相关;靶点JAK2也与真性红细胞增多症、骨髓纤维化、原发性血小板增多症、高凝状态、与急性和慢性血液恶性肿瘤相关的体细胞突变这些疾病相关;靶点JAK3主要与急性巨幼细胞白血病、T细胞白血病和淋巴瘤病相关,最后靶点TYK2主要与皮肤淋巴增殖性疾病,T细胞白血病这类疾病相关.自身免疫性疾病主要与JAK-STAT信号通路中STAT蛋白相关,例如STAT3蛋白的过度表达可能导致银屑病(一种自身免疫性皮肤疾病)[25].JAK-STAT信号通路作为细胞内一组重要的信号通路,与常说的癌症疾病也有很大的关联.由于JAK-STAT信号通路参与细胞分裂基因的转录,所以信号过强是影响癌症形成的潜在原因,其中根本原因为STAT蛋白被过度激活时,特别是大量的STAT3和STAT5激活与更危险的肿瘤有关.
JAK-STAT信号通路不仅能够传递细胞间化学信号,还能调节遗传物质的转录表达,通过调节遗传物质的转录与表达治疗相关的疾病.例如乳头甲状腺癌的治疗,乳头甲状腺癌在很早就报道与微RNA遗传物质(miRNAs)相关. miRNAs是一种具有18~25个核苷酸的非编码小RNA,在细胞生长和发育过程的调节过程中起多种作用,很多研究者靶点 miRNAs的转录和表达来治疗乳头甲状腺癌症疾病[26]; 另外Bi等人研究发现,MicroRNA-520a-3p该遗传物质通过JAK-STAT信号通路抑制甲状腺乳头状癌细胞的上皮间质的转化、侵袭和迁移也能间接达到治疗乳头腺癌症疾病的效果[27].非小细胞癌症疾病也与JAK-STAT信号通路间接相关,Zhang等人研究发现,通过调节JAK/STAT3信号通路可增强顺铂对非小细胞肺癌A549细胞的抗癌作用,间接达到治疗非小细胞癌症的效果[28].
4 基于JAK-STAT信号通路的药物靶点
4.1 基于JAK蛋白的靶点药物
JAK-STAT信号通路作为一组重要的信号通路,靶点通路上关键蛋白开发抑制剂是近几年的研究热点.其中靶点JAK蛋白开发药物一直在研究,主要用于治疗银屑病、类风湿关节炎、真性红细胞增多症、脱发、原发性血小板增多症、溃疡性结肠炎、骨髓化生伴骨髓纤维化和白癜风等疾病[29].靶点JAK蛋白开发药物治疗炎症性疾病数量最多,并且不同JAK抑制剂用于治疗不同相关疾病(表3).炎症性疾病是由于破坏组织的抗原物质以及一些细胞因子经过传递抗原的细胞传递到自身的辅助T细胞(Th0)之后,Th0被激活分化出具有特定功能的T细胞(例如Th1,Th2,Th17),之后分泌出活化免疫细胞的细胞因子,就会导致炎症性疾病.
辉瑞公司研发的Tofacitinib是第一个进入临床阶段用于治疗炎症性疾病的抑制剂分子,该小分子主要靶点JAK1、JAK2和JAK3家族成员,用于治疗类风湿炎症疾病;Ruxolitinib、Baricitinib是瑞士诺华制药公司开发的靶点JAK1、JAK2用于治疗炎症性疾病的药物,与辉瑞公司的抑制剂分子和JAK激酶作用机理相似,通过吡咯嘧啶结合杂环作为有效的官能团与JAK蛋白的活性位点相互作用,从而达到抑制激酶的效果[30].Decernotinib抑制剂分子是Vertex研究者设计合成用于靶点JAK3蛋白的抑制剂,该抑制剂分子是同样基于吡咯嘧啶结合杂环作为关键骨架,进行细胞实验时,发现该抑制剂IC50(50% inhibitory concentration)值在50~170 nM范围进行变化时,对于JAK3、JAK1参与的信号通路均具有抑制性,用于治疗类风湿炎症疾病[31].Filgotinib抑制剂分子是Galapagos研究者开发的抑制剂,同样也是用于治疗类风湿炎症疾病,对于JAK家族中的JAK1具有高的选择性,与其他用于治疗类风湿炎症的JAK抑制性相比,选择性明显高的多[32].Galapagos研究者不仅开发出Filgotinib抑制剂分子,还开发出GSK2586184抑制剂分子,该抑制剂分子主要被用于治疗系统性红斑狼疮和银屑癣皮肤疾病[33].
Baricitinib是美国礼来公司研发的抑制剂分子,靶点JAK1、JAK2用于治疗RA类风湿关节炎疾病,和Tofacitinib作用机理类似,对于抗风湿药物难以治疗的患者非常有效[34].在糜烂和关节间隙狭窄方面疾病治疗方面用药量存在显著差异,分别是高剂量的每日两次(4毫克)和低剂量每日两次(2毫克)[35].Oclacitinib是非常有效的JAK1抑制剂,已经被美国食品药品管理局批准用于治疗狗过敏性湿疹,在现有的口服JAK抑制剂中,目前还没有用于治疗人类过敏性疾病的测试,Oclacitinib对犬特应性皮炎的疗效表明,JAK抑制剂可以破坏驱动过敏性炎症的关键信号通路.该发现为局限托法替尼治疗人类特应性皮肤病的临床试验提供了可能[36].Peficitinib 由安斯泰来公司研发,处于三期临床用于治疗风湿性关节炎的JAK抑制剂,用于治疗银屑病的临床二期研究目前已经完成,是一种新型口服的JAK激酶抑制剂,其抑制JAK1、JAK2、JAK3和TYK2的活性IC50分别为3.9 nM、5.0 nM、0.71 nM和4.8 nM[37].
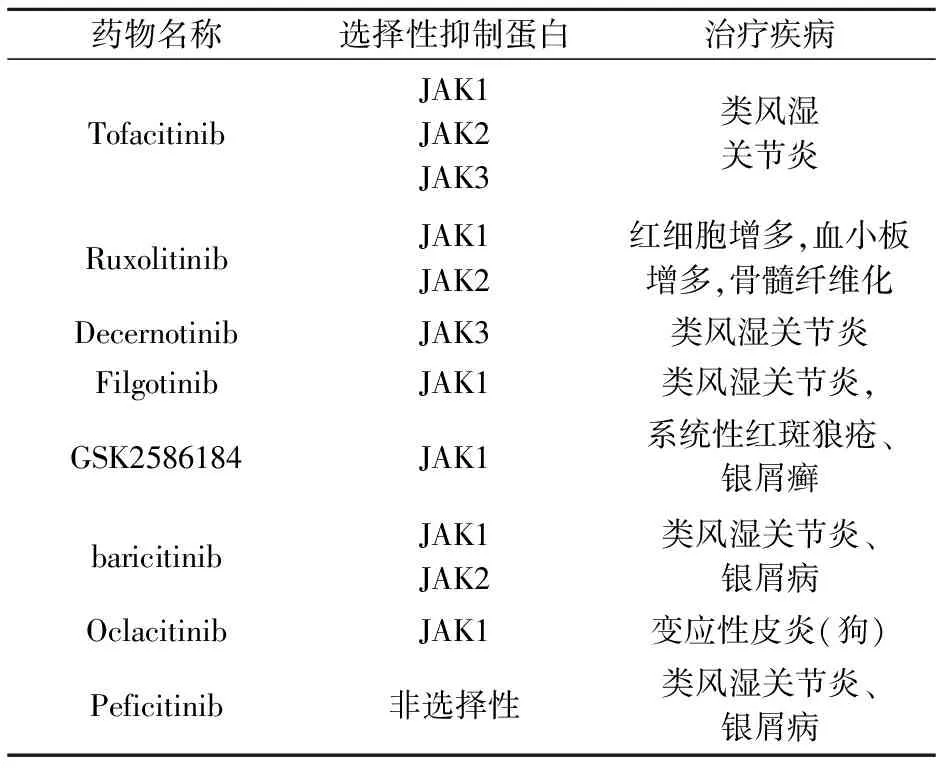
表3 靶点JAK抑制剂
JAK家族成员氨基酸序列对比同源性较高,靶点JAK蛋白开发设计特异性抑制剂是现存在的关键问题.由于抑制剂分子主要与JAK激酶的激酶结构域相互作用,因此针对JAK家族成员激酶结构域序列的不同设计抑制剂分子是解决特异性的关键方法.JAK家族成员之间与疾病之间的关系也不太相同,抑制不同JAK蛋白可以特异性治疗相关的疾病,例如JAK1对Ⅰ型和Ⅱ型细胞因子的信号传导至关重要.在启动对多种主要细胞因子受体的反应中起着至关重要的作用.
临床研究发现失去JAK1对于新生小鼠是致命的[38].癌细胞中JAK1的表达会使单个细胞收缩,使其逃离肿瘤快速转移到身体的其他部位,从而导致癌症的扩散;JAK2激酶被验证在II型细胞因子受体的信号传递中发挥信号作用,临床研究发现小鼠胚胎在第12天丧失JAK2是致命的[39],与血液性疾病有着密切关系,当JAK2发生基因突变可导致白血病和淋巴瘤,其中具体的原因研究者认为JAK2基因外显子12、13、14和15的突变被认为是发展淋巴瘤或白血病的危险因素[40,41];JAK3被验证是I型受体信号传导所必需的,I型受体作用常见的伽马C链(γc), 在造血细胞和上皮细胞中表达.JAK3基因的突变可能影响人的免疫系统方面的问题,JAK3的突变会导致自身免疫紊乱,其次JAK3最常在T细胞和自然杀死细胞(NK细胞)中表达,基因突变的患者会失去T细胞、B细胞以及NK细胞,以至于患者会更容易发生皮肤感染疾病[42,43],并且JAK3也在肠上皮细胞中被发现,临床研究发现敲除 JAK3基因导致常染色体严重的联合免疫缺陷疾病(SCID)[44],相反过度激活JAK3的突变会导致白血病的发生[45].除了在T细胞和NK细胞中发挥作用外,JAK3还被发现在人中性粒细胞中介导IL-8刺激信号,IL-8用于诱导中性粒细胞和淋巴细胞趋化,而JAK3激酶失活会严重抑制IL-8信号的趋化[46];TYK2激酶是JAK家族成员中第一个被发现的家族成员,参与IFN-α、 IL-6、 IL-10和IL-12细胞因子发挥信号作用.在正常生理条件下,免疫细胞一般受多种细胞因子的作用调控,不同细胞因子信号通路之间的交叉共同参与JAK-STAT通路的调控,因此JAK-STAT信号通路调节与免疫相关疾病有很大关系[47,48].JAK蛋白作为人体中重要的一种蛋白,靶点JAK蛋白设计的小分子抑制剂有许多, 然而大多数由于口服生物利用率低、选择性差等缺点都处于临床的不同研究阶段,获得监管部门批准的上市JAK抑制剂起今为止仅有两个,分别是用于治疗血液疾的Ruxolitinib和类风性关节炎疾病的Tofacitinib.Ruxolitinib是第一个批准上市用于治疗骨髓纤维化的药物.Tofacitinib是辉瑞公司研发的一种新型口服JAK抑制剂,用于治疗类风湿炎症疾病,以细胞内信号转导通路为靶点,作用于细胞因子网络的核心部分[49].综上所述,靶点JAK蛋白抑制剂的开发已成为治疗相关疾病的热点.
4.2 基于STAT蛋白潜在靶点
基于JAK-STAT信号通路开发的药物大多数是靶点JAK蛋白, STAT蛋白也与众多疾病相关.STAT蛋白和JAK蛋白相比,激酶活性口袋部分没有小分子药物作用的靶点,所以可以从阻止STAT蛋白形成二聚物的新角度进行药物开发.
STAT1被多种配体因子激活,如α干扰素、γ干扰素、表皮生长因子、血小板衍生生长因子或IL-6,同时STAT1在许多导致细胞存活或病原体反应的基因表达中起关键作用[50]; STAT2在干扰素作用下,结合STAT1蛋白形成异源二聚物,结合p48形成复合物进入细胞核结合DNA发挥相应的作用[51];STAT3作为STAT蛋白家族成员的一名参与多种基因在细胞刺激反应中表达,在细胞生长和凋亡等许多过程起着关键作用;STAT3对辅助性T细胞17(TH17)的分化至关重要,而TH17细胞与多种自身免疫性疾病有关.在病毒感染期间,T细胞中缺乏STAT3时,T滤泡辅助细胞的能力有损伤,不能维持基于抗体的免疫[52].临床数据报道,STAT3基因功能突变可导致多器官早发性自身免疫性疾病,如甲状腺疾病、糖尿病、肠道炎症和低血计数[53],STAT3还可以通过其他途径促进肿瘤的发生,其次也有报道STAT3的抑癌作用,STAT3在癌细胞中的活性增加,导致控制炎症基因表达的蛋白复合物功能发生改变,导致分泌体和细胞表型、肿瘤活性和转移能力发生变化[54];STAT4参与多种自身免疫性和癌症疾病的研究,在结肠炎溃疡性血脑屏障和银屑病患者的皮肤T细胞中,STAT4明显升高[55];STAT5蛋白分为STAT5A和STAT5B,STAT5异常活性被证明与多种人类癌症密切相关,抑制这种异常活性成为药物化学研究的一个活跃领域[56],抑制STAT5治疗疾病通常有2种方式,一种是利用小分子抑制STAT5活性,阻止STAT5与DNA的结合,达到治疗疾病的效果;第二种是通过阻止STAT5的二聚化达到治疗疾病的效果[57].STAT6蛋白通过小鼠敲除实验表明,该基因在辅助T细胞2(Th2)分化、细胞表面标记物表达和免疫球蛋白类转换中发挥作用[58].
综上所述,STAT蛋白与人类疾病也息息相关,找出STAT的活性靶点或抑制STAT磷酸二聚化对于治疗相关疾病有重要意义.
5 JAK-STAT药物开发展望
JAK-STAT信号通路作为人体细胞中重要的一组信号通路,对于细胞因子、免疫的调节都有着密切的关系.信号通路上JAK激酶家族成员、STAT家族成员之间特异性磷酸化与不同种类的疾病息息相关,将细胞外的不同的化学信号通过信号通路迅速传递到细胞核促使目的基因的表达,其中靶点信号通路上JAK蛋白设计的抑制剂分子也已经有进入临床阶段,因为与JAK-STAT信号通路相关的疾病的种类还有很多,并且还有众多已经在研究阶段的JAK抑制剂与JAK激酶蛋白之间的相互作用还没有被完全解析,所以我们深入了解JAK-STAT信号通路结构、作用机理以及靶点JAK蛋白设计开发的小分子抑制剂,对于有关疾病治疗有很大的帮助.另外一些自身免疫性疾病、血液性相关疾病的治疗现在研究的热点也是靶点JAK-STAT信号通路中特定的激酶蛋白.该综述就是主要从JAK-STAT信号通路的结构、作用机理以及与相关疾病之间的关系这几个方面进行简述,对于进一步了解信号通路以及相关恶性肿瘤的治疗有重要的作用.

