脑微出血影像学分类与血浆血管内皮生长因子水平及载脂蛋白E基因分型的关系研究
白家赫,于永鹏,刘丽君,郑亚利,李鑫,谭兰
脑微出血(cerebral microbleeds,CMBs)是以微小出血为主要特征的一种脑小血管病变[1]。不同类型的卒中患者CMBs的发生率波动在19.4%~68.5%[2]。脑出血患者CMBs的发生率为38%~66%,脑梗死患者为21%~26%,而在健康人群为5%~6%。CMBs是急性脑梗死后发生出血转化的独立危险因素,也是脑梗死患者接受溶栓、抗凝药物治疗发生症状性出血转化的重要因素。有研究发现抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路能抑制脑梗死患者接受rt-PA溶栓治疗的出血转化[3]。VEGF与基质金属蛋白酶(matrix metalloproteinase,MMP)-9过表达在脑转移瘤相关性颅内出血中发挥促进作用[4]。VEGF增高是急性脑梗死患者CMBs发生的独立危险因素,VEGF水平与CMBs严重程度相关[5-6]。推测VEGF可能参与CMBs的起始和进展过程。
目前认为基因遗传因素参与了包括CMBs在内的脑小血管病的发生、发展过程[7-8]。在遗传基因方面,载脂蛋白E(apolipoprotein E,ApoE)ε4等位基因是迄今唯一较公认的增加CMBs发生风险的遗传因素[2,9-10]。针对我国汉族人群ApoE基因型与CMBs的相关性研究尚未见报道,ApoE基因型是否与潜在的CMBs风险因子存在交互作用,目前仍不清楚。虽然近期有研究针对汉族人群探讨了急性脑梗死患者CMBs与VEGF相关性,发现VEGF水平与CMBs严重程度相关[10]。也有研究发现阿尔茨海默病(Alzheimer’s disease,AD)患者血清VEGF水平与CMBs存在相关性[11]。上述研究均未对ApoE基因进行分型,VEGF水平与ApoE基因型是否存在交互作用,仍不清楚。因此,本研究选取急性脑梗死患者为研究对象,基于ApoE基因分型和CMBs影像学分类,探讨汉族人群血浆VEGF水平与CMBs及其影像学分类的关系,为CMBs预警筛查提供有效的生物标志物。
1 研究对象及方法
1.1 研究对象 研究所选择的对象来自于2014年8月-2017年8月在青岛大学附属医院黄岛分院及青岛大学附属威海市中心医院住院治疗的急性脑梗死患者。纳入标准:①所有病例诊断符合中国急性期缺血性脑卒中诊治指南2010版的标准,经颅脑MRI证实为新发梗死(DWI序列高信号和表观弥散系数低信号)[12];②发病48 h内入院;③18岁≤年龄≤80岁。排除标准:①合并颅内出血、脑外伤、脑梗死后出血转化、感染及肿瘤等占位性病变;②伴严重的心、肝、肾等基础疾病;③年龄>80岁,伴严重痴呆、帕金森病或帕金森综合征;④伴神经系统脱髓鞘疾病如吉兰-巴雷综合征、多发性硬化等;⑤意识障碍。
1.2 方法 对所有患者进行MRI(包括T1WI,T2WI,DWI及SWI等序列)检查。常规行心电图、心脏彩超、颈部动脉彩超、颅脑MRA(或CTA)及TCD等检查,病因分型参照TOAST分型标准。记录危险因素:年龄、性别、吸烟、饮酒、简易精神状态评估量表(mini-mental state examination,MMSE)评分、NIHSS评分、高血压病、收缩压水平、糖尿病、高血脂、抗高血压、抗凝及抗血小板药物使用等。本研究已经通过青岛大学伦理委员会批准。
主要协变量的定义:①高血压病:病前应用降压药物,入院时收缩压≥140 mm Hg和(或)舒张压≥90 mm Hg;②糖尿病:糖尿病病史;空腹血糖≥7.0 mmol/L或餐后2 h血糖≥11.1 mmol/L合并糖化血红蛋白≥6.5%;③高脂血症:既往有血脂异常或入院检查血脂异常,TC>5.72 mmol/L,TG>1.72 mmol/L,或LDL>3.12 mmol/L;④吸烟:目前仍吸烟或已戒烟(10支/天,持续5年以上);⑤饮酒:饮酒量>50 mL/d,戒酒或未戒酒。
1.2.1ApoE基因分型及血管内皮生长因子检测 所有患者在入院24 h内(即发病72 h内)抽取空腹静脉血10 mL。其中5 mL血用于血糖、血脂、血常规、血凝常规等检测。另5 mL血采用人VEGF Quantikine ELISA试剂盒检测血浆VEGF水平。VEGF操作步骤按照说明书进行。ApoE基因分型采用的引物由南京东极生物科技有限公司设计并提供。使用以下引物进行扩增。ApoE rs429358:5’-TGTCCAAGGAGCTGCAGG-3’和5’-CTGCCCATCTCCTCCATCC-3’(片段长度3 9 3 b p);Ap o Er s7412:5’-ATGCCGATGACCTGCAGAA-3’和5’-CTGCCCATCTCCTCCATCC-3’(片段长度219 bp)。具体操作步骤按照说明书进行。
1.2.2 脑微出血MRI检测及其影像学分类 采用GE公司的超导性磁共振成像系统(型号:GE MR Discovery 750 3.0T)、先后获得横轴位T1WI及T2WI、矢状位T1WI、DWI、3D-TOF MRA和SWI图像。扫描参数为:FLAIRT1WI[重复时间(repetition time,TR)/回波时间(echo time,TE),1750 ms/24 ms,反转时间(inversion time,TI)780 ms;视野24 cm×24 cm,矩阵320×256];快速恢复快速自旋回波(fast relaxation fast spin echo,FRFSE)-T2WI(TR/TE,4300 ms/95 ms,视野24 cm×24 cm,矩阵512×512);DWI-平面回波成像(echo planar imaging,EPI)(TR/TE,3000 ms/70 ms;视野24 cm×24 cm,矩阵160×160。其中SWI序列参数为:3D T1-快速场回波(fast field echo,FFE),TR Minimum,TE 45.0 ms,反转角15°,层厚2 mm,无间隔采集,矩阵384×320,激励次数1.0。患者入院后行MRI平扫+SWI。CMBs诊断标准为SWI序列上圆形或椭圆形、质地均一、直径为2~10 mm低信号影,边界清楚、周围无水肿,并排除颅内钙化、铁沉积、海绵状血管瘤及扩大的血管周围间隙等[13](图1)。根据CMBs的分布位置不同,参照CMBs解剖评定量表可分为深部CMBs(基底节、丘脑、内囊、外囊及胼胝体和脑室周围白质)、脑叶CMBs(皮质和皮质下白质)、幕下CMBs(脑干及小脑)、混合型CMBs(脑叶+深部或幕下+脑叶),为方便研究,本研究将幕下CMBs归类于深部CMBs。为避免混合型CMBs对研究的干扰,予以剔除。所有MRI图像均由2名影像专业医师分别阅片给出报告。
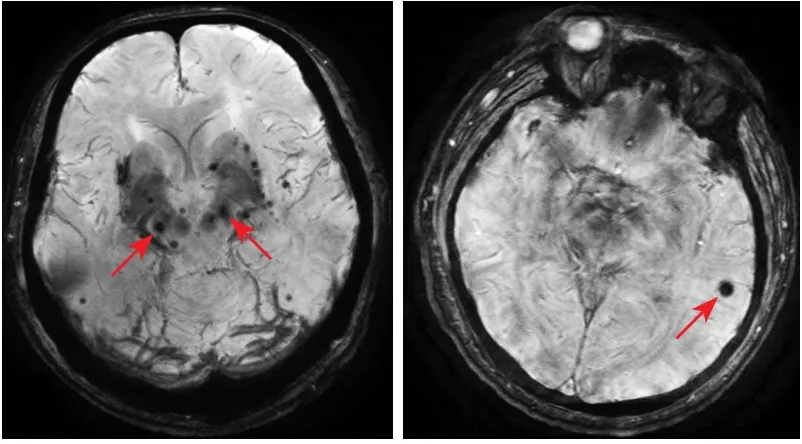
图1 脑微出血在SWI序列上的表现
1.2.3ApoE基因分型依据 鉴于ApoEε4与Ap oEε2等位基因与脑内出血高风险、CMBs及白质高信号(white matter hyperintensities,WMH)负荷增加有关。且ApoE不同的基因型可能影响CMBs的不同影像学分类。因此本研究参照既往研究中ApoE基因分型思路,根据ApoE基因型对CMBs的影响不同,分为两类:携带ε2或ε4等位基因(ε2/ε2、ε2/ε3、ε2/ε4、ε3/ε4、ε4/ε4)和仅携带ε3/ε3等位基因[14]。
1.3 统计学方法 采用SPSS 16.0统计软件进行统计学处理,正态分布计量资料以表示,计数资料用频数(%)表示。两样本均数比较采用t检验。计数资料两样本间比较采用卡方检验。使用Logistic分析校正混杂因素,分析VEGF与总体CMBs及CMBs不同影像学分类的关系。不同的回归分析模型采用不同的协变量(年龄、性别、MMSE评分、NIHSS评分、高血压病、收缩压水平、糖尿病、吸烟、饮酒及抗血小板药、抗凝剂、他汀类药物使用等)进行校正。P<0.05表示差异有统计学意义。
2 结果
2.1 研究对象的人口统计学和临床特征 本研究共纳入451例脑梗死患者,经筛查发现CMBs 99例,将混合型分布(脑叶+深部或幕下+脑叶)CMBs 7例予以剔除。实际CMBs组92例,CMBs组的MMSE评分较非CMBs组低,CMBs组患者认知功能明显受损(表1)。本研究并未发现ApoEε2和ε4两个等位基因在脑叶和脑深部CMBs个体中的分布存在差异(P>0.05)。与非CMBs患者比较,合并CMBs的脑梗死人群中有更高的ApoEε2或ε4等位基因携带率(P<0.05)。CMBs组患者存在高血压的比例较非CMBs组高(χ2=68.12,P=0.00),其他因素包括年龄、性别、MMSE评分、NIHSS评分、收缩压水平、糖尿病、吸烟、饮酒及抗血小板药、抗凝剂、他汀类药物使用等,各组之间的差异无统计学意义。
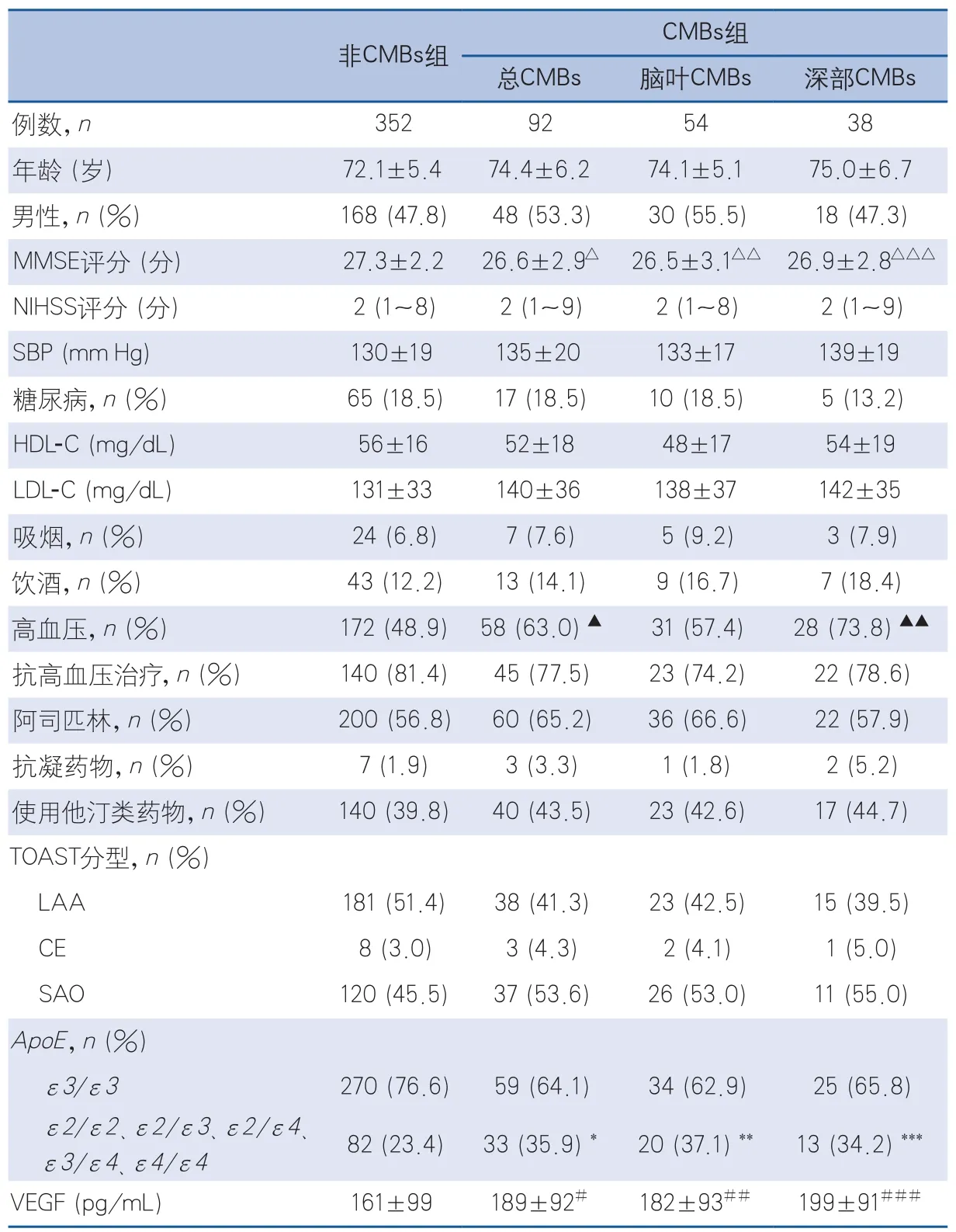
表1 研究对象的人口统计学和临床特征
2.2 血管内皮生长因子与CMBs的关系及其交互作用 CMBs组血浆VEGF水平高于非CMBs组(P=0.005),基于CMBs不同影像学分类亚组分析,脑深部CMBs组血浆VEGF水平高于非CMBs组(P=0.009)(图2)。Logistic回归分析表明,高水平血浆VEGF是CMBs的风险因素(OR1.59,95%CI1.02~2.47,P=0.005)。在脑深部CMBs患者中,血浆VEGF水平与ApoE基因型存在交互作用(P=0.01)。在携带ApoEε3/ε3患者中,血浆VEGF水平每增加一个标准差对于脑深部CMBs的多因素校正OR值是0.90(95%CI0.49~1.20,P=0.73);在ApoEε2或ε4患者中,对脑深部CMBs多因素校正OR值是2.83(95%CI1.31~6.10,P=0.008)(图3)。

图2 CMBs组与非CMBs组及CMBs各亚组患者血浆VEGF水平的比较

图3 CMBs中ApoE基因型与血浆VEGF间交互作用分析
3 讨论
本研究发现,在脑梗死人群中CMBs患病率为22.0%(99/451),多数患者存在单发CMBs,其中多发CMBs者42例,CMBs的位置分布较为广泛,21例多发CMBs分布在脑叶,14例分布于基底节、丘脑、内外囊、胼胝体和脑室周围白质、脑干及小脑等区域,7例多发CMBs属于混合型分布(脑叶+深部或幕下+脑叶),为避免对研究的干扰,予以剔除。本研究观察到男性CMBs患病率较女性高,但差异无统计学意义,这可能与本研究中男性样本年龄偏大有关。既往研究表明药物使用情况影响CMBs的发生,故本研究将药物使用情况进行了统计分析[15-16]。
3.1ApoE基因型与CMBs的关系ApoE在脑功能中发挥多种作用,改变脑血管疾病和痴呆对常见危险因素的反应,影响其发生风险及易感性。例如,ApoE等位基因状态与WMH(缺血性小血管疾病的标志)相关。ApoEε4与脑深部WMH有关[17]。携带ApoEε2或ε4等位基因的个体表现出更高的脑叶出血风险[16,18]。ApoEε4等位基因与深部和脑叶出血有关,而ApoEε2等位基因与脑深部出血的风险增加有关[19]。提示脑出血的分布类型及其发生易感性可能具有ApoE等位基因风险依赖性。然而在汉族人群中,ApoE等位基因与CMBs的影像学分类是否存在关联,目前尚不清楚。有证据提示ε4等位基因可能对脑叶CMBs有更强的影响[16]。有一项包含了42个研究(共29 965例)的系统回顾和Meta分析表明,ApoEε4和ApoE ε2基因型与WMH负荷增加相关,ApoE4基因型与CMBs特别是脑叶CMBs发病率增加有关,而ApoEε2基因型与脑梗死相关[20]。本研究并未发现携带ApoEε2或ε4的等位基因在脑叶和脑深部CMBs个体中的分布存在差异(P=0.826)。与非CMBs患者比较,合并CMBs的脑梗死人群中有更高的ApoEε2或ε4等位基因携带率(P=0.01)。这一点与既往研究结果不尽一致,分析原因认为,不同种族人群CMBs的分布对ApoEε2或ε4基因型的风险依赖可能存在差异。另外,本研究选取急性脑梗死人群为研究对象,不除外脑梗死急性期病理过程导致新发CMBs的可能,因此可能对分析ApoE基因型与CMBs的风险关系产生偏倚。
3.2 CMBs影像学分类与炎性标志物的关系 CMBs不同影像学类型可能预示着不同的发生机制。上面的论述也表明CMBs影像学类型及其发生易感性可能具有ApoE等位基因风险依赖性。既往有研究发现,较高水平的血清炎性标志物(CRP、IL-6和IL-18)与脑深部和脑叶CMBs相关[21]。VEGF具有强烈的促内皮细胞增殖及促进新生血管形成的作用,可使血管通透性增加血浆蛋白渗出,在整合素及基质的作用下诱导内皮细胞增殖、迁移,形成新生血管[22]。当前关于CMBs的发生机制尚未明确,血脑屏障受损是CMBs主要的发生机制假说之一[23]。作为CMBs的两个常见病因,高血压和脑淀粉样血管病变均可导致血脑屏障的损伤。有研究发现脑血管淀粉样变性(cerebral amyloid angiopathy,CAA)患者中β-淀粉样蛋白的沉积可导致血脑屏障通透性增加及MMP-2、MMP-9表达增加。VEGF、血管生成素、MMP是促进新生血管形成的主要细胞因子,在促进血脑屏障通透性增加中发挥重要作用。近期国内研究报道AD患者血清VEGF水平与CMBs存在相关性[14]。
在汉族人群ApoE基因分型背景下,CMBs影像学分类与血浆VEGF是否存在相关性,至今仍不清楚。本研究发现,在整体CMBs层面,与CMBs有关的是血浆VEGF水平。基于不同CMBs影像学分类亚组分析发现血浆VEGF能增加CMBs的风险。既往研究发现急性脑梗死合并CMBs患者血清VEGF水平大约是健康人的4倍[24]。近期有研究发现VEGF增高是急性脑梗死患者CMBs发生的独立危险因素,VEGF水平与CMBs严重程度相关[6]。本研究关于血浆VEGF水平与CMBs关系的结果与上述研究一致。上述研究纳入的研究对象是发病24 h内的脑梗死患者,且采集血样的时间在发病24 h内,不除外脑梗死超急性期及急性期病理过程对血浆VEGF等检测指标的影响。而本研究纳入的研究对象是发病48 h的脑梗死患者,且在患者入院第2日的清晨采集血样标本,即患者发病72 h内采集血样,尽可能减少上述因素所造成的偏倚。本研究发现脑深部CMBs与高水平血浆VEGF有关。在ApoEε2或ε4患者中,高水平血浆VEGF是脑深部CMBs的风险因素(OR2.83,95%CI1.31~6.10,P=0.008)。提示血浆VEGF在不同CMBs影像学分类亚组与ApoE基因型存在一定的交互作用。这是本研究的创新之处,进一步发现ApoE基因型与血浆VEGF参与CMBs发生易感性风险控制的复杂性。ApoE等位基因型不同状态对血浆VEGF与CMBs不同影像学类型风险关联的影响可能由不同的机制介导。
3.3ApoE基因型对血浆VEGF与CMBs风险关联的影响及其可能机制 众多研究发现,ApoE是脂蛋白代谢过程中一个重要的调节剂,是心脑血管疾病、AD等慢性疾病重要风险因素之一。ApoE4可能涉及到对线粒体功能的异常调节,与缺血性脑损伤后的恶化结局有关[25]。ApoE基因型与氧化/氮化应激、内质网应激调控、线粒体功能和炎症反应存在密切的联系。ApoE蛋白的多功能特性及基因型对疾病风险的影响在很大程度上可能归因于对氧化/氮化应激状态的影响或基于ApoE免疫细胞/抗炎特性的影响。
已有大量研究证实了ApoE基因型与氧化应激和衰老过程之间的关联。ApoE异构体特异性抗氧化能力的顺序是ApoE2>ApoE3>ApoE4。ApoE4与氧化应激标志物呈正相关,ApoEε4/ε3杂合子个体中脂质过氧化物水平升高[26-27]。ApoEε4等位基因导致更高的氧化应激和促炎状态[28-29]。在ApoE ε4携带者中发现了高水平的氧化/氮化应激压力,这可能是ApoEε4和人类疾病之间基因关联的潜在机制之一[30]。研究发现,ApoE基因多态性通过对细胞内钙水平调节影响神经元细胞凋亡,所有ApoEε4等位基因型,即ε2/ε4、ε3/ε4和ε4/ε4与AD风险增加相关,而ApoE ε2/ε2、ε2/ε3和ε3/ε3则具有保护作用[31]。提示ApoE基因多态性对疾病状态影响的复杂性和多样性。即ApoE不同基因型对氧化应激等生化病理状态影响是不同的,从而对疾病的发生易感性产生不同的影响[28,32-33]。ApoEε4通过调节炎性分子即增加IL-1和减少IL-10表达水平来调节MMP-9和组织抑制剂(tissue inhibitor of metalloproteinase,TIMP)-1的水平[34]。而MMP是参与合成和降解细胞外基质和具有特定底物的酶,涉及MMP在细胞外基质的重塑。研究发现调节MMP-9水平有助于清除β-淀粉样蛋白,MMP-9与CMBs密切相关[35-36]。新生血管形成反应存在VEGF、CD31、MMP-2、MMP-9上调和TIMP-1和TIMP-2下调等主要特征,伴有MMP蛋白水解活性增强、血管Ⅳ型胶原和层粘连蛋白的降解,VEGF是血管炎症发生过程中重要的趋化因子[37-39]。VEGF和MMP都至少部分受到氧化应激的调节,这一病理过程与CMBs是密切相关的。在一定程度上,VEGF和ApoE蛋白的表达可能受ApoEε4基因型调控[40]。不同亚型的ApoE对包括VEGF在内的细胞因子的调控发挥的作用不同[41]。由于VEGF表达受缺氧、氧化应激和氮化应激等因素调控,推测ApoE不同基因型影响VEGF参与CMBs的机制,可能是通过调控氧化或氮化应激等炎性机制影响VEGF的表达,从而参与内皮细胞功能的调节。
本研究结果表明,ApoE基因型可能对CMBs发生风险相关炎性细胞因子,例如血管内皮细胞调节因子VEGF致病风险产生修饰作用。在遗传基因方面,ApoE基因型可能是唯一增加CMBs发生风险的敏感性因素。然而ApoE基因型方法在诊断CMBs方面的能力是有限的。因此,结合易感基因分型策略,联合其他体液生物标志物进行评估,可能是进行CMBs早期筛查诊断的有效手段。在整体CMBs层面,血浆VEGF水平与CMBs有关。血浆VEGF在不同的CMBs影像学分类亚组与ApoE基因型存在交互作用。本研究结果提示ApoE基因型状态可能影响血浆VEGF与CMBs发生风险及其影像学分类的内在联系,即血浆VEGF对CMBs风险作用可能存在ApoE基因型依赖。尤其是那些携带ε2或ε4等位基因者,对血浆VEGF的综合评价可能有助于CMBs的早期诊断和预测。
本研究仍存在一些局限性:①属于横断面研究,仅在单个时间点进行MRI评估和VEGF检测。尚不清楚急性脑梗死的病程是否会对患者血清VEGF产生影响。为了尽可能减少非同期评估及急性脑梗死病程等混杂因素对研究结果的影响,在患者发病后的72 h内完成头颅MRI并采集血、尿相关样本并保存进行检测;②本研究采用汉族人群为研究对象,鉴于不同种族的差异性,本研究结果不能推广到其他种族人群。是否存在其他未知的影响ApoE基因型/CMBs风险关联的调节因子,仍不清楚,需要将来进一步研究。
【点睛】基于载脂蛋白E基因分型研究发现脑深部脑微出血与高水平血浆血管内皮生长因子有关。血浆血管内皮生长因子与脑微出血的风险联系可能存在载脂蛋白E基因型依赖。

