血清脂蛋白相关磷脂酶A2水平对颈动脉粥样硬化斑块及其稳定性预测价值的研究
申园,王丹丹,赵性泉
卒中是目前威胁人类健康的主要疾病之一,而颈动脉粥样硬化是缺血性卒中重要的危险因素之一[1-4]。研究发现不稳定的动脉粥样硬化斑块是引起大多数临床缺血性脑血管事件的潜在病理因素[5-8]。多种炎症分子参与动脉粥样硬化斑块产生和发展的过程,其中脂蛋白相关磷脂酶A2(1ipoprotein-associated phospholipase A2,Lp-PLA2)具有稳定、生物变异度低及直接参与动脉粥样硬化早期炎症反应等特点,可能作为临床判断动脉粥样硬化斑块发生和发展的生物标志物[9-11]。目前尚缺乏Lp-PLA2与颈动脉不稳定斑块早期形成与破裂关系的研究,尤其是以人群为基础的前瞻性队列研究。本研究利用大样本临床研究数据库,通过比例风险模型,探讨Lp-PLA2与颈动脉粥样硬化斑块的关系,建立适合国人的卒中发病预警模型,识别高危人群,为早期干预颈动脉粥样硬化,降低卒中发病提供依据。
1 研究对象与方法
1.1 研究设计及人群 开滦研究是基于河北省唐山市开滦集团101 510名员工的健康信息建立的数据库[11]。无症状性多血管床狭窄的社区研究(Asymptomatic Polyvascular Abnormalities Community,APAC)是以开滦社区为基础的一项前瞻性随访研究,用以调查无症状性血管狭窄在中国成人当中的发病率,是开滦研究的一项子研究。2010年6月-2011年6月,依据2010年人口普查结果,采用性别年龄随机分层的方法,随机从开滦研究中抽取7000例40岁以上受试者作为APAC研究样本。APAC入组标准:①年龄≥40岁;②既往无卒中、TIA及冠状动脉粥样硬化性心脏病史;③无神经系统功能缺损体征。
共有5852例受试者同意参与APAC研究,其中5816例受试者最终完成数据采集工作,其中有376例受试者因未满足入组条件而被排除,最终共有5440例受试者的数据纳入统计分析。在基线期,所有受试者参与问卷调查,并进行临床、实验室及TCD检查,其中有2919人行颈动脉超声检查,在这2919人中按年龄性别匹配随机抽2033例纳入本研究。
APAC研究获得开滦总医院伦理委员会批准,受试者均签署知情同意书。
1.2 基线资料的获取 所有受试者均接受问卷调查、体格检查及实验室检查,由开滦社区的11家医院完成。
1.2.1 指标测量及体格检查 通过问卷获得患者基本信息,包括年龄、性别、吸烟、酗酒、体育锻炼水平、高血压、糖尿病、高血脂病史等信息,并测量血压、身高、体重,计算BMI。在患者休息5 min后用水银血压计测量血压2次,间隔5 min,取2次读数的平均值用于数据分析。如果两次读数相差5 mm Hg,就再测量1次,取3次测量值的平均值。
1.2.2 生化指标 清晨空腹(禁食8 h以上)采集肘前静脉血,置于乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)真空管内,在室温24 ℃下,经过3000 g离心10 min,取上层血清,在4 h内测量TC、HDL-C、LDL-C、TG、CRP、Hcy、UA和Lp-PLA2。所有血液指标均于开滦医院中心实验室应用自动分析仪(Hitachi 747,Hitachi,Tokyo,日本)进行测量。Lp-PLA2浓度测定采用美国CUSABIO公司的Lp-PLA2酶联免疫试剂盒(产品批号CSB-E08319h)。
1.2.3 相关指标的定义 高血压:曾被确诊为高血压病,或目前口服降压药物,或收缩压≥140 mm Hg或舒张压≥90 mm Hg。糖尿病:曾被确诊为糖尿病,或目前口服降糖药或使用胰岛素,或者空腹血糖≥7 mmol/L(126 mg/dL)。脂代谢异常:曾被确诊为高脂血症,或目前应用降脂药,或者TC≥5.7 mmol/L或TG≥1.7 mmol/L或HDL-C<1.04 mmol/L。吸烟:吸烟至少1年,每日吸烟1根以上,或戒烟<1年。酗酒:饮酒至少1年,每日饮酒100 mL以上,或戒酒<1年。
1.2.4 颈动脉粥样硬化斑块的检测及诊断标准采用Philips公司HD-15彩色超声诊断仪,高频探头,频率5~12 MHz。颈动脉超声常规检测的动脉包括:双侧颈总动脉、颈内动脉、颈外动脉、椎动脉、锁骨下动脉及无名动脉。观察有无动脉粥样硬化斑块及斑块的性质。
根据颈动脉粥样硬化斑块的超声特性,将中等水平回声或强回声特征的斑块定义为稳定性斑块,低回声或不均质回声斑块为进展性(或复杂性)斑块。在本研究中,将具有不完整纤维帽或溃疡的斑块及低回声或混合回声的斑块定义为颈动脉不稳定粥样硬化斑块。
1.3 分组和研究方法 根据入组患者有无颈动脉粥样硬化斑块及斑块性质分为无斑块组、稳定斑块组及不稳定斑块组,比较3组患者基线资料、既往病史及临床生化指标的差异。按照Lp-PLA2水平的四分位数分为4组,通过Logistic回归分析不同水平Lp-PLA2对颈动脉粥样硬化斑块和斑块不稳定性的影响。
1.4 统计方法 统计分析应用SAS 9.4(SAS Institute,Cary,North Carolina,USA)软件包。非正态分布的计量资料用中位数(四分位数)表示,正态分布的计量资料用表示。非正态分布计量资料的组间比较采用Kruskal-Wallis秩和检验,正态分布的计量资料采用ANOVA检验。分类资料用率表示,组间比较采用卡方检验。Lp-PLA2不同水平与颈动脉粥样硬化斑块是否发生及颈动脉斑块是否稳定的关系采用多因素Logistic回归分析,并计算OR及95%CI。所有统计检验均为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 单因素分析 本研究共入组患者2033例,其中男性1497例,女性536例。年龄范围40~94岁,平均(60±11)岁。无斑块组409例、稳定斑块组333例及不稳定斑块组1291例,分析三组患者一般临床资料发现,男性、年龄、高血压病史、糖尿病病史、高血脂病史、理想体育锻炼比例、血糖水平、TC、TG、LDL-C、CRP、Hcy、UA水平3组间差异具有统计学意义(表1)。

表1 患者基线资料比较
2.2 多因素分析结果 按照Lp-PLA2水平的四分位数分为<131.8 ng/mL(n=508)、131.8~141.0 ng/mL(n=508)、141.0~159.1 ng/mL(n=509)及>159.1 ng/mL(n=508)4组。Logistic回归结果显示,较高水平Lp-PL A 2是颈动脉粥样硬化斑块发生的危险因素(141.0~159.1 ng/mL组:OR1.6,95%CI1.2~2.1,P=0.0039;>159.1 ng/mL组:OR2.3,95%CI1.7~3.2,P<0.0001)。校正相关危险因素后,该统计学差异消失(表2)。去掉不稳定斑块人群后,与无斑块组比较,较高水平的Lp-PLA2不是颈动脉稳定斑块的危险因素(表3)。去掉稳定斑块人群后,与无斑块组比较,较高水平的Lp-PLA2是颈动脉不稳定斑块发生的独立危险因素(141.0~159.1 ng/mL组:OR1.8,95%CI1.3~2.4,P=0.0004;>159.1 ng/mL组:OR2.8,95%CI2.0~3.8,P<0.0001),校正性别、年龄后,>159.1 ng/mL组仍是颈动脉不稳定斑块的独立危险因素(OR1.6,95%CI1.1~2.3,P=0.0163),校正年龄、性别、高血压、糖尿病、高血脂病史、吸烟、酗酒、BMI后,该统计学差异仍然存在(OR1.7,95%CI1.2~2.5,P=0.0067);通过对年龄进行分层发现,<60岁组该差异仍然存在(OR1.7,95%CI1.1~2.7,P=0.0142)(表4)。

表2 Lp-PLA2对颈动脉斑块影响的多因素分析结果

表3 Lp-PLA2对颈动脉稳定斑块影响的多因素分析结果
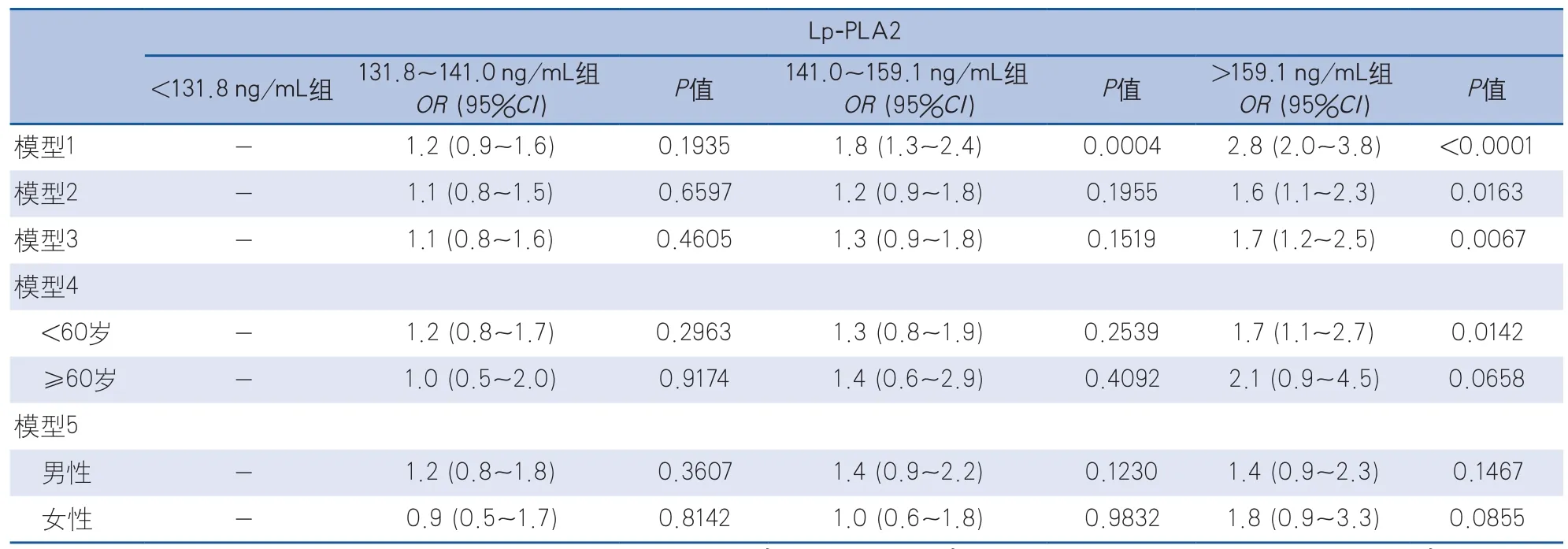
表4 Lp-PLA2对颈动脉不稳定斑块影响的多因素分析
3 讨论
Lp-PLA2是磷脂酶A2(phospholipase A2,PLA2)超家族中的一员,由441个氨基酸残基组成,相对分子质量为45.4 kD。Lp-PLA2主要由成熟的巨噬细胞和淋巴细胞合成和分泌,并受炎性介质的调节,人循环中的Lp-PLA2以与脂蛋白颗粒结合的形式存在[12]。Lp-PLA2作为一种新的炎性反应标志物,在动脉粥样硬化形成和发展的几个阶段中均起着重要作用[13-17]。在早期的研究中,因Lp-PLA2能水解致炎因子如血小板活化因子(platelet activating factor,PAF)及结构相关的氧化磷脂,因此曾被认为能抑制炎性反应,甚至能抑制动脉粥样硬化的形成,故也被称为血小板活化因子乙酰水解酶[18]。但是近年来的研究证实,Lp-PLA2更大的作用在于促进动脉粥样硬化的发生与发展。
Lp-PLA2在促进颈动脉粥样硬化斑块形成与破裂的过程中发挥重要作用。Lp-PLA2在氧化型LDL-C表面迅速降解,产生促炎介质及细胞毒性物质,促进细胞凋亡,加速凋亡小体聚集,被认为是促进脂质核心坏死扩大的主要原因[19]。有研究显示,抑制Lp-PLA2可以减小动脉粥样硬化的脂质核心及平滑肌细胞和成纤维组织坏死[20]。
较多临床研究也提示,Lp-PLA2与心脑血管疾病的发生有关[21-22]。Sotirios Tsimikas等[23]观察了765例45~84岁患者10年间心脑血管疾病的发生率,结果显示,Lp-PLA2活性水平增加是心脑血管疾病发生的独立危险因,提示Lp-PLA2可能作为心脑血管病预防监测的指标。一项包含5393例受试者,平均随访(10.6±1.7)年,基于社区人群队列研究表明,高水平Lp-PLA2及其活性增高是缺血性卒中发生的独立危险因素[24]。
既往的病理研究发现,在动脉粥样硬化斑块坏死中心及巨噬细胞内Lp-PLA2高表达,提示Lp-PLA2参与动脉粥样硬化不稳定斑块形成和发展过程[11]。本研究发现高Lp-PLA2水平与颈动脉粥样硬化不稳定斑块相关。Lp-PLA2与动脉粥样硬化斑块不稳定有关,可能存在以下机制:在外周血液循环中,Lp-PLA2与脂蛋白相结合形成复合物,该复合物进入到血管内膜后,其卵磷脂基团被氧化变成氧化卵磷脂。Lp-PLA2又作用于该复合物,可以水解其氧化卵磷脂部分,促使溶血磷脂胆碱和氧化型游离脂肪酸两种促炎介质的生成,参与炎症因子的级联放大效应。
本研究还对受试者按照年龄进行分层研究,发现在<60岁受试者中,Lp-PLA2水平>159.1 ng/mL时是颈动脉不稳定斑块发生的预测因素,而此趋势在60岁以上的受试者中则不明显。这可能与高龄受试者中动脉粥样硬化现象较普遍有关。
本研究为横断面调查,没有对受试者进行后续随访,没有对lp-PLA2水平与颈动脉粥样硬化斑块的动态发展关系进行探索。另外,妇女健康促进会(Women’s Health Initiative,WHI)研究结果显示,在未使用激素替代治疗者中,绝经后妇女Lp-PLA2水平升高者卒中风险显著增高,而在接受激素替代治疗者中Lp-PLA2水平与缺血性卒中风险无显著相关性[25]。本研究未对参与研究的女性做围绝经期敏感性分析。本研究所依托的开滦研究数据库是一项动态的数据库,之后,课题组会进一步对受试者动脉粥样硬化情况的动态进展进行追踪和分析。
【点睛】本研究是基于大样本社区人群数据库的研究,发现高水平血清Lp-PLA2是颈动脉粥样硬化不稳定斑块的危险因素。

