冷热圈套器内镜下黏膜切除术对结直肠息肉疗效及安全性比较
谢 娇, 王 雯, 李达周, 叶 舟, 许斌斌, 徐桂林, 洪东贵
1.厦门大学附属东方医院消化内科,福建 福州 350025; 2.中国人民解放军联勤保障部队第九〇〇医院消化内科
结直肠息肉是结直肠癌的癌前病变,大肠癌中60%~80%是由肠息肉进展形成[1]。结肠镜检查时行肠息肉切除术可降低结直肠癌的发生率和死亡率,但10%~27%结直肠间期癌发生在息肉不完全切除部位[2-3]。因此,结直肠息肉的组织学完整切除具有重要的临床意义。目前息肉切除方法众多,但对于结肠镜检查发现的最常见结直肠(微)小息肉(80%~90%)[4]内镜下最佳的治疗方法缺乏统一观点。最新欧洲胃肠镜学会(ESGE)指南[5]提出,所有1~9 mm结直肠息肉均可采用安全有效的冷圈套息肉切除术(CSP);也有HIROSE等[6]研究显示,CSP治疗2~14 mm结直肠息肉安全有效,术后迟发性并发症发生率低,但一些相关研究证明CSP全切除率为44%~96%[4,7-10]。另一方面,ALDRIDGE等[11]研究发现,患有直径6~9 mm结直肠腺息肉的患者比<6 mm腺息肉患者有更高的风险发展为进展期癌,因此,日本消化内镜协会强烈推荐对于6~9 mm息肉需加强内镜治疗策略,ZHANG等[4]研究显示,内镜下黏膜切除术(EMR)在结直肠小息肉的内镜下全切除方面明显优于CSP,但该术式采用了高频电凝电切,故易产生电凝相关并发症;并且临床上EMR多用于10~20 mm息肉的治疗中。若采用黏膜下注射联合冷圈套器治疗结直肠息肉,是否既保留了CSP术后电凝相关并发症低的优点,又具有与EMR相似的高全切率和低术中出血率呢?因此,综上系列研究、争议及现状,本研究提出探讨冷圈套器内镜下黏膜切除术(CS-EMR)与热圈套器内镜下黏膜切除术(HS-EMR,即传统EMR术)对6~14 mm结直肠息肉疗效和安全性比较。
1 资料与方法
1.1 一般资料本研究前瞻性选取2017年10月至2018年12在解放军联勤保障部队第九〇〇医院消化内科行肠镜检查发现患有6~14 mm结直肠息肉并满足纳入标准的患者400例进行对照研究,采用数字表随机法将符合条件的患者按1∶1随机分配接受HS-EMR或CS-EMR各200例。HS-EMR组(n=200例):男109例(54.5%),女91例,年龄(61.54±7.1)岁;CS-EMR组(n=200例):男97例(48.5%),女103例,年龄(62.13±6.8)岁;两组患者一般情况:性别、年龄、体质量指数(BMI)、肠镜指征、肠道评分等方面比较,差异无统计学意义(P>0.05),具有可比性(见表1)。此研究通过医院伦理委员会同意,且所有纳入患者受试之前均签署知情同意书。
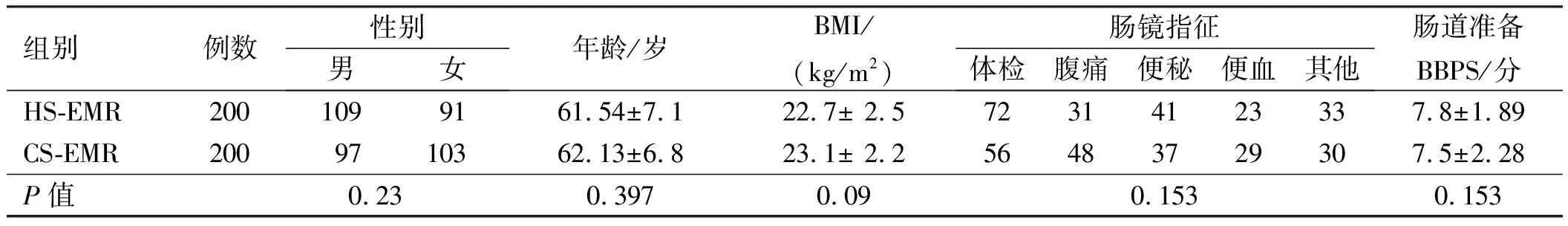
表1 患者的一般情况Tab 1 Baseline characteristics of patients
1.2 纳入排除标准
1.2.1 纳入标准:(1)年龄18~75岁;(2)单发或多发直径6~14 mm(巴黎分型:0-Ⅰp、0-Ⅰsp、0-Ⅰs、0-Ⅱa)结直肠(微)小息肉。注:如果患者有超过1个合格的息肉,只纳入位于距肛侧最近并首先接受治疗的息肉,其余均排除。
1.2.2 排除标准:(1)肠梗阻、有家族性息肉病、炎症性肠病;(2)既往有急性心梗病史(6个月内),有严重的心、肝、肾功能不全或精神疾病;(3)正在服用阿司匹林、华法林等抗凝药者,或存在凝血功能障碍者;(4)息肉直径>1 cm;侧向发育性病变(laterally spreading tumor,LST)与结肠癌需进行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)和外科手术;(5)正参加其他临床观察试验或60 d内曾参与其他临床试验者;(6)妊娠;(7)肠道准备不合格者(BBPS<6分)。
1.3 方法
1.3.1 术前准备及器械:所有纳入患者均在肠镜检查前2天少渣饮食,前一天全营养粉代餐,前一晚2 L聚乙二醇电解质散,检查当日上午2 L聚乙二醇电解质散(上午检查者4∶00开始,下午检查者7∶00开始第2次服用泻药)联合低剂量硫酸镁和西甲硅油去泡去黏液,必要时采用开塞露启动腹泻进行肠道准备。采用高清内镜(CV-290;日本OLYMPULS),常规内镜(GIF-H260;日本OLYMPULS)。黏膜注射针[Boston Scientific InterjectTM25 ga(0.5 mm)240 cm]。可通电圈套器(Boston Scientific CAPTIVATORTM13 mm;JHY-SD-23-230-15-AI 15 mm;常用凝切通电功率:20~50 W)。活检钳(UPN SFBF China)。止血夹(MD850;Boston Scientific ResolutionTMClip)。软组织夹(ROCC-D-24-195;AG-5108-1950-135-9)。息肉在结肠镜检查时采用我科自制息肉大小测量器(5~15 mm不同大小圆孔测量卡见图1C)测量息肉大小是否合适。
1.3.2 操作方法:肠镜操作及治疗由本内镜中心3名经验丰富的内镜医师完成(肠镜工作量>3 000例,工作年限>5年),内镜医师术前不知道患者分组情况,术中由护士根据之前随机分组情况告知内镜医师采用何种术式,纳入患者在息肉切除前均使用亚甲基美兰生理盐水溶液进行息肉处黏膜下注射,当侧缘清晰可见时,确定息肉抬举阳性后,HS-EMR组:采用高频电凝圈套器套取息肉后轻轻拉离肠壁稍许距离再予以切除,从而避免电凝灼烧更深的组织(见图1A~G);CS-EMR组,采用冷圈套器套取息肉后,再慢慢收紧圈套器直至机械性勒除组织(见图1H~L)。两组切除息肉均回收送病理,最后再在NBI下对息肉切除部位的底部及边切缘活检3~5块(6~9 mm息肉:底部1块+边切缘2块;10~14 mm息肉:底部1块+边切缘4块),用以组织学评估完整切除率。
注:A:内镜白光下见一带蒂息肉;B:NBI下观察息肉血管、腺管等形态;C:自制直径1.5 cm圆孔测量卡,测得其大小约1.3 cm×0.5 cm;D:注射针插入行黏膜下注射;E:予以高频电凝圈套器勒除息肉;F:HS-EMR术后息肉切除部位创面;G:内镜白光下见一亚蒂息肉;H:NBI(Near Focus模式)下观察息肉血管、腺管等形态白光;I:自制直径1.0 cm圆孔测量卡,测得其大小约0.6 cm×0.5 cm;J:注射针插入行黏膜下注射;K:予以冷圈套直接勒除息肉;L:CS-EMR术后息肉切除部位创面。
图1 热圈套内镜下黏膜切除术(A~G)及冷圈套内镜下黏膜切除术(H~L)
Fig 1 HS-EMR (A-G) and CS-EMR (H-L)
1.3.3 观察指标:息肉的一般情况:大小、部位、形态、分型等;主要结局指标:组织学完整切除率,即通过切除的息肉标本及活检标本的病理组织学评估,只要息肉标本底侧缘及底部和周缘活检标本中有1处含有病变组织则定义为不完整切除。次要结局指标:整块切除率:内镜直视下息肉整块切除的情况;切除时间,即从黏膜注射针插入到收集完标本所需时间;切除息肉回收率;回盲部插管率;手术相关并发症发生率,包括术中及术后2周内出血、穿孔率,其中,息肉切除后创面出血无法自凝需内镜干预止血定义为术中出血;息肉切除治疗后2周内需要内镜干预的延迟出血定义为术后出血。
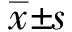
2 结果
2.1 两组切除息肉及手术相关情况两组均纳入患者各200例,其中HS-EMR组和CS-EMR组病灶平均大小分别为(10.1±1.87)mm和(9.87±2.13)mm,切除息肉一般情况:大小、部位、形态及分型,两组间比较,差异均无统计学意义(P>0.05),故两组切除息肉的基线特征在组间均衡。此外,HS-EMR组息肉切除时间(3.39±1.56)min与CS-EMR组(3.45±1.12)min相似,差异无统计学意义(P>0.05)。两组均有较高回盲部插管率且所有切除息肉均回收(见表2)。
2.2 两组的治疗结果HS-EMR组及CS-EMR组均有较高的内镜下整块切除率,分别为99.5%和98.5%。CS-EMR组在6~14 mm结直肠息肉的治疗中组织学完整切除率为93.0%(186/200)稍低于HS-EMR组94.5%(189/200),但在6~9 mm结直肠息肉的治疗中CS-EMR组织学完整切除率高达96.1%,与HS-EMR(96.7%)相似,可见CS-EMR对于6~9 mm息肉治疗优于10~14 mm息肉(96.1%vs89.8%,P=0.082),但组织学完整切除率均较高。两组在不同病理类型息肉的完整切除率差异无统计学意义(P>0.05)。HS-EMR组出现5例迟发性出血和2例迟发性穿孔,但CS-EMR组均未出现迟发性出血、穿孔;CS-EMR组仅出现7例术中出血与HS-EMR组3例相比,差异无统计学意义(P>0.05)(见表3)。

表2 两组息肉的特征及手术相关情况Tab 2 Baseline characteristics of polyps and polypectomy related information of two groups

表3 HS-EMR组和CS-EMR组息肉治疗情况Tab 3 Treatment outcomes of HS-EMP group and CS-EMP group
2.3 两组腺癌的内镜下表现HS-EMR组和CS-EMR组共3例腺癌均位于直肠处,亚蒂或无蒂,大小分别为:0.7 cm×0.8 cm、1.2 cm×1.4 cm、0.9 cm×1.0 cm。内镜下白光图示(见图2),形态均欠规则,部分表面结构扭曲或缺失,含点状脐凹,底部与正常肠壁黏膜有一定界限。
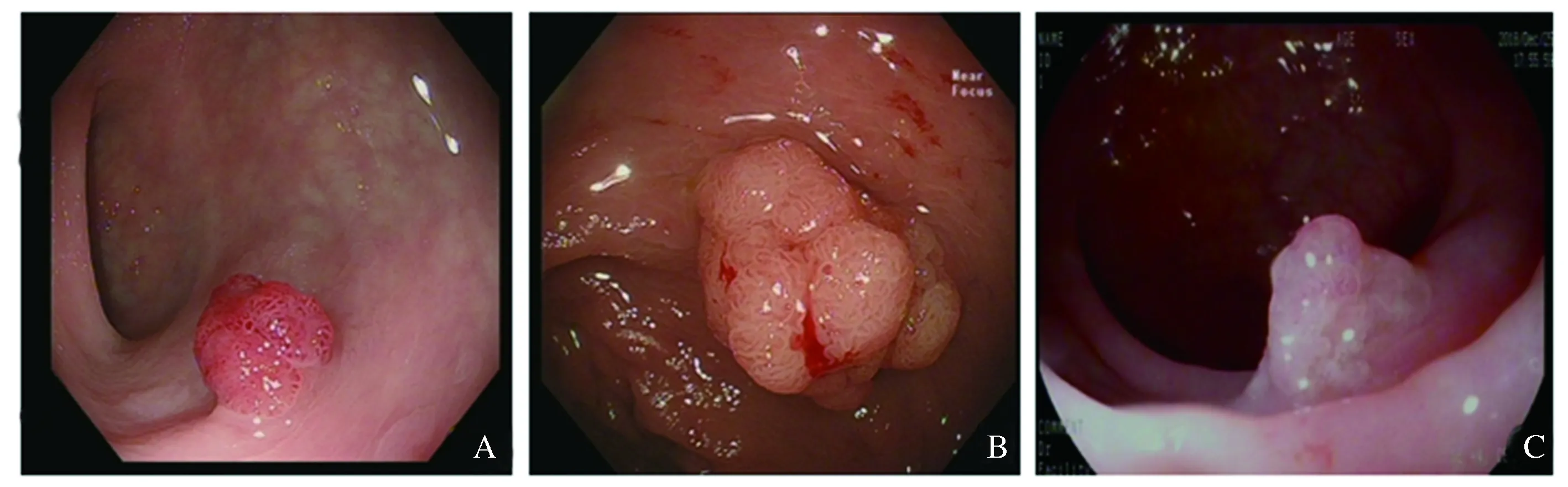
注:A:内镜白光下见一大小约0.7 cm×0.8 cm亚蒂息肉,采取术式CS-EMR;B:内镜下(采用Near Focus模式)见一大小约1.2 cm×1.4 cm亚蒂息肉,表面点状出血,采取术式HS-EMR;C:内镜白光下见一大小约0.9 cm×1.0 cm无蒂息肉,采取术式HS-EMR。
图2 研究中3例均位于直肠处腺癌的内镜下表现
Fig 2 Endoscopic features of three cases of adenocarcinoma located in rectal in this study
3 讨论
本研究中,CS-EMR对6~14 mm结直肠息肉的治疗安全有效,尤其是6~9 mm息肉完整切除率与HS-EMR(96.7%)相似高达96.1%,并且与HS-EMR相比,迟发性出血、穿孔等不良反应少。然而,实际上在这种较大的息肉切除中不采用高频电凝电切治疗,无论是组织学完整切除率,还是术中出血均是一个很大的挑战。
但本研究中CS-EMR全切除率较高的可能原因有:首先,采用黏膜下注射可将息肉及其周围更大范围的黏膜和黏膜下层与固有肌层分离,间接扩大息肉的水平及垂直切除范围;其次,黏膜下注射抬举病变易于圈套器套取息肉后直接予以机械性勒除,间接弥补了冷圈套因特殊结构而导致的息肉勒除后黏膜缺损处凸起残留物的缺陷,TUTTICCI等[12]研究发现,冷圈套息肉切除后的苍白凸起残留物在直径>6 mm息肉中常见,其主要由黏膜下层和黏膜肌层组成,虽然在锯齿状息肉、腺瘤性息肉、上皮内低级别瘤变的治疗中单纯冷圈套勒除疗效尚可,但在高级别上皮内瘤变病灶的治疗中CSP仍需谨慎采用;而本研究纳入的3例腺癌患者主要以体检或便秘为主诉行肠镜发现肠息肉,按研究分组予以相应术式切除后,病理结果显示,局灶高级别上皮内瘤变、点状癌变,底边切缘阴性。虽然本研究结果显示,两种术式均可完整切除早期腺癌,但例数较少,仍需要多中心大样本研究进一步证实。再者,含有染料的注射液可强化凸显病灶样黏膜与正常黏膜的边界,间接提高完整切除率;最后,CS-EMR术中出血少见,使内镜医师不需要冲洗渗血,视野也清晰,可快速找到残留组织予以再次切除,多重效应确保组织学高完整切除率。
关于术中出血问题:研究结果显示,CS-EMR术中出血率仅稍高于HS-EMR(3.5%vs1.5%)。CHANG等[13]研究显示,单纯CSP术中出血较常见。本研究中CS-EMR虽未采用高频电凝电切术凝固组织及出血点,但术中出血少,其原因可能是由于注入溶液对黏膜下血管造成的填塞效应,或黏膜下组织间隙液体量增加,从而起到压迫止血效果;再则,黏膜下注射或许可减少圈套器对黏膜下动脉及组织的机械损伤。据CS-EMR组的7例术中出血病灶观察中所见,在圈套器还未及时套取息肉组织时大部分黏膜下注射液体已向周围组织渗透弥散,故实际黏膜下的水垫很薄,不足以产生填塞及压迫止血等保护效应,考虑术中出血系病变抬举欠佳。故通过向注射液中加入明胶、羟乙基淀粉、丙三醇、玻璃酸等增加液体黏滞度,以减缓其组织渗透及弥散;以及加入低浓度肾上腺素收缩血管降低术中出血率,是否能更加完善CS-EMR术有待进一步研究证明。
CS-EMR与HS-EMR相比迟发性出血、穿孔等不良反应少。据ICHISE等[14]相关研究显示,电凝是迟发性出血、穿孔等并发症的高危因素。其可能原因:首先,因内镜医师的经验水平及通电模式的选择上存在一定差异,若电凝过深或灼烧时间过长可损坏大量黏膜下血管等组织;其次,电凝术后造成的伤口属于烧灼伤,灼伤的组织细胞变性坏死,切除伤口随时间推移会进一步扩大,甚至演变成迟发性出血、穿孔等术后并发症。据SUZUKI等[15]在冷热圈套器息肉切除的深度及宽度对比研究中显示,HSP后第2天的伤口较原伤口进一步扩大,而CSP术后第2天伤口较原伤口减小,很好地证实了以上说法。CSP后的伤口属于机械性切割伤,仅伤口周边少许细胞受牵拉切割力而损伤,未波及更远组织细胞,细胞未完全变性坏死,在此基础上伤口迅速愈合,一定程度上缩短了术后恢复及住院时间,减少医疗费用和资源的浪费,降低了术后迟发性并发症发生率,或许这也是国内外内镜医师青睐于息肉冷切除术的主要原因。
目前,关于CS-EMR治疗结直肠息肉的相关研究尚少,但其符合ESGE指南[5]推荐的EMR治疗目的:使用最少工具获得完整的圈套切除、足够的切缘、无需辅助灼烧技术。CS-EMR是单纯CSP的一种有价值的改进,既保留了CSP术后并发症低的优点,又具有与EMR术相似的高完整切除率和低术中出血率,故值得大力推广。虽本研究仅探讨了6~14 mm大小息肉,但为其他类型息肉的切除提供了新思路和研究依据。又如双通道CSP联合黏膜下注射成功治疗阑尾隐窝息肉[16],使得阑尾孔上无法完全观察的病灶从外科手术转为内镜下微创治疗成为可能。这也提示我们常规的肠道息肉切除技术与其他内镜诊疗技术联合后会产生意想不到的“惊喜”,更加促使我们内镜医师进一步研究和探索适用于不同类型息肉的最佳切除方式。

