药物性胆汁淤积发生机制与防治研究进展
厉 文,袁 芳,王来友
厉文,袁芳,王来友,广东药科大学药学院 广东省广州市 510006
核心提要:药物性胆汁淤积(drug-induced cholestasis,DIC)是药物性肝损伤常见表现形式,发病率逐年上升.DIC涉及的机制涉及转运蛋白,肝细胞,胆小管等功能或微观结构的改变.针对其发生机制,研究,探索或开发DIC有效防治策略与药物至关重要.
0 引言
肝脏是对药物,异源物和环境毒素进行选择性摄取,代谢和排泄的中枢器官.这一特征使肝脏易遭受药物毒性的侵扰,药物肝毒性也是新药开发被迫终止的主要原因.药物毒性是临床上急性暴发性肝衰竭最常见的原因,约占全部病例数的50%以上.而胆汁淤积和肝细胞损伤及其混合型是药物性肝损伤(drug-induced liver injury,DILI)最常见的表现形式,在最近发布的一项旨在确定中国大陆DILI发生率和原因的回顾性研究中,发现在收集的中国大陆共25927例确诊DILI的病例中,胆汁淤积,肝细胞损伤及混合型三者比例分别为20.31%,51.39%,28.30%,中国大陆DILI年总发生率约为23.80/100万,高于欧洲人群[1,2].胆汁淤积是指肝内外各种原因造成胆汁分泌和排泄障碍,胆汁不能正常流入十二指肠而导致在肝组织蓄积或反流入血液循环的病理状态.近年来随着人口老龄化与临床用药种类及联合用药的比例增加,包括药物性胆汁淤积在内(druginduced cholestasis,DIC)的DILI发病率逐年上升,已引起包括临床药师在内的医务工作者的广泛关注[3,4].
1 临床表型
胆汁淤积临床可表现为瘙痒,乏力,尿色加深和黄疸等,早期常无症状仅表现为血清碱性磷酸酶(alkaline phosphatase,ALP)和γ谷氨酰转肽酶(gamma-glutamyl transferase,GGT)水平升高,病情进展后可出现高胆红素血症,严重者可导致肝衰竭甚至死亡.
药物可导致几种不同类型的胆汁淤积性肝损伤,这些损伤可能以急性或者慢性肝病的形式出现.急性肝病可能伴有黄疸,通常随着停药而迅速消退.然而,实质性肝损伤可能引发非特异性症状,如恶心,不适,肛门排气和疲劳.少数药物引起的胆汁淤积症可能会出现腹痛或不适,例如阿莫西林-克拉维酸盐或红霉素引起的胆汁淤积症.症状可能在开始治疗后几周或几个月出现.而药物引起的慢性胆汁淤积则可出现黄色瘤,瘙痒和黑色素瘤等症状.瘙痒症通常是患者寻求医疗护理的主要原因.药物引起的慢性胆汁淤积通常也会在停药后消退,但在某些情况下,如果有小叶间胆管明显损失(vanishing bile duct syndrome,VBDS),DIC会导致慢性肝病,并可能发展为肝功能衰竭.很少有药物能诱发胆石症或模拟大管硬化性胆管炎,导致肝外梗阻.某些情况下,药物毒性的肝外表现可能为诊断提供线索,比如:阿莫西林-克拉维酸盐引发肝损伤的同时,常伴随急性间质性肾炎和急性泪腺炎.类似的,1981年发生在西班牙的食吃受污染的菜籽油中毒人群同时呈现DIC和肺部毒性[5-7].
DIC临床表型按发生部位,急慢性以及病理特征可分为几类(表1和表2).无肝炎的急性DIC.此类疾病很少发生,并且引起很少或没有肝实质受累.这种药物引起的胆汁淤积在组织学上表现为单纯的小管胆汁淤积,典型地由雌激素或合成代谢类固醇产生.
1.1 急性DIC伴肝炎 胆汁淤积症合并肝炎的特征是门静脉炎症和不同程度的肝细胞损伤和坏死.
1.2 急性DIC伴胆管损伤 此类疾病表现为胆管损伤,实质肝细胞损伤最小.

表1 药物性胆汁淤积综合征的分类
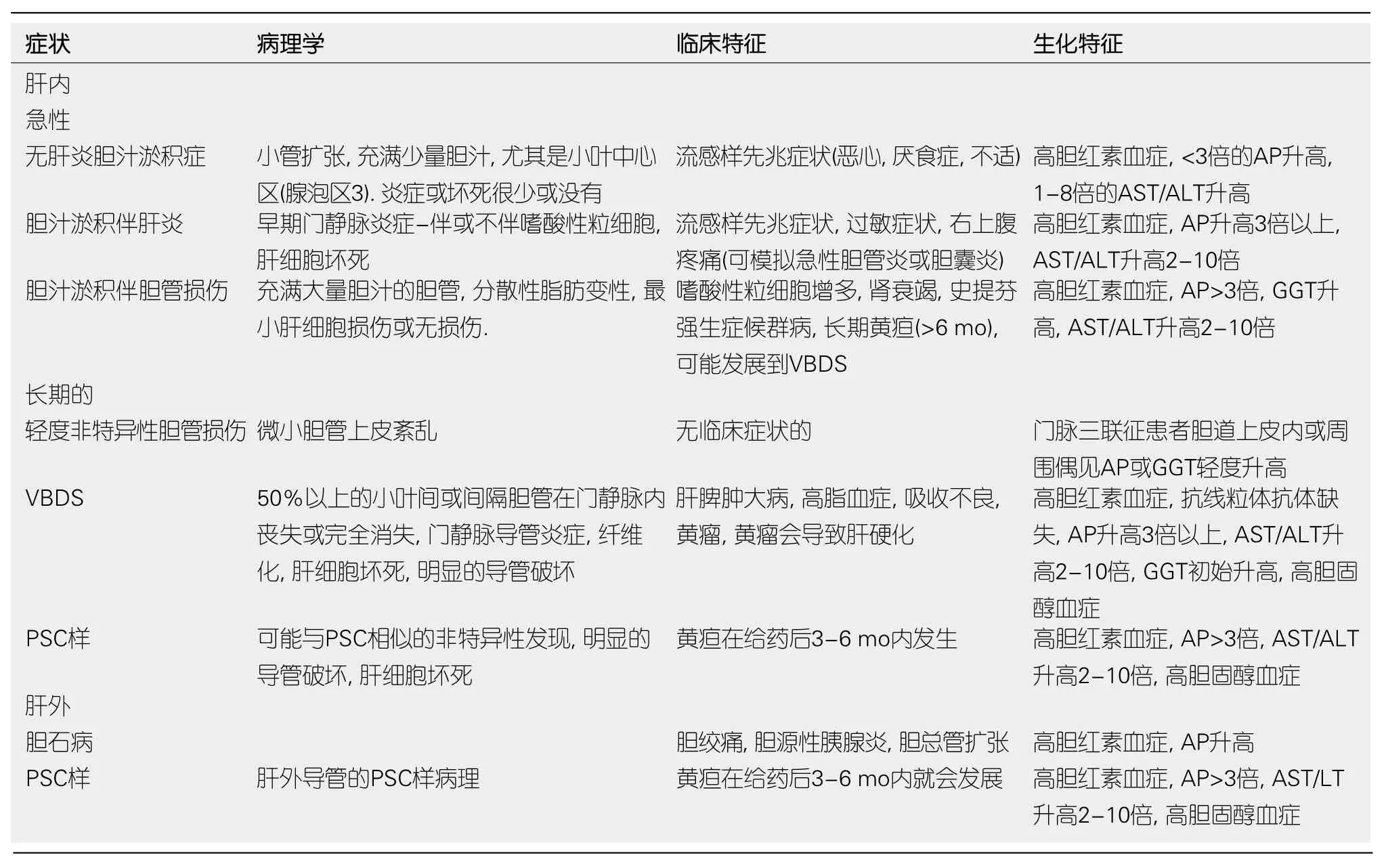
表2 药物性胆汁淤积的临床症状
1.3 慢性药物性胆管疾病 药物诱导的这类胆汁淤积性疾病不同于具有AP或GGT单独升高的无症状患者.尽管一些关于无症状的成人特发性胆管扩张症的报告未能确定病因,但其他报告表明,这些病例可能源于被忽视的药物诱导的胆管损伤.引起各种DIC综合征的常见药物列于表3[3-7].
2 DIC的病理机制
肝细胞是高度极化的细胞,药物进入肝细胞的方式除了易化扩散转运之外,大多数需要转运体的介入(0相代谢),药物被肝细胞摄取与结合胞质蛋白后,会继续Ⅰ相和Ⅱ相代谢反应进行生物转化,产生更多水溶性代谢物.Ⅰ相代谢反应包括氧化,羟基化和细胞色素P450(cytochrome P,CYP)系统介导的其他反应.CYP系统的活性在个体之间差异很大,它们的转录可受到外源物感受器如孕烷X受体PXR和组成型雄甾烷受体CAR的调节; Ⅱ相代谢反应包括与硫酸盐,葡糖醛酸,氨基酸或谷胱甘肽等形成结合物的酯化反应.一般情况下,药物代谢反应会增加水溶性,降低药理活性,从而增强其解毒作用.然而,同样的过程也会导致有毒中间体的产生,特别是在药物浓度增加,酶或转运蛋白表达发生遗传改变和/或抗氧化剂如谷胱甘肽在肝内的浓度降低的情况下,DIC发生的风险会增加.这些DIC一般认为是药物或其代谢物对肝脏不同细胞类型的直接毒性作用,干预肝细胞膜转运蛋白的功能活性,微循环障碍或通过免疫介导的过程引起的[8,9].

表3 引起各种药物性胆汁淤积综合征的常见药物
目前鉴定出的诸多调节胆汁酸和药物跨膜转运的膜蛋白(表4),极大地增进了我们对DIC的理解[10].亲脂性药物及其代谢物排泄到胆汁的过程限制了它们全身清除的速度,这一过程由腺苷三磷酸依赖的小管转运蛋白调节,包括胆盐外排泵(bile salt export pump,BSEP),以及多重耐药相关蛋白2(multidrug resistance-associated protein 2,MRP2).转运有机阳离子(通常为叔胺或季胺)的多重耐药蛋白1(multidrug resistance protein 1,MDR1),转运有机阴离子的乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)和多药耐药蛋白3(multidrug resistance protein 3,MDR3).已知这些转运体的许多药物底物会导致DIC(表4).这些母药或其代谢产物可以破坏肝细胞的转运系统,导致潜在的毒性胆酸对肝脏的损害或者增加肝细胞摄入外源性物质,而后者又会激活对肝细胞的损伤,最终导致DIC[11].
肝细胞转运子,位于基底外侧膜,主要负责运输胆酸和药物,从窦状间隙摄取化学物质.而胆小管的转运子功能则是通过负责清理和分泌药物,胆酸和其他胆汁成分,使之穿过肝细胞的胆管膜汇入胆汁[11].
影响肝脏内胆酸转运子的表达,功能抑制和异常的药物均可能引起胆汁淤积[11].药物对转运子系统的影响可能会导致胆酸蓄积或增加对潜在有害的外源性物质的摄取.
2.1 转运子改变 BSEP表达于肝脏胆小管膜上,是一个外排转运子,负责清除外源性物质,使药物与胆酸经过肝细胞的跨膜转运进入胆汁.负责胆酸的分泌和降低细胞内有害胆酸水平药物对BSEP功能的干扰尤其是抑制被认为是波生坦,环孢霉素,利福平,曲格列酮等药物导致的DILI主要机制,但是由于种属差异,目前仍缺乏合适的具有很好的预测功能的临床前动物模型[12,13].
同样表达于肝脏胆小管膜上的MDR3是三磷酸腺苷酸依赖的磷脂翻转酶,其主要功能是将细胞内的磷脂酰胆碱从肝小叶的小管膜内侧转运到外侧,而在胆酸微团和胆固醇的形成中,磷脂发挥了保护胆管和肝细胞的顶端膜免受胆酸的毒性作用.因而一些对MDR3的功能有抑制作用的药物如伊曲康唑,氯丙嗪等常会导致药源性胆汁淤积.除此之外,阴离子外排泵MRP2被药物抑制后,也可以引起黄疸发生[14].另外,诸多研究表明基底膜转运子MRP3[4]和MRP4,摄入转运子牛磺胆酸辅助转运子和有机阴离子转运多肽1B1,1B3和2B1(OATP1B1,1B3和2B1)[15,16]都参与了胆汁淤积的发病过程.有研究表明,BSEP等转运子基因的常见变异也会导致胆汁淤积的易感性大幅度提高[11].

表4 主要肝细胞膜药物转运体及其已知药物底物的命名,定位和功能
2.2 肝细胞的改变 细胞骨架包括三个主要成分:微管,微丝和中间丝.微管协助了极化膜域的蛋白嵌入,微丝支持胆管的网络形成,调节紧密结合的通透性; 中间丝是细胞骨架主要成分,药物可以通过作用于微管或者细胞角蛋白中间丝来干扰肝细胞的极性[13].大鼠胆管结扎导致的胆汁淤积模型中,会发现微管的重排,并干扰Ca2+,Mg2+-ATP酶依赖的小囊泡转运[17].另外,利福平和雌二醇等可导致胆汁淤积的药物,能影响肝细胞去极化,并且能够通过破坏细胞之间的紧密结合导致肝细胞的改变[14].
肝细胞紧密结合的重要性还体现在可以限制胆汁成分从胆小管向窦状隙扩散的过程.破坏这种紧密结构会干扰胆酸到血浆的梯度渗透和顶端到基底膜的扩散屏障[18].后者会导致胆汁的流动变化,比如:胆汁入血增加,或者胆汁进入细胞间隙.α-异硫氰酸萘酯(α-naphthyl isothiocyanate,ANIT)正是通过破坏这种紧密连接增加通透性而导致胆汁淤积[19].
导致胆汁淤积的药物对肝细胞的另外一个影响是改变胆小管膜上脂质的含量,从而影响细胞膜的流动性.细胞膜的流动性是指对于膜内的脂质的自由运动.胆固醇和鞘磷脂都是决定膜流动性的主要决定因素.降低鞘磷脂浓度会降低膜的流动性[20].在环孢素A和雌二醇诱导的胆汁淤积中,膜上游离胆固醇和胆固醇酯的浓度明显增加[21].
2.3 胆小管的改变 胆汁的流动需要肌球蛋白轻链2的磷酰化和去磷酸化过程引起胆管有节律地收缩.肌球蛋白轻链2的磷酸化和去磷酸化通过蛋白激酶(protein kinase,ROCK),肌球蛋白轻链激酶和肌球蛋白通路等调节子控制.引发胆汁淤积的药物可以在早期干扰胆管动力学,甚至早于转运子的抑制发生之前,比如环孢素A和氯丙嗪二者可通过干扰肌球蛋白轻链的磷酰化和去磷酸化和ROCK活性导致胆小管收缩,而且会继发引起细胞死亡.另外,有报道氟氯西林可激活蛋白激酶C/p38,导致热休克蛋白27的磷酸化从而诱导胆小管的扩张,激发可逆的细胞毒性[22].其它的化学物质,比如波生坦和ANIT,也可以通过抑制肌球蛋白轻链激酶和减少肌球蛋白轻链磷酸化来诱导胆小管扩张[3].
2.4 两类生物反应 针对上述改变,肝脏细胞会继发胆酸蓄积所导致的损害性反应,以及机体旨在清除蓄积胆酸的适应性反应.损害性反应会导致线粒体的损伤,在慢性药源性胆汁淤积中,膜损伤和呼吸链活性的降低都会导致线粒体功能损伤.鹅脱氧甘胆酸盐的蓄积可以诱导线粒体的碎裂,增加细胞的死亡率[23].内质网担负着各种应激的传感和信号功能,尤其在是折叠和翻译后修饰的蛋白分泌旁路中发挥重要作用.除此之外,内质网还有助于为细胞提供一个钙离子富集和氧化的环境.如果在特殊情况下,比如缺氧应激,会导致蛋白质的错误折叠,这被称之为内质网应激(endoplasmic reticulum stress,ERS).环孢素A可以增加ER的应激性表达.研究显示左旋氧氟沙星,氟喹诺酮,红霉素,氯唑西林和耐酶的青霉素类抗生素等能导致胆汁淤积的药物都会增加ERS[24].除此之外,药物通过氧化应激,炎症和细胞死亡等机制也均可导致药源性胆汁淤积的发生.
肝细胞除了胆酸蓄积的损害性反应外,还存在适应性应激反应.在这一过程中核受体发挥着重要作用.胆汁淤积性肝损伤伴随着明显的肝细胞保护机制,目的在于抵消胆酸对内稳态的干扰.大量的转录调节机制可以被胆酸激活,引起细胞摄入胆酸的减少,并且增加外排,通过Ⅰ相和Ⅱ相代谢过程促进改善胆酸的羟基化和共轭结合促进从尿液的排出.这一转录调节过程依赖于核受体的激活.核受体作为配体依赖的转录因子,可上调相关靶基因的表达[25].法尼醇X受体FXR,孕烷X受体PXR,组成型雄甾烷受体CAR,维生素D受体等与维持胆汁分泌和胆管的内稳态关系密切.我们前期通过人源化PXR小鼠模型的研究表明,PXR可介导利福平和异烟肼联用所引起的内源性肝脏毒性物质原卟啉Ⅳ的蓄积,引起DIC.这也是国际上首次报道抗结核药物联用所致胆汁淤积的防治靶点[25].
2.5 遗传因素 越来越多的研究表明基因遗传因素会影响个体对DIC的易感性.对转运子,核受体与药物代谢酶单核苷酸多态性及其功能的研究也是DIC的一个热点领域.现已发现OATP1b1,OATP1b2,MRP2,BSEP,UGT2B7和CYP2C8的SNP与基因变异与药源性胆汁淤积关系密切[26-30].详细的综述可参见已发表的综述[31].这些研究提醒我们,对于DIC患者中调节药物代谢和转运的核受体和代谢酶的遗传因素,仍需要我们去深入研究.
3 DIC的防治
DIC目前尚无特效治疗方法,大多数药物引起的胆汁淤积症会随着药物的停用而得到解决,不会发展成慢性肝病; 同时应避免再次使用导致DIC的药物.除了停用可疑药物外,对已经或随后产生的症状应积极处理.对DIC及其相关症状的治疗国内外学者进行了诸多的探索[32-36].目前,一般认为轻度瘙痒通常可以通过非特异性措施来控制,如润肤剂和温水浴或H1受体阻断剂羟嗪和苯海拉明,胆酸结合树脂如考来烯胺和考来替泊是治疗DIC中重度瘙痒证的常用药物.糖皮质激素仅用于超敏或自身免疫征象明显,且停用肝损伤药物后生化指标改善不明显或继续恶化的患者,且需充分权衡治疗收益或可能的不良反应.
熊去氧胆酸(ursodeoxycholic acid,UDCA)是目前应用最广泛的治疗DIC的药物,多数胆汁淤积性肝病可以通过服用UDCA达到治疗目标.UDCA可以促进内源性胆酸排泌,改变BA的组成,增加亲水性胆酸的比例,保护肝细胞和胆管细胞免受毒性胆酸的侵害.一般服用至胆红素,ALP和GGT基本复常后可考虑停药.UDCA疗效不佳者加用贝特类降脂药物有可能改善对胆汁淤积的疗效.病情较重者可同时加用S-腺苷蛋氨酸(S-adenosylmethionine,SAMe).瘙痒明显时可酌用考来烯胺,但为避免抑制其吸收需与UDCA等药物错开服用.UDCA也是PXR的强激动剂,可上调CYP3A4.对大鼠的实验研究表明,UDCA可明显改善由鬼笔环肽,17β-雌二醇葡萄糖醛酸苷和内毒素诱导的胆汁淤积.UDCA还可增加BSEP和其他有机阴离子转运子如MRP2的表达,促进胆汁分泌.UDCA还能刺激MDR1靶位于小管膜,从而防止环孢菌素引起的胆汁淤积[37].
SAMe参与磷脂酰胆碱合成,是主要的谷胱甘肽前体和甲基供体,可增加疏水性胆汁酸的溶解性,减少活性氧含量,减轻肝细胞毒性作用.动物实验表明SAMe可以改善DILI时氧化应激状态,线粒体功能障碍,改善酒精中毒性CYP的活性失调,促进肝脏功能恢复,因而SAMe也常用于DIC的治疗[38,39].
N-乙酰半胱氨酸(N-acetylcysteine)可以减轻多种自由基的含量,于2004年被批准用于治疗对乙酰氨基酚(acetaminophen,APAP)导致的DILI和非APAP药物导致的急性肝衰竭.另外,在病程较长的胆汁淤积患者中,肠胃外给药途径的脂溶性维生素(维生素A,维生素D和维生素K)也可以考虑[2].
利福平是核受体PXR的强激活剂,诱导CYP相关亚型的表达,这些亚型能够减轻疏水性胆汁盐的毒性.利福平(150-300 mg,一天两次)对不能耐受结合树脂的DIC患者可能有效[4,22].但利福平本身也会导致肝毒性,其它类似的药物尚有苯巴比妥.其它可以考虑的药物有阿片受体拮抗剂纳洛酮和纳曲酮[2-4].
另外,使用分子吸附剂再循环系统的侵入性手术(包括血浆置换和体外白蛋白透析),可以缓解严重瘙痒,但这两种方法都可能需要住院治疗和肾透析人员的大量投入.DIC导致的严重瘙痒可引起睡眠剥脱和心理异常,甚至可以作为DIC肝移植的指征[2-5].有发展为胆汁性肝硬化和肝衰竭风险的患者应考虑转移至肝移植中心.Russo等[40]报道了1990/2002年270例急性药物性肝功能衰竭患者行肝移植治疗,1年生存率可达到70%以上,证实了肝移植治疗有效.
在我国肝病界,中医药的使用是相当广泛的,有独特的疗效,减轻了肝病患者的病痛,延长了生命期.尽管CLD的防治难度很大,中药治疗也没有绝对的把握.但若能充分发挥“辨证论治”的特点和优势,不失为对DIC防治的有益补充.比如甘草类药物具有稳定肝细胞膜,解毒及调节免疫等功能,有研究表明应用甘草类药物或苦参类药物治疗药物性肝损害患者可有效改善其肝功能[41].今后,对DIC患者的精准辩证,个体化中药复方或许是一个有效途径[42,43].
在未来,基因表达谱信息,毒理基因组学和蛋白质组学可有助于更好地理解药物引起的胆汁淤积症的发病机制,基于循证医药学与整合药学的理念,开发特异的DIC的防治药物或中药复方或许不再遥遥无期,比如选择性的PXR拮抗剂用于防治抗结核药物联用所致的DIC[25].
4 结论
DIC症发病机制复杂,不同药物引起胆汁淤积的机制可能存在异同.深入了解DIC的发病机制,对开展DIC预警,预防及优化治疗具有重要的意义,对新药研发过程中肝毒性的评估也具有潜在指导价值.发生胆汁淤积时,迅速识别和撤回涉及的药物是治疗DIC症的主要手段.严重时可采取UDCA等药物和血液净化乃至肝移植等治疗,采取药物治疗时应尽可能避免处方级联的现象,增加患者的负担.
由于我国国情等原因,导致DILI的药物种类繁多,特别是中(成)药占据主要地位; 而大多中药成分不明,一定程度上增加了包括DIC在内的诊断和治疗难度; 我国人口众多,部分地区人们甚至医务工作者对DILI的认识和重视不足,因此全民科普包括DIC在内的DILI的相关常识至关重要,这一方面临床药师及相关的工作人员应承担更多的职责.另外,充分利用好美国的LiverTox网站(http://livertox.nlm.nih.gov)和我国的HepaTox网站(http://www.hepa-tox.org)以及国家,省不良反应中心的信息,建立完善的药物警戒系统也是一个重要方向.DILI临床表现缺乏特异性,早期诊断困难,因此发现客观的血清学标志物,是建立预测模型,早期明确诊断的重要策略.此外,DIC最重要的还是预防.加强DIC相关药物的研究,深入DIC发病机制,预后因素和精准治疗的研究,对已有明确靶点的DIC防治药物开发加大投入,减少药物性肝衰竭的发生,意义重大.

