磷矿区高效解磷菌的分离鉴定及其碱性磷酸酶的克隆表达
宁 清,刘 迪,靳 翔,弓亚杰,薛智权,吕建华
(山西农业大学生命科学学院,山西太谷030801)
山西省是矿产资源大省,为国家经济发展作出了不可估量的贡献,但矿产资源开发的同时也使农业生态环境遭受到了非常严重的破坏。山西省还是全国中药材的主采区之一,是中药资源大省。而在采矿复垦区种植中药材既能改善复垦区土壤生态系统,也可为当地经济发展带来推动力。农业生产的重要物质保障离不开磷,它是植物生长发育中最主要的营养元素之一[1]。然而,矿区复垦土壤因为严重缺乏可溶性磷,造成养分含量降低、微生物数量减少、溶磷活力低下、土壤贫瘠[2-3],导致作物生长缓慢,产量低,质量差。为了满足作物对土壤磷元素的需求,提高作物产量,农民大量施用化学磷肥,但施入磷肥的成本高、有效转化效率过低、浪费严重;同时化学肥料的过度施用会对土壤和水体环境造成严重的污染[4],而且肥料中70% 以上的水溶性磷会与土壤中的Fe3+、Al3+、Ca2+等结合,生成非常难溶的磷酸盐沉淀。生物固定化和其他反应会很快耗尽可用的磷酸供应,留下极少部分供给植物[5-6]。因此,释放土壤中固定化的磷可以增加土壤中磷元素的生物利用度。
土壤微生物在磷循环中起着至关重要的作用,其中,一些细菌可以通过溶解不溶性磷酸盐来提高植物的有效磷库,其被称之为解磷菌。目前报道,较多的解磷菌主要包括芽孢杆菌(Bacillus)、假单胞菌(Pseudomonas)、根瘤菌(Rhizobium)、伯克氏菌属(Burkholderia)、无色杆菌属(Achromobacter)、固氮菌(Azotobacter)、农杆菌(Agrobacterium)、微球菌(Micrococcus)、黄杆菌属(Flavobacterium)、根瘤菌(Rhizobium sp.)等[7-8]。这些溶磷微生物能够通过分泌有机酸、无机酸、嗜铁素、H2S、腐殖质、磷酸酶、胞外多糖等物质或NH4+同化作用将土壤中无效磷转化为植物可以充分利用的有效磷,提升磷肥利用率,改善土壤结构,促进作物生长[5,9]。目前,已有将解磷菌应用于玉米、青菜、小麦、大麦、油菜等作物种植,并取得了较好的效果[3,10-13]。另外,王样庭等[14]从中药材牛蒡的根际土壤中也分离得到了活性较高的溶磷菌株。因此,解磷菌在促进中药材生长等方面也具有潜在的应用价值。
本研究从山西祁县磷肥厂磷矿石堆积区和排污口收集土壤样品,利用选择培养基从样品中筛选具有解磷活性的菌株,并通过分离、纯化、复筛,得到1 株具有高解磷活性的菌株SXAU- S1;结合形态学观察、生理生化特征研究和16S rDNA 序列的方法对该菌株进行了鉴定,另外还克隆并表达了该菌株的碱性磷酸酶基因,旨在了解该菌株的解磷能力,为开发新的廉价、高效且环境友好的微生物菌肥提供科学依据,对加快复垦区土壤生态修复、提高复垦区种植作物的质量和产量具有重要的意义。
1 材料和方法
1.1 试验材料
1.1.1 供试土壤 土壤样品采集自山西省祁县磷肥厂的磷矿石堆积区和排污口。采集方法为3 点采样法,去除表层土,用灭菌后的铲子挖取深度5~20 cm 的土壤,去除石块后,将3 个不同点的土壤样品混合成一份,装入50 mL 无菌离心管中,标记好采样信息,放入4 ℃冰箱保存备用。
1.1.2 培养基
1.1.2.1 筛选培养基NBRIP[15]葡萄糖10 g,磷酸钙5 g,六水氯化镁5 g,七水硫酸镁0.25 g,氯化钾0.2 g,硫酸铵0.1 g,琼脂15 g,去离子水1.0 L,121 ℃灭菌20 min。
1.1.2.2 富集培养基LB 液体培养基 酵母提取物5 g,蛋白胨10 g,NaCl 10 g,去离子水1.0 L,121 ℃灭菌20 min。
1.1.2.3 优化培养基 在1.1.2.1 的NBRIP 培养基的基础上,分别将葡萄糖(10 g)替换为甘油10.23 g、蔗糖9.5 g、乳糖9.5 g,或是分别将硫酸铵(0.1 g)替换为尿素0.04 g、氯化铵0.08 g、硝酸钾0.15 g。
1.1.3 其他试剂 试验所用其他试剂均为国产分析纯。
1.2 试验方法
1.2.1 解磷菌的分离与初筛 将不同的土壤样品各称取10 g 分装到三角瓶中,加入50 mL 双蒸水,富集一晚上;第2 天将其静置20 min,用移液枪吸取上层100 μL 到固体筛选培养基平板上,涂布后在28 ℃进行培养;5 d 后观察,挑取具有较大溶磷透明圈的菌株,接种到筛选培养基上进行划线培养,重复试验直到出现单克隆菌株透明圈为止;接种到富集培养基中摇床培养(220 r/min,28 ℃),24 h后,菌株生长浓度达到要求,取200 μL 菌液和200 μL 甘油保存并标记。
1.2.2 解磷菌鉴定
1.2.2.1 菌株的形态学观察 吸取少许新鲜菌加入生理盐水稀释,在酒精灯上方摇动干燥,用结晶紫初染1~2 min,水洗;晾干后再取碘液复染1 min,水洗,95%乙醇脱色20 s,水洗,番红复染2 min,水洗晾干,在高倍显微镜下观察。
1.2.2.2 菌株的分类学鉴定 试验以所得菌株的总DNA 为模板进行16S rDNA 扩增,通过对其序列比对以确定菌株的种属。总DNA 提取采用细菌基因组DNA 提取试剂盒(康为世纪公司,北京)提取,操作步骤按照说明书进行。所用引物为细菌16S 序列扩增通用引物27F(5′- AGAGTTTGATCATGGCT CAG- 3′)和1492R(5′- GGTTACCTTGTTACGACTT-3′)。PCR 反应体系(50 μL):5 μL10 × buffer,2 μL dNTP,2 μL 27F,2 μL 1492R,2 μL 基因组DNA,1 μL Taq DNA 聚合酶,36 μL ddH2O。PCR 反应条件为:95 ℃预变性3 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸90 s ,共35 个循环;最后在72 ℃延伸5 min。采用1.5%的琼脂糖凝胶电泳检测PCR产物,然后将PCR 产物送到北京华大基因有限公司进行直接测序。采用Blast 软件对所得序列在GenBank 数据库里进行比对,根据同源性确定其种属。
1.2.3 解磷菌生长条件优化
1.2.3.1 碳源和氮源的影响 分别以蔗糖、乳糖、甘油、葡萄糖为筛选培养基中唯一碳源,其培养条件不变,按1%的接种量接种菌株S1,于28 ℃、220 r/min 振荡培养24 h,以不接菌为对照组,每个处理重复3 次,取上清液用酶标板测定600 nm 处的吸光度。同理以尿素、氯化铵、硝酸钾为唯一氮源替换等量氮元素含量的硫酸铵,从而研究不同碳氮源对菌株生长浓度的影响。发酵液解磷活性测定采用钼锑抗法[16]。
1.2.3.2 培养条件优化 根据1.2.3.1 的试验结果,确定最佳的碳源和氮源,采用L16(44)正交试验设计进一步优化S1 的生长条件,以不接菌为对照,重复3 次,试验设计如表1 所示。

表1 培养条件优化试验各因素和水平设置
1.2.4 菌株碱性磷酸酶基因的克隆和表达
1.2.4.1 菌株碱性磷酸酶基因的克隆 根据1.2.2的结果,在GenBank 数据库中搜索成团泛生菌Pantoea agglomerans 的碱性磷酸酶基因序列(JYGW 01000006.1:39510- 40523),以此为参照设计扩增引物C6- AKP- F(5- CCGGAATTCGATGTTTTATTCCCTCCG- 3)和C6- AKP- R(5- CCGCTCGAGCACTT TGGGATTGGTCAG- 3),其中,上游引物划线部分为EcoR I 酶切位点,下游引物划线部分为Xho I 酶切位点。用1.5%琼脂糖凝胶电泳检测PCR 产物,并采用凝胶回收试剂盒(TransGen,北京)对目的条带进行回收。回收产物与pBackZero T Vector(Takara,大连) 连接后转化进Escherichia coli DH5α 感受态细胞,挑取单克隆,采用基因特异性引物PCR 扩增确定插入片段后,将阳性克隆送去测序。
1.2.4.2 菌株碱性磷酸酶基因的表达 将经测序验证序列正确的重组质粒进行EcoR I+Xho I 双酶切,与相同双酶切后的pET22b 表达质粒连接,构成表达重组质粒,并转入到Escherichia coli BL21 表达宿主菌中。挑取单克隆接种到含有氨苄的液体LB 培养基中,37 ℃200 r/min 培养,待菌液的OD600值到0.8 左右时,加入终浓度1 mmol/L 的IPTG,16 ℃200 r/min 诱导培养6 h,离心收集菌体,悬浮于磷酸缓冲液中,超声破碎后,12 000 r/min 离心10 min,留取上清。采用考马斯亮蓝G250 染色法测定蛋白浓度,采用SDS- PAGE 和考马斯亮蓝R250 染色法观察裂解液中蛋白的表达情况。收集2 mL 发酵液的菌体,用500 μL PBS 悬浮,超声裂解后离心,收集上清,取50 μL 裂解液加入到NBRIP 液体中,28 ℃反应30 min 后,测定溶液中有效磷的含量,即为重组菌裂解液碱性磷酸酶的活性。
2 结果与分析
2.1 高效解磷菌的分离与纯化
本试验采用以磷酸钙为唯一磷源的NBRIP 培养平板对菌株进行初步筛选,具有解磷活性的菌株能够分解培养基中的磷酸钙,形成透明圈,结果如图1 所示,通过初筛分离出单克隆11 株解磷菌,编号为SXAU- S1~SXAU- S11;选择透明圈大、生长状况良好的菌株SXAU- S1 进行后续研究。

2.2 解磷菌鉴定

挑取SXAU- S1 单克隆进一步纯化后,采用LB液体培养基进行富集培养,然后吸取菌液进行革兰氏染色,在显微镜下观察结果如图2 所示,可见菌体为革兰氏阴性球菌,菌体直径约0.5~1.0 μm,液体培养状态下呈弥散分布。
提取菌株基因组DNA,电泳结果如图3- A 所示,结果显示,总DNA 含量较少且有部分降解,可能是由菌体裂解时间过长所致。以基因组DNA 为模板,扩增16S rDNA 序列,电泳结果如图3- B 所示,结果显示,在1 500 bp 附近有单一的条带,符合预期设计大小。
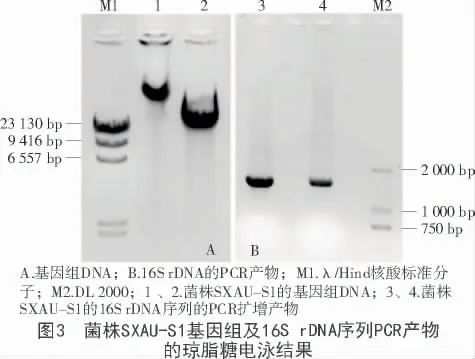
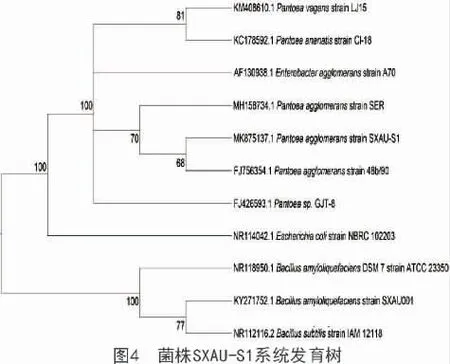
对菌株SXAU- S1 的16S rDNA 扩增片段进行测序,将得到的序列提交到GenBank 数据库中,序列ID 为MK875137。在GenBank 数据库进行比对,并与相近的序列构建进化树,结果如图4 所示,该序列与Pantoea agglomerans strain 48b/90 的16S rRNA 序列(Sequence ID: FJ756354.1)在分类学上位置最接近。结合形态特征,依据《常见细菌系统鉴定手册》,确定该菌株为Pantoea agglomerans,命名为Pantoea agglomerans strain SXAU- S1。
2.3 不同培养基成分对菌株SXAU-S1 生长的影响
2.3.1 不同碳源对菌株生长状况的影响 菌株SXAU- S1 在不同碳源的液体培养基中培养过夜,测得的菌体浓度值如图5 所示。由图5 可知,菌株SXAU- S1 在不同碳源培养基中生长状态存在差异,OD600的测定值大小依次为甘油>葡萄糖>蔗糖>乳糖。以甘油为唯一碳源时,过夜培养的SXAU- S1发酵液达到0.685,显著高于乳糖(P<0.01);也高于以蔗糖和葡萄糖作碳源的培养基,但没达到统计学差异。可能是由于该菌株在生长过程中,优先利用低碳化合物,而乳糖代谢途径比较复杂,菌株SXAU- S1 不能很好地利用乳糖。
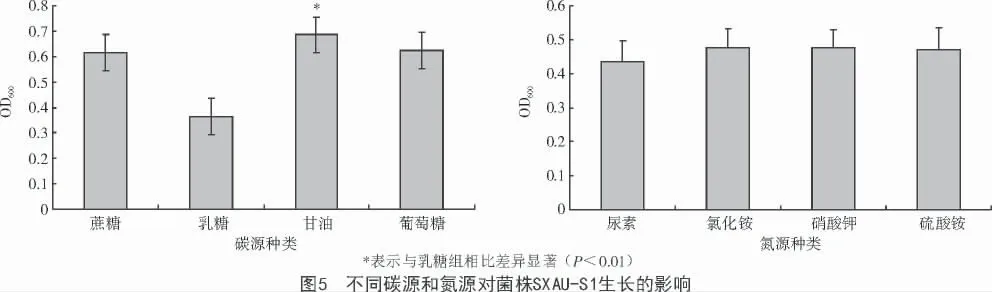
2.3.2 不同氮源对菌株生长状况的影响 由图5可知,菌株SXAU- S1 在氯化铵、硝酸钾和硫酸铵培养基中生长速度差不多,但都比在尿素液体培养基中生长状况要好。可能是由于菌株SXAU- S1 在生长过程中利用无机氮的效率要大于有机氮。
2.3.3 其他培养条件的优化 根据碳源和氮源的试验结果,确定培养基中碳源选用甘油,氮源选用氯化铵,设计4 因素4 水平正交试验,进一步考察培养基pH 值和温度对菌体生长的影响,结果列于表2,根据K 值和R 值可知,4 个因素对菌株SXAU- S1 生长的影响大小顺序为氯化铵>PH>T>甘油。正交试验初步得到,在接种量为1%时,最优条件为氯化铵0.4 g/L、pH 值为9、T 为33 ℃、甘油为10 g/L。
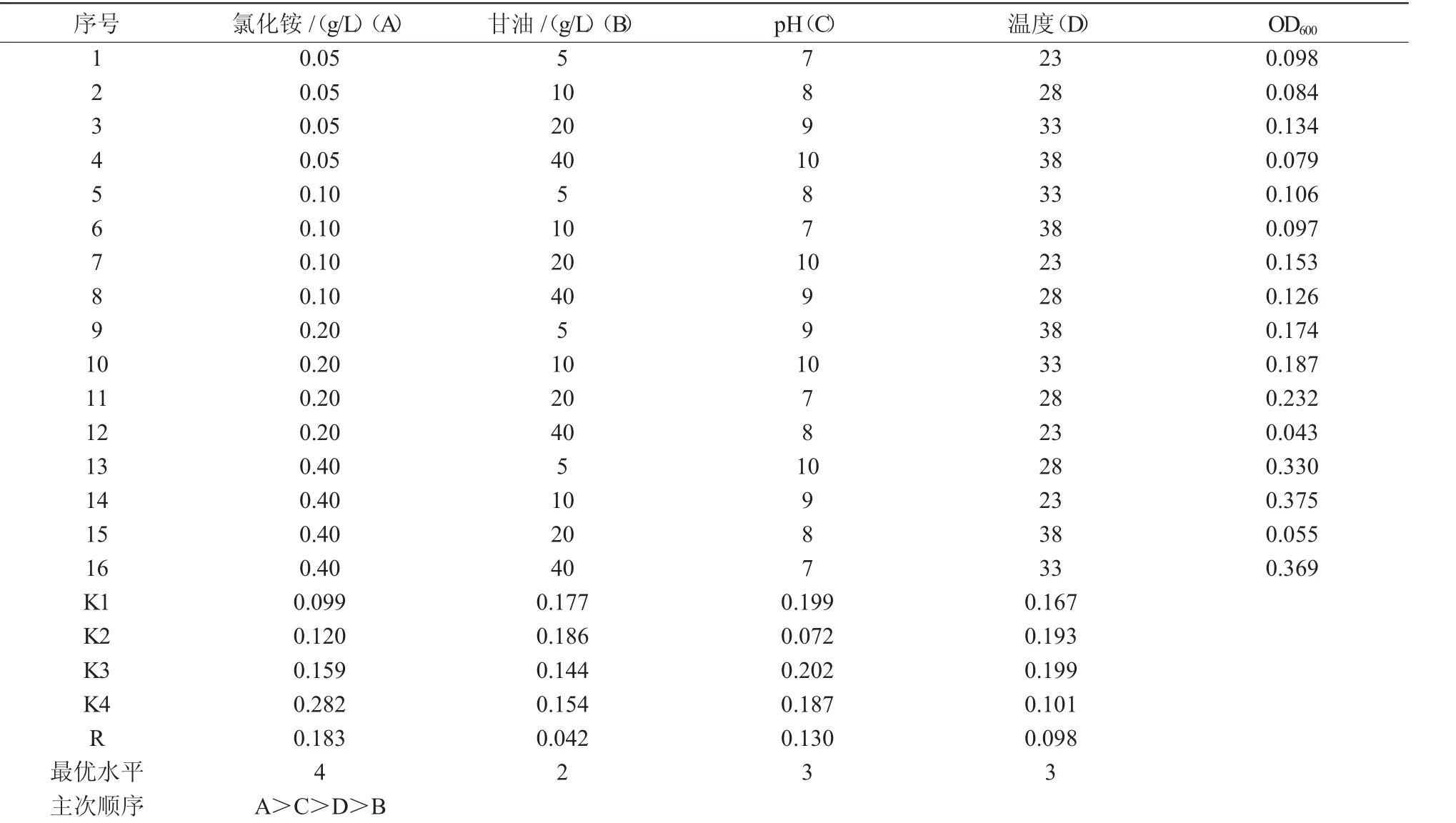
表2 菌株SXAU-S1 培养条件优化的正交试验结果
根据正交试验结果,选择最优培养条件,培养72 h 后,测定发酵液中有效磷的含量和pH 值,结果显示,发酵液中有效磷含量最高达到了287.48 mg/L,而发酵液的pH 值降低到3.67。
2.4 菌株SXAU-S1 碱性磷酸酶基因的克隆与表达
2.4.1 SXAU- S1 菌株碱性磷酸酶基因的克隆 以SXAU- S1 基因组DNA 为模板,以碱性磷酸酶特异性引物C6- AKP- F/R 进行扩增,PCR 产物的琼脂糖电泳结果如图6- A 所示,结果显示,在1 000 bp 附近有单一条带。将该条带切胶回收后,与T 载体相连接构成重组克隆质粒T- akp,转化进Escherichia coli DH5α,挑取阳性克隆进行测序。对得到的序列进行分析,所得序列长度为1 014 bp,是一个包含起始密码和终止密码的完整开放阅读框。经Blast比对,结果发现,该序列与Pantoea agglomerans strain L15 的aminopeptidase 基因(Accession No.:CP034148)具有99%的相似度,二者的开放阅读框长度一致,但是编码区有5 个碱基不同,分别为52(T- G)、110 (T- C)、388 (C- T)、487 (C- T)、1 000(T- C)。进一步将二者的编码序列翻译成蛋白质序列进行比较,结果显示,完全一致,揭示碱性磷酸酶在该菌不同株系中比较保守。
2.4.2 菌株SXAU- S1 碱性磷酸酶基因的表达 阳性表达重组菌不同裂解液的SDS- PAGE 电泳结果如图6- B 所示,结果显示,诱导后的菌体裂解液中,在38 ku 附近有一条明显的蛋白条带,其大小符合以该基因翻译后多肽链计算的结果。
2.4.3 重组菌裂解液碱性磷酸酶活性测定 以NBRIP 液体为底物,加入诱导表达后的菌体裂解液,28 ℃反应30 min 后,检测溶液中的有效磷含量,结果显示,含量达到了941.97 mg/L。根据稀释倍数计算,重组菌裂解液溶磷活性为原始菌株最优培养条件下的32.77 倍。

3 结论与讨论
目前,对解磷菌的研究以芽孢杆菌、假单胞菌、伯克氏菌等为主[17-20],且得到的解磷菌活性普遍较低,有效溶磷能力最高的为215.43 mg/L。本试验从磷矿堆积区筛选得到的菌株为成团泛生菌,作为溶磷菌在以前还鲜有报道。在本试验条件下,该菌的最大溶磷量达到了287.48 mg/L,远远高于前面文献的试验结果。在培养基条件方面,不同碳源会改变产生的有机酸影响解磷菌的生长浓度和解磷效果[5],卫星等[21]筛选出的巨大芽孢杆菌以葡萄糖为碳源时解磷量高于以蔗糖、麦芽糖和淀粉为碳源,且研究发现,培养基中pH 的变化与菌株对碳源的利用次序一致,二者均表明菌株的产酸能力与碳源的利用顺序一致。本研究得到的成团泛生菌株,以甘油为唯一碳源时解磷量高于以葡萄糖为唯一碳源,培养基中pH 的变化与菌株对碳源的利用次序也一致。在氮源方面,成团泛生菌优先利用无机氮,与常慧萍等[19]从小麦根际分离得到的假单胞菌对氮源的选择显著不同,表明菌株的生理特性与其来源相适应。该特点也使本试验中的成团泛生菌很适于应用到采矿区等地的复垦上,对于解决矿区难溶性磷转化问题、改善土壤环境、为矿区作物和中药材的生长提供良好的保障具有重大意义。该菌株碱性磷酸酶蛋白的体外表达也为该酶的工业应用提供了试验基础。
本研究从磷矿区土壤筛选得到1 株具有高溶磷活性的解磷菌,经16S rDNA 鉴定其为成团泛生菌。对其培养条件进行了优化,确定了最佳碳源为甘油,最佳氮源为氯化铵。另外,还克隆了该菌中的碱性磷酸酶,并在大肠杆菌中实现了异源表达。

