冻结与解冻处理对猪肉肌原纤维蛋白凝胶特性及分子间作用力的影响
刁小琴,关文婷,关海宁,张 瑛,云 波,黎 亚
(绥化学院食品与制药工程学院,黑龙江绥化152061)
冷冻是迄今为止一种应用广泛、价格低廉、效果较好的保藏肉的方法;解冻是冻结肉中的冰晶融化,并被肉重新吸收恢复到冻结前新鲜状态的过程[1]。通常肉经冻结、解冻处理后会出现色泽和质地变差、汁液流失、保水性降低等问题[2],因此,冻结与解冻方式的选择对肉的品质起着非常重要的作用。肌原纤维蛋白是猪肌肉的重要组成成分之一,具有持水性、乳化性以及凝胶性等多重功能特性。蛋白质的凝胶特性在肉制品加工中决定着成品的质构和感官。SAELEAW 等[3]研究发现,随着冻结时间的延长,鱼类肌原纤维蛋白形成的凝胶强度变小。任丽娜[4]研究冷冻对白鲢鱼肌原纤维蛋白凝胶形成的影响,结果发现,冷冻会减弱凝胶的形成能力。刘富康[5]研究发现,微波解冻的鱼糜,其凝胶持水力和凝胶形成能力较差。
本试验将猪肉采用- 18,- 50 ℃冻结,然后分别以微波、空气及4 ℃解冻方式对其进行解冻,研究不同冻结与解冻方式对猪肉肌原纤维蛋白凝胶特性及凝胶形成过程中蛋白质分子间作用力的影响,旨在为凝胶的形成机制奠定理论基础,同时为获得维持猪肉凝胶较好品质以及为实际肉品的冻结和解冻提供理论参考。
1 材料和方法
1.1 材料
1.1.1 材料 供试材料为猪背最长肌,购自绥化市大润发超市。购买后快速运回实验室,剔除猪肉表面脂肪和结缔组织,切分为100 g 左右的肉块,进行冷冻处理。
1.1.2 试剂 牛血清蛋白(北京索莱宝科技有限公司);乙二醇双(2- 氨基乙基醚)四乙酸(EGTA)(北京华迈科生物技术有限责任公司);哌嗪- 1,4- 二乙磺酸(PIPE,上海麦克林生化科技有限公司);β-巯基乙醇(分析纯,上海建鑫化工试剂厂);磷酸氢二钠、磷酸二氢钠、硫酸铜、氯化镁、氯化钠等均为分析纯。
1.2 仪器与设备
TH- 120- 150- WA 超低温冰箱(北京天地精仪科技有限公司);GL- 16G- Ⅱ高速冷冻离心机(上海安亭科学仪器厂);DS- 1 高速组织捣碎机(上海净信实业发展有限公司);ZE- 6000 色差计(日本色电工业株式会社);TA- XT plus 型质构分析仪(英国Stable Micro System 公司);752 紫外- 可见分光光度计(上海菁华科技仪器有限公司)。
1.3 试验方法
1.3.1 样品的冻结 切分好的肉块随机分成2 组,每组3 块,分别置于- 18,- 50 ℃条件下冻结,冻藏3 d 后进行解冻处理;同时以新鲜肉样不进行处理为对照组(CK)。
1.3.2 样品的解冻 2 个冻结组分别采用微波解冻、空气解冻(室温20 ℃)和4 ℃条件下解冻。
1.3.2.1 空气解冻 将冻结肉样放入洁净的塑料托盘中,以空气为介质进行自然解冻,肉块中心温度达到4 ℃即可。
1.3.2.2 微波解冻 将冻结肉样放入洁净的塑料托盘中,置于微波炉中,启动质量解冻按钮,解冻到肉块中心温度达到4 ℃即可。
1.3.2.3 4 ℃解冻 将冻结肉样放入洁净的塑料托盘中,置于4 ℃冰箱进行解冻,肉块中心温度达到4 ℃即可。
1.3.3 肌原纤维蛋白的提取 参照XIA 等[6]的方法从不同处理组中提取肌原纤维蛋白,以牛血清蛋白为标准品,采用双缩脲法进行测定[7]。
1.3.4 凝胶的制备 将不同处理得到的肌原纤维蛋白用50 mmol/L PIPES(含0.6 mol/L NaCl,pH 值6.0)配成40 mg/mL 的溶液,将溶解的蛋白溶液分装于凝胶瓶中于4 ℃条件下平衡过夜,次日取出室温平衡30 min,放入72 ℃水浴加热10 min 后立即取出冰浴冷却,用于凝胶强度、白度、持水性以及凝胶在形成过程中蛋白质分子间作用力的测定。
1.4 测定项目及方法
1.4.1 凝胶强度的测定 参考秦传军等[8]的方法,稍作改动。采用质构分析仪进行测定,采用P/0.5 柱形探头(直径12 mm),将凝胶置于探头正下方,前进速度为1 mm/s,穿刺距离为10.0 mm,用穿透力来表示凝胶强度。
1.4.2 凝胶白度的测定 参考于建行[9]的方法,稍作改动。将样品在室温平衡一段时间,用色差计测定,要求凝胶填满整个样品池,样品池底部置于载物台上,每个样品顺着一个方向旋转3 次,分别测定,最后取其平均值。
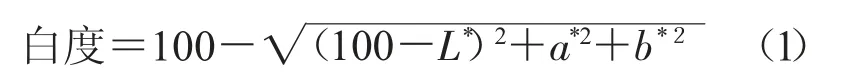
式中,L*值代表亮度,a*值代表红度,b*值代表黄度。
1.4.3 凝胶持水性的测定 参考唐晓婷等[10]的方法,稍作改动。分别称取不同处理的肌原纤维蛋白凝胶样品各5g,放入离心管中,4℃条件下6000r/min离心15 min,倒出上层液体,用滤纸吸干凝胶表面残余的水分。

式中,M1为离心前凝胶的质量(g);M2为离心后凝胶的质量(g)。
1.4.4 凝胶在形成过程中蛋白质分子作用力的测定 将1 g 凝胶分别加入3 种不同的蛋白变性剂中,混合后于13 500 r/min 均质20 s;为了达到最大的溶解度,将其放在80 ℃的水浴锅中加热1 h,4 000×g 离心15 min,吸取上清液,通过双缩脲法测定蛋白含量。其中,蛋白溶解度即为上清液中溶解出的蛋白含量占凝胶中总蛋白的百分比。蛋白变性剂分别为含8 mol/L 尿素的50 mmol/L 磷酸盐缓冲液(pH 值7.0,用以分析氢键的作用)、含0.5%十二烷基硫酸钠(SDS) 的50 mmol/L 磷酸盐缓冲液(pH 值7.0,用以分析疏水相互作用) 和含0.25%β- ME 的50 mmol/L 磷酸盐缓冲液(pH 值7.0,用以分析二硫键的作用)。
1.5 数据统计分析
每个试验结果均用平均数±标准误表示。采用Excel 2010 作图,差异显著性分析采用Statistix 8.1软件进行。
2 结果与分析
2.1 不同冻结与解冻方式对凝胶强度的影响
凝胶强度是凝胶的一个重要品质特性,好的凝胶特性不仅可以提高肉制品的品质,还可以提高产品的得率。由图1 可知,冷冻和解冻处理使肌原纤维蛋白的凝胶强度呈下降趋势。除了采用- 50 ℃冻结4 ℃解冻的处理组的凝胶强度与未经处理的肌原纤维蛋白(CK)差异不显著外(P>0.05),其余处理均较对照组显著下降(P<0.05),这可能是由于冻结及解冻处理使肌原纤维蛋白发生了变性、降解等[11]。
从图1 还可以看出,不论采用哪种解冻方式,- 50 ℃冻结的处理组其凝胶强度显著高于- 18 ℃冻结的处理组(P<0.05),同时,不论采用哪种冻结温度,微波解冻处理组的凝胶强度均表现为最小。SAELEAW 等[3]也报道,冻结会减弱鱼类肌原纤维蛋白的凝胶能力,进而使其强度减小。郭恒等[1]研究发现,鱼肉的硬度随着解冻温度的升高而减小。余力等[12]研究不同的解冻方式对伊拉兔肉品质特性的影响,结果发现,低温解冻后的兔肉硬度下降最小,而微波解冻的硬度下降最大。

2.2 不同冻结与解冻方式对凝胶白度的影响
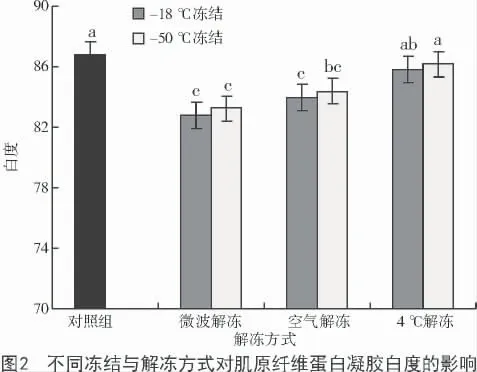
凝胶白度决定凝胶的外观品质。从图2 可以看出,不同的冻结温度与解冻方式均造成了凝胶白度的下降,这可能是由于冻结解冻方式造成了蛋白的变性。HWANG 等[13]也报道了凝胶白度的变化与蛋白质的变性程度有关。
图2 结果还显示,不论是哪种冻结方式,微波解冻与空气解冻均较对照组显著下降(P<0.05),说明这2 种解冻方式对蛋白的变性影响程度比较大,而4 ℃解冻与对照组相比差异不显著(P>0.05),可能是因为低温缓慢解冻温度分布均匀,不易产生局部过热现象,对蛋白的伤害比较小。夏秀芳等[14]研究报道,冻藏过程中凝胶白度的降低可能是由于色素蛋白与肌肉蛋白的交联,使其在蛋白提取过程中,色素蛋白去除不完全。本研究在采用相同的解冻方式下,- 18,- 50 ℃冻结的样品,凝胶白度差异均不显著(P>0.05),这可能是由于冻结时间短,色素蛋白与肌肉蛋白的交联还未发生,或者二者交联程度不大,因此,在蛋白提取过程中,容易被除去。
2.3 不同冻结与解冻方式对凝胶持水性的影响
凝胶的持水性直接影响着凝胶制品的嫩度、多汁性等品质。在凝胶的形成过程中,蛋白质受热变性、聚集、交联成三维网状结构,良好的凝胶能够通过毛细管作用而固定凝胶网络里的水。

从图3 可以看出,肌肉经冻结再解冻处理后,其肌原纤维蛋白凝胶的持水性均表现出下降的趋势,但- 50 ℃冻结、4 ℃解冻的处理组与对照差异不显著(P>0.05)。这可能是由于- 50 ℃冻结与- 18 ℃冻结相比,能在更短的时间内迅速通过- 5~0 ℃这一最大冰晶生成带,有效减小了蛋白质的变性和细胞的损伤,再加上采用4 ℃解冻的方式,升温慢且平稳,解冻产生的能量较弱,解冻的肌肉温度分布均匀,不易产生局部过热现象,较好地维持了凝胶的持水性。而不论是哪种冻结方式,采用微波解冻均造成凝胶持水性显著下降(P<0.05),这可能是由于微波解冻能量比较高,在肌肉传递过程中发生局部聚集,部分蛋白变性,进而造成蛋白形成的凝胶网状结构致密性比较差,持水性较弱。余文晖等[15]研究不同解冻方式对金枪鱼持水性的影响,结果发现,采用微波解冻方式,其持水性最低。ANESE 等[16]研究也发现,冻藏中鱼肉的持水性与硬度存在一定的正相关关系,本研究也得出类似的结论。
2.4 不同冻结与解冻方式对凝胶主要作用力分析
凝胶形成三维网状结构是蛋白质与蛋白质、蛋白质与水分子之间的二硫键、氢键和疏水相互作用之间的作用力达到平衡的结果[17]。JIANG 等[18]报道,凝胶中添加不同的变性剂,能够溶解形成凝胶的蛋白,进而确认维持凝胶稳定的分子间作用力。尿素会破坏凝胶的氢键作用,SDS 破坏的是疏水相互作用,β- 巯基乙醇破坏的是二硫键。经冷冻再解冻后的肌原纤维蛋白凝胶在不同变性剂中溶解度如图4~6 所示。
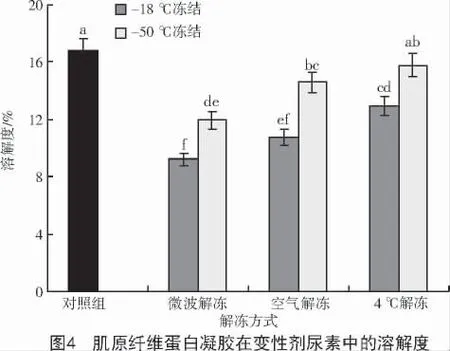
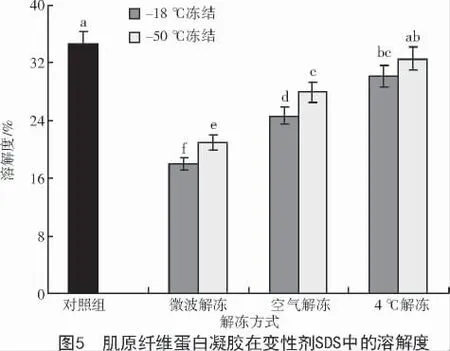

从图4~6 可以看出,经不同冻结和解冻处理的肌原纤维蛋白形成的凝胶中氢键和疏水相互作用与对照组相比,均呈现下降趋势,且以- 18 ℃冻结微波解冻的处理组,对氢键和疏水相互作用破坏最为显著(P<0.05),可能是由于该处理方式造成了肌原纤维蛋白的显著变性,这一结果与上述该处理的肌原纤维蛋白形成的凝胶的持水性和凝胶强度下降一致。从图6 可以看出,经不同处理的肌原纤维蛋白,其二硫键含量均高于对照组,这可能是由于不同处理使蛋白质中的巯基转化成了二硫键。同时,蛋白质凝胶在尿素变性剂中的溶解度相对于其他2 种变性剂较小,说明氢键对维持经冻结及解冻处理后的肌原纤维热诱导凝胶的贡献较小,而疏水相互作用和二硫键交联对分子构象的改变和蛋白分子聚集起主要作用,是凝胶形成的主要作用力。
3 结论
在不同冻结与解冻方式下肌原纤维蛋白的凝胶特性及凝胶分子间的作用力均发生了变化,表现出凝胶强度、白度及持水性降低,采用- 18 ℃冻结、微波解冻的肌原纤维蛋白与未经处理的对照组相比,各理化指标下降最为明显;而采用- 50 ℃冻结、4 ℃解冻的肌原纤维蛋白含量较高且凝胶特性保持较好。同时,凝胶分子间的作用力分析表明,疏水相互作用和二硫键是凝胶形成的主要作用力。因此,在加工、贮藏和运输环节中,尽可能采用较低的温度冻结和低温缓慢解冻,才能够有效保持肌原纤维蛋白的凝胶特性。

