基于Ksp的计算解疑及教学处理
河北
沉淀作为一种溶解现象是学生在义务教育阶段建立的一个化学基本概念,它生动直观,能体现化学变化,彰显学科特色,给学生留下了深刻的印象。高中人教版《必修1》中,又以离子反应的角度,结合微粒观和电性观重申“生成沉淀”的意义和作用。《选修4》中,将难溶电解质重新定位,从变化观念与平衡思想出发,研究它在水中的“变化”,纠正了学生的一些认识偏差,如“沉淀是静止不变的”、“沉淀不溶于水”等等,特别是Ksp的出现,增强了理论内涵。但是,Ksp这一内容在教材中过于后置,师生习惯将其局限在含义的理解、判断及简单计算,很少开发它作为一种常数,将它具有的工具功能整合融入到先期学习内容中,提高问题分析的维度。
为此,教师有必要专门针对一些真实的任务情景,通过分析、求证及数据处理,增强学生对Ksp的应用意识,凸显其概念的定性分析、定量分析及证据推理作用,进而强化学生对化学反应原理应用模型建构过程的理解。
一、为什么常用调节溶液pH法除去杂质离子Fe3+、Al3+?
【例1】(2019·全国卷Ⅲ·26节选)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
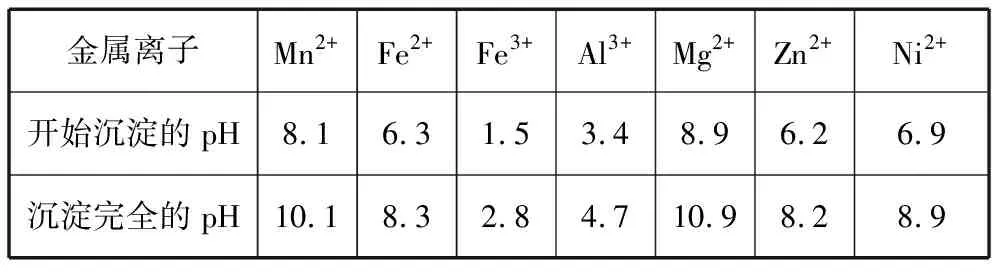
金属离子Mn2+Fe2+Fe3+Al3+Mg2+Zn2+Ni2+开始沉淀的pH8.16.31.53.48.96.26.9沉淀完全的pH10.18.32.84.710.98.28.9
(2)“氧化”中添加适量的MnO2的作用是___________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为________~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是________。
【答案】(2)将Fe2+氧化为Fe3+
(3)4.7
(4)NiS和ZnS
本例题以高纯硫酸锰的制备工艺为背景,考查了调节溶液pH法、沉淀法除去杂质离子的化学原理。笔者针对本例题向准高三学生进行问卷调查,其中认为“表格中形成氢氧化物沉淀的pH可由Ksp计算得到”的占24%,“除去Fe2+需将其氧化为Fe3+再调节溶液pH”的占25%,“本例题中除去Zn2+和Ni2+不宜采用调节溶液pH法”的占27%……结果表明学生习惯叙述性知识的记忆,缺乏对化学原理的深层理解,处于面对新问题不会应用的窘境。

因为Zn2+和Ni2+完全形成氢氧化物沉淀时溶液的pH分别为8.2和8.9,需保留的Mn2+也开始沉淀,因而不能实现有效地分离。由于多数金属硫化物是最难溶的物质,工业上常使用H2S或Na2S沉淀金属离子。当使用Na2S沉淀Zn2+和Ni2+时是否会产生MnS的共沉淀,如何控制?当学生提出了这样的问题时,可以说明他们基于Ksp的应用能力已经有了较大的进步。
二、MnS可溶于盐酸,但为什么CuS不溶于盐酸呢?
【例2】(2016·天津卷·3改编)“在同浓度的盐酸中,MnS可溶而CuS不溶,说明CuS的溶解度比MnS的小”是否正确?
【答案】正确。

上述推理过程,重视理论计算,凸显了多重平衡规则及应用,有利于提升学生的化学反应原理的分析水平。相反,若教学时仅靠定性陈述和结论,讲不通时干脆让学生死记硬背,缺少必要的推理思维和数据分析,迁移应用能力的形成以及可持续发展就无从谈起。


三、食盐精制过程中,需要几次过滤?
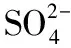
【例3】实验室常用MnO2与浓盐酸反应制备Cl2。制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与已知量CaCO3(过量)反应,称量剩余固体的质量。判断该方案的实验结果__________(填“偏大”“偏小”或“准确”)。[已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11]
【答案】偏小
四、教材附录“部分酸、碱和盐的溶解性表(室温)”中Fe2+与为何是“不”而非“—”呢?
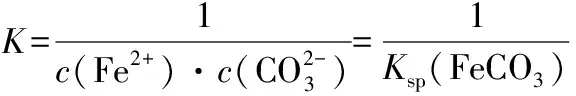
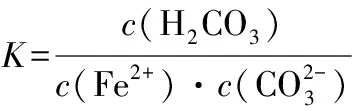

【例4】(2019·全国卷Ⅲ·26节选)(题干见例1)写出“沉锰”的离子方程式:____________________。


五、Mg(OH)2不溶于水,但为什么使酚酞变色?
在义务教育阶段学生形成了Mg(OH)2不溶于水的事实性认知,基于此,在高中人教版《必修1》食盐精制实验时,杂质离子Mg2+就是加入NaOH使其完全形成Mg(OH)2沉淀而分离出去的。在《必修2》探究元素金属性时,将镁带加入到滴入酚酞的水中,加热至水沸腾,发现镁带上有大量气泡、溶液变浅红色。很多学生心生疑窦:明明Mg(OH)2不溶于水,但为什么它又能使酚酞变红呢?

【例5】室温下,Fe(OH)3悬浊液的pH约为________(已知:室温时,Fe(OH)3的Ksp为4.0×10-38、Kw=1×10-14)。
【答案】7
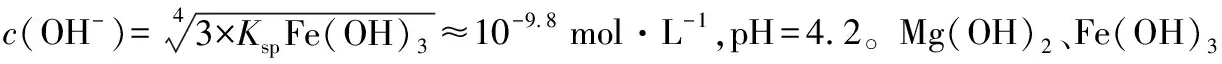
六、使用AgNO3标准溶液滴定溶液中的Cl-时,为什么可用K2CrO4作指示剂?

【答案】2.0×10-55.0×10-3

本例题以沉淀滴定为主题,考查共沉淀平衡体系中的离子浓度基于Ksp的简单计算,表面看似是一种数字游戏,实则不然,计算的背后隐含着沉淀滴定原理和指示剂的选择要求。教学时教师可搭建问题支架,诱思探究:待测离子和指示剂离子是同时形成沉淀吗?指示剂是否需要限量?能否使用KI、KBr作指示剂?
若使用KI作指示剂时,由于AgI与AgCl结构相似,且AgI的Ksp远远小于AgCl的Ksp,在相同的浓度条件下进行滴定,被测离子和指示剂离子沉淀先后顺序错位而使滴定失败。至此,沉淀滴定原理在上述分析的过程中就体现完全了。
综上案例分析,Ksp是反映难溶电解质在水中的溶解能力的重要标尺,它在判断难溶电解质的溶解平衡的移动方向,深化理解沉淀的形成、溶解与转化等方面具有广泛的应用价值。但由于课本的设置和学生的思维,当前的教学现状是先具体物质性质,后Ksp概念及相关理论,呈现明显的脱节和割裂。因此,强化Ksp概念与相关化合物性质之间的内在联系,弥补高一阶段被动接受定性结论的教学缺陷,构建难溶电解质的离子反应系统观是高三复习教学的必然要求。第一,师生树立一种“Ksp是难溶电解质溶解性的定量表达”的基本观念。Ksp的应用是用数据说话,是证据推理,有化晦涩为浅显、化复杂为简单的教学效果。第二,创设情景,强化运用,整合教学。如复习“复分解反应的条件”时,教师可引导学生思考为什么离子之间生成沉淀就能发生反应呢?这与沉淀的Ksp有关系吗?学生在老师的启发下计算离子反应的平衡常数,发现沉淀反应的K是沉淀的Ksp的倒数,由于沉淀的Ksp很小,所以K就很大,离子反应就容易发生,学生们就会恍然大悟,原来早已熟知的结论可以这样理解,在应用中感受了理论的魅力。第三,学会建构运用Ksp计算推理的思维模型。Ksp的数学表达式是出发点,里面包含着溶解平衡中各离子浓度之间的数量关系,涉及难溶电解质的化学反应,它自发进行的方向和限度可用平衡常数来描述,平衡常数中“埋伏”着难溶电解质的Ksp等常数,遂使问题得以定量分析。第四,加强总结归纳。如:注意不同沉淀的阴阳离子个数比,把握沉淀的先后顺序或转化方向,掌握计算复杂离子反应平衡常数时的“整体代换”技巧,区分完全沉淀和开始沉淀等。
涉及难溶性电解质的问题很多,Ksp的介入和计算推理是分析和解决它们的一个途径,但并非每个问题都需要Ksp的“较真”,具体问题具体分析才是王道。

