基于思维模型结构的氧化还原反应方程式书写策略——以2019年全国卷高考试题为例
湖北
纵观历年高考化学方程式或离子方程式的书写,绝大多数都是以陌生情景中氧化还原反应方程式的书写作为考查的重点。高考命题者如此青睐氧化还原反应,不仅仅是因为氧化还原反应作为高中必备的核心知识必须加以考查,而且氧化还原反应还蕴含丰富的学科思想方法,承载学科的核心能力——学生灵活运用已有知识解决陌生情景中实际问题的能力,体现了化学学科核心素养“宏观辨识与微观探析”“证据推理与模型认知”的考查意图。加之这样的试题具有一定的难度和很强的区分度,因而是高考中必不可少的一道化学大餐。用心咀嚼,细细品味,给人以回味无穷之感。下面笔者以2019年全国高考化学试题为例谈谈有关陌生情景中氧化还原反应方程式的书写策略,从中感悟规律,悟法开窍,希望能对2020届高三学生有所裨益。
一、正确认识氧化还原反应的思维模型是解题的关键
1.氧化还原反应的思维模型

图1 氧化还原反应的一般思维模型图
在此一般思维模型中,氧化还原反应蕴含着化学众多的学科思想方法:认识物质性质及转化关系的思路方法——物质转化的一般规律;氧化性和还原性的强弱规律;化合价升降守恒规律;得失电子守恒规律;离子反应所遵循的电荷守恒规律;质量守恒定律(原子守恒、元素守恒、物料守恒)等等。
2.氧化还原反应的学科价值
氧化还原反应的学习体现了学科的价值,主要体现在:
从转化的视角看,认识元素在物质中可以具有不同价态,可通过氧化还原反应实现含有不同价态元素的物质的相互转化。
从分类的视角看,学生能够建立对化学反应分类的新视角,特别是形成化学反应认识的新视角,能够更全面地认识物质性质和转化;
从思维的视角看,学生对于相关的实际现象和问题的解释分析能力将得到进一步的提高,使认识思维从低阶向高阶发展;
从应用的视角看,作为工具建构原电池和电解池装置,用于分析电池的形成,凸显学科教学的应用价值;
从辩证的视角看,氧化反应和还原反应作为对立的统一体,从电子的失和得、化合价的升和降、反应物的氧化性和还原性、氧化产物和还原产物,全面揭示了物质的对立统一规律。
二、从物质类别和元素价态变化的视角认识物质的转化路径
结合物质类别和元素价态两个角度,依据氧化还原反应原理,预测物质的化学性质和变化,建立认识物质转化的二维模型,重点关注元素化合价变化。以“氧化还原”视角再认识物质的转化,帮助学生形成全面的认识物质性质和转化的“元素化合价-物质类别二维模型”(如图2所示)。

图2 元素化合价-物质类别二维模型图
该“元素化合价-物质类别二维模型图”(简称“价-类模型”)是在氧化还原反应一般思维模型的基础上,从物质分类与元素化合价的视角给学生以直观明晰的思维结构:
(1)确定某物质及其化合价所处的位置,以此来判断该物质具有的性质(氧化性、还原性)。
(2)明确发生氧化反应或还原反应之后,该物质中核心元素的化合价变化,并且通过箭头指向来表达反应的过程(找到反应物和生成物),同时能够看到物质之间转化的多种途径。
(3)通过化合价所处的位置,掌握该物质具有的类别通性。
三、梳理常见物质的转化是书写氧化还原反应方程式的必备工具
从高中教材及高考试题中梳理常见物质及其转化关系,是高中学生必备的基础性工具知识,因此,学生应熟记常见的氧化剂和还原剂并判断还原产物和氧化产物。

强氧化剂被还原之后的产物强还原剂被氧化之后的产物Na2O2NaOHFe2+Fe3+Fe3+Fe2+SO2SO2-4NO2NOH2SO3SO2-4HNO3(浓)NO2Na2SO3、NaHSO3SO2-4HNO3(稀)NOH2SS、SO2、SO2-4H2O2H2OH2O2O2H2SO4(浓)SO2Na2S、NaHSS、SO2、SO2-4X2(卤素单质Cl2、Br2、I2)X-(Cl-、Br-、I-)Na2S2O3SO2-4ClO-、KClO3Cl-NaII2、IO-3NaClO、Ca(ClO)2Cl-NH3NO、N2KMnO4(H+)、MnO2(H+)Mn2+K2Cr2O7(H+)Cr3+
学生可结合上表中物质的转化(或离子的转化),依据“价-类二维模型”,感悟其分析问题的一般方法。常见的铁及其化合物之间的相互转化关系如下:
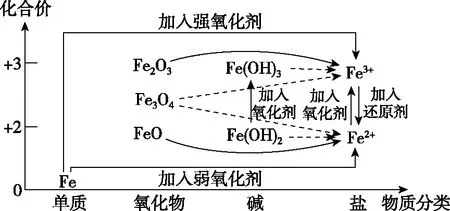
图3 铁及其化合物的价-类二维图
四、掌握有序书写信息型氧化还原反应方程式的一般步骤
第1步:找出发生氧化还原反应的粒子。根据元素价态和氧化还原顺序规律确定氧化剂和还原剂。
第2步:合理地预测产物。根据化合价规律及题给信息和已知元素化合物性质确定相应的还原产物、氧化产物。
第3步:配电子。即转移电子数守恒。根据化合价升降总数相等确定发生氧化还原反应转移的电子总数也应相等,确定氧化剂、还原剂、氧化产物和还原产物的化学计量数。
第4步:配电荷。即方程式两边电荷守恒。根据溶液的酸碱性,通过在反应方程式的两端添加H+或OH-的形式使方程式两端的电荷守恒。
第5步:配原子。即遵守质量守恒定律,方程式左右两边各种元素的原子数守恒。根据原子守恒,通过在反应方程式两端“补缺”H+、OH-和H2O(或其他小分子、离子)使方程式两端的原子守恒。其“补缺”技巧:
H+→H2O(酸性)、OH-→H2O(碱性);
H2O→H+(中性或酸性)、H2O→OH-(中性或碱性)。
五、例析2019年高考陌生情景氧化还原反应方程式的书写
(一)典例剖析
【例题】(2019·全国卷Ⅲ·26改编)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
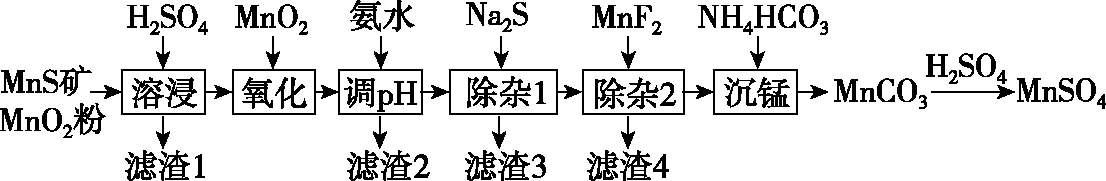
(1)“滤渣1”含有S和________;写出“溶浸”中二氧化锰与硫化锰反应的离子方程式:____________________。
(2)“氧化”中添加适量的MnO2的作用是___________________。

(2)将Fe2+氧化为Fe3+
【命题意图】本题以工业上制备高纯硫酸锰的工艺流程图作为载体,考查元素化合物间的相互转化与物质的分离提纯,重点考查了陌生情景下氧化还原反应方程式的书写。其情景素材来源于科学研究的成果《二氧化锰和硫化锰两矿法制备高纯硫酸锰》(刘清华著),试题中的工艺流程进行了简化和改进。
【思路分析】硫化锰矿中的Si元素主要以SiO2或不溶性硅酸盐存在,SiO2与硫酸不反应,所以滤渣1中除了S还有SiO2;在硫酸的溶浸过程中,二氧化锰和硫化锰发生了氧化还原反应,二氧化锰作氧化剂,硫化锰作还原剂。运用“价-类二维模型”来分析反应物MnO2和MnS反应的产物:

图4 锰、硫及其化合物的价-类二维图
【解析】第1步:找出发生氧化还原反应的粒子:MnO2中Mn为+4价,处在高价,因而具有氧化性;MnS中S为-2价,处在最低价,因而具有还原性。
第2步:合理地预测产物:MnO2发生还原反应,Mn元素化合价降低,产物一般为+2价的Mn2+;MnS发生氧化反应,S元素化合价升高,氧化产物一般为单质S。由此可得,MnO2+MnS——2Mn2++S。
第3步:配电子。由于MnO2→Mn2+是得到2e-;MnS→S是失去2e-,因此,得失电子已经相等了。
第4步:配电荷。由于加入的是硫酸溶浸,且方程式右边总共有4个单位的正电荷,因而在方程式的左边补上4个H+,使得方程式左右两边电荷守恒。即MnO2+MnS+4H+——2Mn2++S。
第5步:配原子。根据原子守恒,显然在生成物的一边要加2个H2O,即MnO2+MnS+4H+——2Mn2++S+2H2O。这样该离子化学方程式就配平了。

【点评】书写陌生情景中氧化还原反应方程式,其核心在于理解氧化还原反应的思维模型,从物质类别和元素价态变化的视角认识物质的转化路径,找准氧化剂和还原剂、氧化产物和还原产物。在氧化还原反应中,元素化合价升高,失去电子,该物质作还原剂,变为氧化产物;元素化合价降低,获得电子,该物质作氧化剂,变为还原产物。元素化合价升降总数等于反应过程中电子转移的数目,可利用最小公倍数法配平氧化还原反应方程式,对于离子反应,同时还要符合电荷守恒及原子守恒。
(二)真题演练
1.(2019·全国卷Ⅰ·27改编)硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
步骤③中发生反应的离子方程式:___________________。
选用足量的H2O2,理由是____________________。
2.(2019·全国卷Ⅱ·26节选)立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。
以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
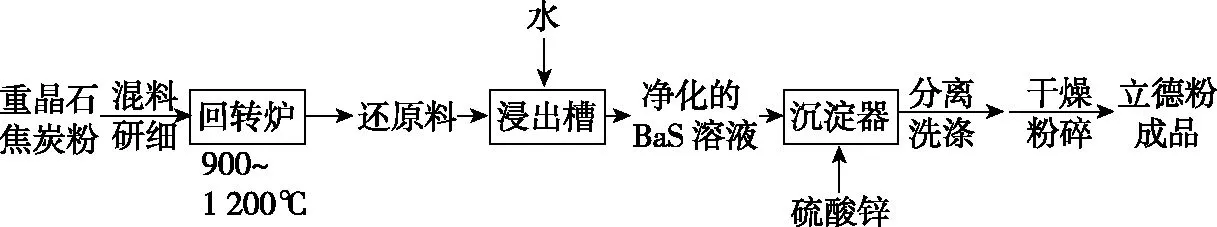
在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为________________________。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为________________________。
3.(2019·北京卷·26节选)化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。
Ⅰ.用已准确称量的KBrO3固体配制一定体积的amol·L-1KBrO3标准溶液;
Ⅱ.取v1mL上述溶液,加入过量KBr,加H2SO4酸化,溶液颜色呈棕黄色;
Ⅱ中发生反应的离子方程式是__________________。
4.(2019·天津卷·2)下列离子方程式能用来解释相应实验现象的是

( )
5.(2019·江苏卷·16节选)N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________________。

6.(2019·江苏卷·18·节选)将一定量的FeSO4·7H2O溶于稀硫酸,在约70℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为____________________。
【参考答案】


4.A


