图解“位—构—性”试题
江西
在近几年的高考题中,元素推断及“位-构-性”试题每年必考,笔者以近三年全国卷为例,总结了解答该类试题的思维方式和方法技巧,并预测明年该类高考试题的考查方向,望对2020届考生及一线教师有所帮助。
一、三年试题分析
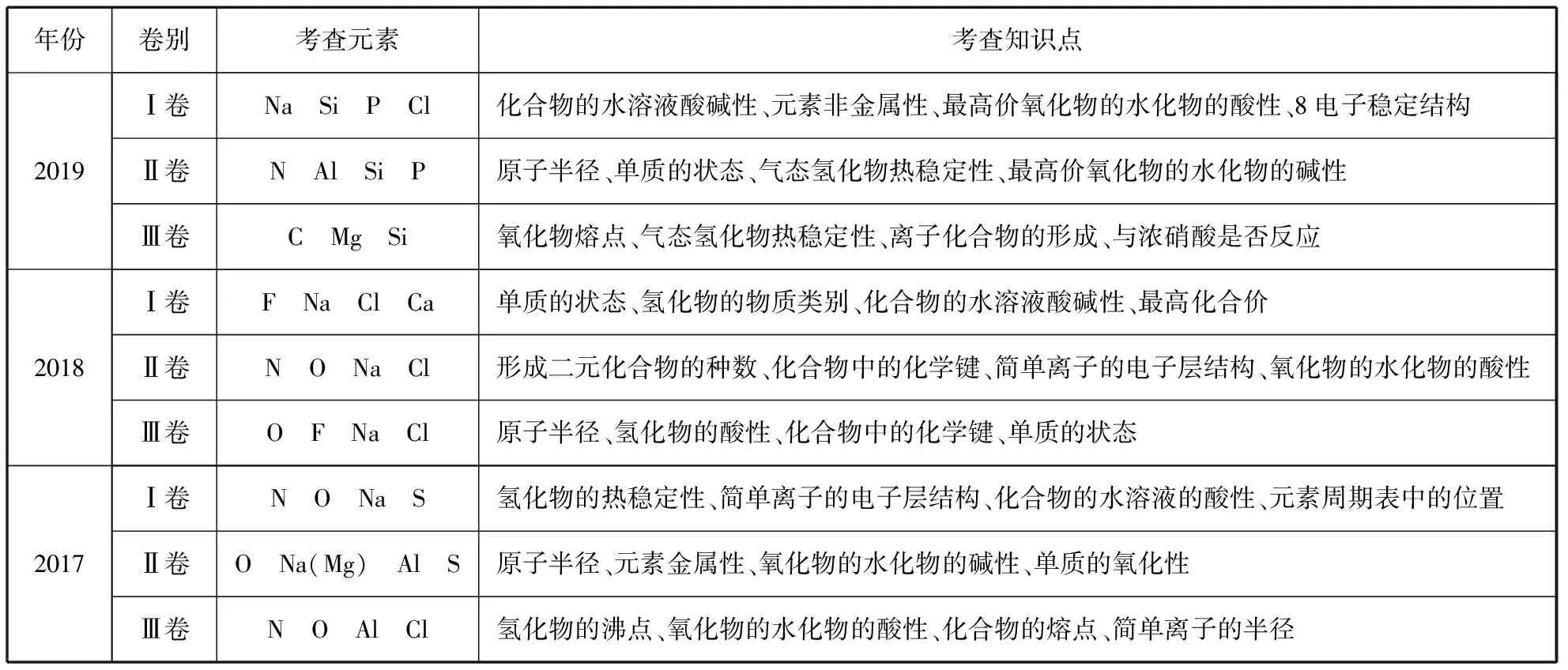
年份卷别考查元素考查知识点2019Ⅰ卷Na Si P Cl化合物的水溶液酸碱性、元素非金属性、最高价氧化物的水化物的酸性、8电子稳定结构Ⅱ卷N Al Si P原子半径、单质的状态、气态氢化物热稳定性、最高价氧化物的水化物的碱性Ⅲ卷C Mg Si氧化物熔点、气态氢化物热稳定性、离子化合物的形成、与浓硝酸是否反应2018Ⅰ卷F Na Cl Ca单质的状态、氢化物的物质类别、化合物的水溶液酸碱性、最高化合价Ⅱ卷N O Na Cl形成二元化合物的种数、化合物中的化学键、简单离子的电子层结构、氧化物的水化物的酸性Ⅲ卷O F Na Cl原子半径、氢化物的酸性、化合物中的化学键、单质的状态2017Ⅰ卷N O Na S氢化物的热稳定性、简单离子的电子层结构、化合物的水溶液的酸性、元素周期表中的位置Ⅱ卷O Na(Mg) Al S原子半径、元素金属性、氧化物的水化物的碱性、单质的氧化性Ⅲ卷N O Al Cl氢化物的沸点、氧化物的水化物的酸性、化合物的熔点、简单离子的半径
二、“位-构-性”试题的“四层四翼”特点

三、两年试题分析
【例1】(2019·全国卷Ⅰ·13)科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是
( )

A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
【答案】C
【解析】
1.图解

2.逐项分析
选项A,WZ为NaCl,为强酸强碱盐,其水溶液显中性,错误;选项B,X、Y、Z三种元素分别为Si、P、Cl,均为第三周期元素,原子序数依次增大,非金属性依次增强,错误;选项C,Y为P元素,其最高价氧化物的水化物为H3PO4,在水溶液中电离不完全,定义为中强酸,正确;选项D,化合物中Y为P元素,和Si原子共用2对电子,阴离子得到Na原子失去的电子,所以P原子满足8电子稳定结构,错误。
【试题点评】
本题体现了高考试题的创新性,试题素材来源新,呈现形式新,在历年的高考试题中,元素推断及“位-构-性”试题均未以此种形式进行考查。在解答本题过程中,特别需要注意,新化合物为离子化合物,存在阴阳离子,结合价键知识,可以顺利地推出几种元素从而正确作答。
【例2】(2019·全国卷Ⅱ·9)今年是门捷列夫发现元素周期律150周年。如表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
( )

A.原子半径:W B.常温常压下,Y单质为固态 C.气态氢化物热稳定性:Z D.X的最高价氧化物的水化物是强碱 【答案】D 【解析】 1.图解 2.逐项分析 选项A,W、X分别为N元素和Al元素,N原子有2个电子层,Al原子有3个电子层,电子层数越多,半径越大,所以原子半径:N 【试题点评】 本题体现了高考试题的基础性和综合性,以元素周期表的一部分为基础,结合题意推断出几种元素,主要考查了元素周期律的相关知识。该题在解答的过程中,根据元素周期律知识也可直接判断A、C选项的说法是正确的,再根据X、Y、Z为第三周期元素,第三周期主族元素的单质中,常温常压下只有Cl2为气态,其他均为固态,可知B选项说法也是正确的。所以,并不需要推断出具体的元素也可正确得出本题答案。 【例3】(2019·全国卷Ⅲ·9)X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10,X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是 ( ) A.熔点:X的氧化物比Y的氧化物高 B.热稳定性:X的氢化物大于Z的氢化物 C.X与Z可形成离子化合物ZX D.Y的单质与Z的单质均能溶于浓硝酸 【答案】B 【解析】 1.图解 2.逐项分析 选项A,X常见的氧化物有CO、CO2,在常温常压下均为气态,熔点较低,Mg的氧化物为MgO,在常温常压下为固态,熔点较高,错误;选项B,X、Z的气态氢化物分别为CH4和SiH4,同主族元素从上到下非金属性逐渐减弱,C的非金属性强于Si,故气态氢化物的热稳定性:CH4>SiH4,正确;选项C,C和Si可形成化合物SiC,为共价化合物,错误;选项D,Mg可溶于浓硝酸,但Si不溶于强酸强碱,只溶于HF,错误。 【试题点评】 本题体现了高考试题的基础性和综合性,解答本题时要有清晰的思维,对最外层电子数之和以及X和Z同主族要有清楚的认识,突破了这个难点,问题就迎刃而解了。 【例4】(2018·全国卷Ⅰ·12)主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是 ( ) A.常温常压下X的单质为气态 B.Z的氢化物为离子化合物 C.Y和Z形成的化合物的水溶液呈碱性 D.W与Y具有相同的最高化合价 【答案】B 【解析】 1.图解 2.逐项分析 选项A,Na在常温常压下为固态,错误;选项B,Z的氢化物为CaH2,属于金属氢化物,为离子化合物,其电子式为[H∶]-Ca2+[∶H]-,正确;选项C,Y和Z形成的化合物为CaCl2,为强酸强碱盐,水溶液显中性,错误;选项D,W为F元素,一般无正价,Y为Cl元素,其最高正价为+7价,错误。 【试题点评】 本题体现了高考试题的基础性和综合性,试题中的四种主族元素的原子序数均不大于20,说明其中原子序数最大的元素可能为Ca,联想到萤石(主要成分CaF2)和浓硫酸反应可生成HF,即可快速确定W和Z元素。 【例5】(2018·全国卷Ⅱ·10)W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同,下列叙述正确的是 ( ) A.X与其他三种元素均可形成两种或两种以上的二元化合物 B.Y与其他三种元素分别形成的化合物中只含有离子键 C.四种元素的简单离子具有相同的电子层结构 D.W的氧化物对应的水化物均为强酸 【答案】A 【解析】 1.图解 2.逐项分析 选项A,O与其他三种元素可形成两种或两种以上二元化合物,可与N元素形成N2O、NO、NO2、N2O3、N2O4、N2O5等多种化合物,可与Na元素形成Na2O、Na2O2两种化合物,可与Cl元素形成ClO2、Cl2O、Cl2O3、Cl2O5、Cl2O7等多种化合物,正确;选项B,Na与O形成的化合物Na2O2中既有离子键又有共价键,错误;选项C,N3-、O2-、Na+核外都是两个电子层,具有相同的电子层结构,Cl-有三个电子层,电子层结构不相同,错误;N的氧化物对应的水化物有HNO2、HNO3等,HNO3是强酸,HNO2是弱酸,错误。 【试题点评】 本题体现了高考试题的基础性和综合性,着重考查了二元化合物问题,需要学生具有发散的思维。在解答的过程中,红棕色气体是突破口,但优生或许会在此陷入困境,N2和O2在放电条件下只能生成NO,并不能得到红棕色气体NO2,此题巧妙之处在于,红棕色气体并非一步得到,在反应的过程中,NO可以和O2反应得到NO2。 【例6】(2018·全国卷Ⅲ·13)W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到含YZW的溶液。下列说法正确的是 ( ) A.原子半径大小为W B.X的氢化物水溶液酸性强于Z的 C.Y2W2与ZW2均含有非极性共价键 D.标准状况下W的单质状态与X的相同 【答案】D 【解析】 1.图解 2.逐项分析 选项A,W、X、Y、Z四种元素的原子半径大小依次为Na>Cl>O>F,错误;选项B,X和Z的氢化物分别为HF、HCl,其中HF是弱酸,HCl是强酸,错误;选项C,Na2O2中既有离子键又有非极性共价键,ClO2中不存在非极性共价键,错误;标准状况下,O2和F2均为气态,状态相同,正确。 【试题点评】 本题体现了高考试题的基础性和应用性,从黄绿色气体可知为Cl2,Cl2再与NaOH溶液反应又得到了NaClO,涉及了氧化还原反应中的两类典型反应:歧化反应和归中反应。 【练习1】X、Y、Z、W、Q是元素周期表前20号主族元素,原子序数依次增大。X、Z同主族,由X、Y、Z、Q四种元素组成的化合物M的结晶水合物是常见的净水剂,含Y元素的化合物LiYH4是一种金属储氢材料。下列说法正确的是 ( ) A.X所在主族中,X的简单氢化物分子间存在氢键,故其氢化物稳定性最强 B.Z的简单氢化物的酸性弱于W的简单氢化物,故元素非金属性Z小于W C.单质的沸点:W>Z>Y>X 【练习2】某高分子化合物可用于化妆品中,其链节如图所示,其中W、X、Y、Z均为短周期元素且原子序数依次增大,X和Z同主族,下列说法正确的是 ( ) A.W、Y两种元素形成的化合物中只存在极性键 B.W、X、Y三种元素形成的酸性化合物只有一种 C.X、Y、Z的简单氢化物的热稳定性:Y>X>Z D.XW4与ZW4的空间结构不相同 【练习3】“九宫格”是一种深受大众喜爱的数学游戏。若在一格中填充了5种元素,如图所示,X、Y、Z、W、Q为相同短周期元素且最外层电子数依次增加,横行和纵行所含元素最外层电子数之和均为10。下列说法错误的是 ( ) A.若为第二周期元素,X常用作电池电极材料 B.若为第二周期元素,W和Q可形成多种二元化合物 C.若为第三周期元素,单质Z既能与酸也能与碱反应,均有H2产生 D.若为第三周期元素,通常用电解熔融氧化物的方法来冶炼X、Y、Z的单质 【答案】1.D 2.C 3.D




四、新题型预测




