肌腱力学生物学与运动性肌腱损伤病理机制研究进展
杨金娟 陈俊飞 支子 严翊
1 北京体育大学运动人体科学学院(北京100084)
2 河北科技师范学院体育与健康学院(秦皇岛066004)
肌腱是一种独特的结缔组织,是连接肌肉和骨骼的肌肉骨骼系统的组成部分。运动性肌腱损伤包括慢性损伤和急性损伤。慢性肌腱损伤是常见的过度使用性损伤,是一种以疼痛和活动受限为特征的疾病,其发病机制目前尚不清楚,有的认为是退行性疾病[1],有的认为是愈合失败导致的[2]。炎症在肌腱疾病发病机制中的作用仍是一个有争议的话题。早在1976年,研究人员对患有腱鞘炎的患者的病变样本进行检测,未显示病变周围有明显的炎性细胞[3],因此肌腱疾病被认为是没有炎症的退化过程。最近的研究从非撕裂性肌腱疾病的活检标本中检测到炎性细胞的存在,这些研究支持了炎症在慢性肌腱损伤发病机制中的作用,但确切机制仍有待阐明[4-6]。肌腱对异常机械负荷的反应在肌腱损伤中具有重要作用,慢性和急性肌腱损伤往往与力学负荷强度和负荷量有关。
力是使物体变形、运动和∕或改变运动状态的一种机械作用。生物力学是研究生命体变形和运动的学科,通过生物学与力学原理方法的有机结合,认识生命过程的规律,解决生命与健康领域的科学问题。近年来,随着科学技术的进步,生物力学研究逐渐深入到细胞分子层面,生物力学自身也在不断发展。力学生物学逐渐成为生物力学一个新兴学科的前沿领域。力学生物学跨越生物系统的多个尺度:分子、细胞、组织、器官和整个有机体,主要探讨力学刺激对生物体健康、疾病或损伤的影响,研究生物体的力学信号感受和响应机制,阐明机体的力学过程与机体发育、生长、重建、适应性变化和修复等的相互关系,从而促进病理机制的研究和发展有效的治疗策略[7]。
力学生物因素在运动系统的结构功能调控中具有非常重要的作用,一些常见的运动系统疾病,如骨质疏松症、骨关节炎、肌腱疾病、肌肉萎缩症和椎间盘退变等,在一定程度上与这些组织内细胞对异常机械负荷的反应有关[8]。肌腱将载荷从肌肉传递到骨骼,通过细胞通路和高度特化的细胞外基质(extracellular matrix,ECM)之间复杂的相互作用,自适应地改变自身的结构和功能,对不同大小、方向、频率和持续时间的机械负荷作出反应。这种机械适应是通过肌腱内细胞对机械信号的响应以及ECM 的沉积和降解来获得的[9]。此外,机械负荷通过调控ECM 的沉积和降解进而调控干细胞增殖和分化,甚至引起基因组本身的表观遗传修饰[10]。因此,了解肌腱和肌腱内细胞,尤其是肌腱干细胞(tendon stem∕progenitor cells,TPSCs)的力学生物学知识对于进一步理解运动性肌腱损伤的发病机制、肌腱再生修复过程中的病理生理学机制和控制机械负荷的生理益处至关重要。本文分别以中文检索词“肌腱损伤、运动、力学生物学、生物力学、病理机制”和英文检索词“tendoninjury,biomechanics,tendon stem∕progenitor cells,pathogenesis”等为关键词,检索CNKI期刊全文数据库和Pubmed数据库收录的相关文献,同时辅以手工检索和文献追溯的方法,收集发表的有关肌腱力学生物学及病理机制等的文献。
1 肌腱的力学生物学结构基础
与所有生物系统一样,肌腱和韧带的功能和对机械负荷的反应高度依赖于其结构。肌腱高度组织化的结构成分对于其对机械负荷的响应至关重要。肌腱主要由ECM、细胞和水构成。ECM 由平行的胶原纤维组成,胶原纤维可进一步分为原纤维、亚纤维、微纤维和原胶原蛋白[11]。胶原纤维是肌腱的主要结构成分,结构层次复杂,从纳米尺度到宏观尺度的拉伸性能各不相同。胶原蛋白的腱层结构和力学性能被认为是肌腱组织承受机械负荷的结构基础[12]。腱内细胞线性排列在胶原纤维之间,形成一个三维的细胞网络,分布于整个肌腱中。腱细胞(tenocytes)是肌腱的主要细胞成分;肌腱纤维原细胞(tenoblasts)由胚胎时期的间充质干细胞分化而来;虽然肌腱干细胞的确切位置尚不清楚,但它们的存在已得到证实。腱细胞、肌腱纤维原细胞和肌腱干细胞通过调控肌腱结构来维持肌腱的力学性能和防止肌腱损伤的发生。此外,胶原纤维之间还存在各种非胶原蛋白成分,如饰胶蛋白聚糖(decorin)、双糖链蛋白聚糖(biglycan)、纤调蛋白(fibromodulin)、腱糖蛋白(tenascin-C)、弹性蛋白(elastin)和腱调蛋白(tenomodulin,TNMD)等糖蛋白,它们分别在肌腱胶原纤维的组装、肌腱完整性的维持等方面发挥一定作用[13],但对于其在机械负荷转导中的作用仍不清楚。机械刺激是肌腱力学生物学的一个重要参数,更好地了解其对肌腱的影响是深入了解肌腱病理生理的基础。
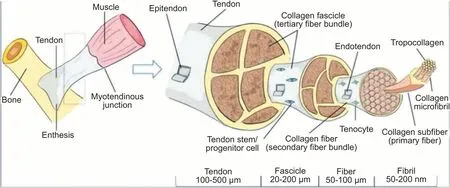
图1 肌腱的腱层结构[12]
2 力学负荷在肌腱组织发育、生长和肌腱稳态中的作用
肌腱是一种机械感觉组织,其力学生物学环境对肌腱的发育、稳态的维持、损伤后修复以及老化等具有重要意义。Gaut 等的研究表明,肢体肌腱的发育涉及干细胞特化,肌腱干细胞分化、成熟和维持,机械信号缺失会阻碍肌腱发育[14,15]。通过动物模型和人体研究发现,机械负荷对成人肌腱稳态的维持也至关重要,肌腱在其特定的生理负荷范围内运行,机械负荷减小或应力剥夺导致肌腱尺寸减小,生物力学性能受损,ECM降解并伴随肌腱标记蛋白表达减少[16,17]。与之相反,生理范围内机械负荷增加会促进肌腱组织内生长因子和炎症介质的表达,进而促进胶原蛋白和ECM 合成[18,19]。同时有研究表明,生理范围内的机械刺激通过激活转化生长因子β(transforming growth factor-β,TGFβ)和Smad2∕3 蛋白介导的TGF-β∕Smad2∕3 通路调节腱调蛋白(tenomodulin,Tnmd)的转录激活因子Scleraxis(Scx)的表达,促进胶原合成,改变ECM 的组成并显著增加肌腱弹性和横截面积[1],使肌腱的机械性能增加,且力学负荷必须达到一定的阈值才能使肌腱发生重塑。然而,当机械刺激因大小、频率、持续时间和∕或方向的不同偏离正常的机械负荷时,肌腱腱膜周围区域蛋白水解酶浓度发生显著变化,导致肌腱内分解反应大于合成反应,引发肌腱的退行性变,进而导致肌腱损伤的发生[20]。研究发现,单次或重复机械负荷对肌腱的过度刺激使肌腱病理标志物如炎症细胞因子,退行性酶如基质金属蛋白酶(matrix metalloproteinases,MMPs)和前列腺素E2(prostaglandin E2,PGE2)等表达增加,胶原纤维损伤[21,22],这一结果与腱病的临床病例中所报道的病理变化如胶原蛋白被破坏,细胞减少,MMPs水平升高,细胞凋亡增多等结果相似[23]。肌腱损伤后的修复过程也需要机械负荷刺激,适度的机械负荷能够促进肌腱的重塑和修复。研究人员通过对大鼠跟腱损伤的动物模型研究发现,机械刺激促进修复与MMPs 激活和抑制以及MMPs 调控胶原基质重建有一定关系,但具体机制尚未阐明[24]。众所周知,老化是肌腱发生退行性变和影响受损肌腱愈合的主要危险因素,老化导致肌腱细胞衰老,胶原蛋白含量减少,肌腱组织的力学性能下降[25]。通过人体研究发现,阻力训练可以增加肌腱的弹性,这可能有助于减轻肌腱损伤的风险[26],机械刺激可以导致肌腱细胞适应性反应和ECM 成分改变,这是由运动产生的局部效应还是系统效应目前尚不清楚。
机体不同部位的正常肌腱组织处于特定的机械环境中,不同肌腱承受负荷的大小取决于它们所附着的肌肉、骨骼和解剖结构的特点,这也决定了肌腱组织的异质性。不同力学环境下,无论机械刺激是小于正常负荷(应力消除或剥夺)还是大于正常负荷(大小、频率、持续时间或方向),不同肌腱的机械刺激响应是不同的;此外,肌腱的力学生物学特征是动态变化的,受年龄、性别、负荷史和解剖位置等的影响。肌腱通过自适应地改变自身结构和功能来响应机械刺激,这种机械适应性是由肌腱内细胞数目的改变以及ECM 重建实现的,具体表现为ECM沉积和纤维排列紧密[27],但肌腱内细胞对机械信号的响应和转导机制尚不清楚。了解细胞对机械刺激的响应对进一步理解肌腱损伤发生的病因及控制运动负荷的生理益处至关重要。
3 肌腱内细胞对机械负荷的生物学响应
肌腱内的细胞包括成熟的肌腱细胞和少数肌腱干细胞,这两种细胞类型都能保证细胞外基质的稳态和修复,以保证其特定的力学性能。机械负荷是维持肌腱组织完整性和稳态最重要的因素之一,也是决定腱细胞和肌腱干细胞功能和命运的关键因素[17]。细胞水平的机械应力是驱动肌腱组织机械调节的中心原则,肌腱内相互作用的细胞和细胞间信号通路受机械刺激的调节[28,29],并在适应肌腱稳态中发挥作用[1]。过去20年来,随着许多体外细胞培养和装载系统的发展,肌腱内细胞对机械刺激的反应及其分子机制成为研究重点。研究认为,细胞是通过细胞骨架、初级纤毛、核变形、拉伸激活离子通道或其他机械敏感通道等传递组织内的机械应力和调节细胞信号与行为的[28,30,31]。
3.1 肌腱纤维原细胞和腱细胞的力学生物学响应
肌腱纤维原细胞作为肌腱内的主导细胞类型,通过改变ECM 的基因和蛋白表达,对肌腱的改变起着重要作用[32]。研究人员设计了一个体外模拟肌腱细胞在体内排列的重复单轴牵拉系统,利用该系统研究发现,机械拉伸可以调节肌腱原纤维细胞的增殖,使Ⅰ型胶原蛋白表达增多[33],同时细胞中MMP1、MMP3、环氧合酶-2(cyclooxygenase-2,COX-2)的表达及PGE2 和白三烯B4(leukotriene B4,LTB4)的生成增多[34];除了机械载荷对肌腱原纤维细胞的直接影响外,机械载荷与细胞因子之间也存在相互作用,这种相互作用的结果与拉伸的大小有关,如,生理条件下的机械负荷(4%循环单轴牵拉)通过增强合成活性(如Ⅰ型胶原的生成)和减少分解代谢活性(如抑制COX-2 和MMP1 的mRNA 表达及PGE2 的生成)来平衡腱细胞的代谢,相比之下,大的机械负荷(8%循环单轴牵拉)通过增加COX-2和PGE2的水平,使代谢平衡向分解代谢方向转变[35]。直接的机械刺激作用于腱细胞可通过TGF-β介导的信号转导对腱细胞分化及形态发生产生影响[36]。已知PGE2 和LTB4 主要存在于炎症或损伤组织中,因此研究认为肌腱或肌腱成纤维细胞对机械负荷的生物学反应可能导致肌腱的病理生理变化。但此类研究尚存在一定的局限性,包括细胞培养模型中缺乏围绕肌腱成纤维细胞的ECM,在体情况下肌腱成纤维细胞对机械牵拉负荷如何反应尚不清楚。
3.2 肌腱干细胞对力学负荷的响应
干细胞被定义为在适当刺激下能够自我更新和分化成不同的特化细胞系的非特化前体细胞。在机体发育和整个生命过程中,干细胞可能会受到各种信号的影响,然而,其调控机制大多仍不清楚。之前的研究主要集中在调控干细胞分化的生物化学因素(可溶性生长因子)上,但干细胞生长的微环境(物理和∕或机械因素)对干细胞的作用长期被忽视。近些年来的一些研究发现,机械信号(拉伸、压缩和剪切应力)既可以单独调控干细胞的增殖和分化[37,38],也可以与其它生物化学因素协同作用调控干细胞的命运[39,40]。肌腱干细胞作为一种成熟的干细胞,自发现以来受到了广泛关注,因其具有自我更新和多谱系分化潜能,成为肌腱修复或再生的一种潜在的细胞治疗策略。与肌腱成纤维细胞一样,肌腱干细胞在体内也受到机械负荷的作用。研究人员借助体内和体外模型研究了肌腱干细胞对各种机械负荷的生物学反应。如通过跑步作用于小鼠肌腱的研究结果显示,机械负荷增加了肌腱干细胞的数量,增加的程度因肌腱类型的不同而有差异,且跑步组肌腱干细胞中胶原蛋白的生成明显高于对照组。因此,该研究认为,机械负荷促进肌腱干细胞增殖和胶原合成进而影响肌腱的合成代谢[41]。为进一步研究机械负荷强度对肌腱干细胞分化的影响,研究人员通过低负荷强度(4%)和高负荷强度(8%)体外牵拉肌腱干细胞,结果显示,肌腱干细胞的分化是机械负荷大小依赖的:当机械牵拉负荷较小(4%)时,肌腱干细胞分化为腱细胞,而在机械负荷较大时,肌腱干细胞还可以分化为脂肪细胞、软骨细胞、骨细胞等非腱系细胞[42]。以小鼠跑步机跑步为实验模型进一步研究发现,在反复剧烈的机械负荷作用下,肌腱产生高水平的PGE2,导致肌腱干细胞增殖能力减弱,诱导肌腱干细胞分化为脂肪细胞和骨细胞[43]。肌腱干细胞的力学生物学研究支持了机械负荷调控肌腱干细胞命运这一观点。
4 运动性肌腱损伤的肌腱力学生物学机制探究
运动性肌腱损伤主要包括慢性肌腱损伤和急性肌腱损伤,在运动员和肌腱重复性劳损的职业人群中较为常见。慢性肌腱损伤是一种常见的软组织损伤,是生理负荷范围内发生的重复性微损伤(退化性损伤,tendinosis),包括由于肌纤维过度使用或反复强烈牵拉而引起肌腱胶原纤维退行性病变肌腱炎(tendinitis),除了累及肌腱本身,还会累及腱鞘导致末端病和滑囊炎。此外,肌腱、韧带和肌肉起止点部位,由于损伤引起局部充血、渗出、水肿,继而由于未能完全吸收,代谢产物在局部滞留,形成粘连、增厚,引发纤维化、骨化乃至钙化等一系列病理变化,也会导致如冈上肌肌腱炎、网球肘、跟腱损伤等末端病,其组织学特征有胶原纤维紊乱、蛋白多糖(proteoglycan)和糖胺多糖(glycosaminoglycan)含量增加,非胶原ECM 增加和新生血管形成[1]。这些细胞和分子的变化改变了肌腱的力学性能,并引发疼痛。由于对其发病机制尚未完全了解,人们提出退行性变和愈合失败等假说。急性肌腱损伤是指肌腱部分或全部断裂,在快速降速、着地或变换方向并伴随中等强度或大强度牵拉负荷的肢体活动中较为常见。此外,在慢性退行性病变的部位,日常负荷强度下也易发生肌腱撕裂或断裂[44]。运动性肌腱损伤是由许多外在和内在因素共同导致的。内在因素包括性别、年龄、Ⅱ型糖尿病和肥胖症等疾病以及遗传等因素;外在因素主要有缺氧、缺血损伤、氧化应激、体温升高、运动和特定的工作特质等[45],其中,重复的异常机械负荷刺激诱导MMPs、生长因子、PGE2 等生物因子的产生,导致ECM重构缺陷,可能会引发肌腱损伤的发生。
随着生物技术的不断进步和力学生物学研究的发展,研究人员提出了肌腱干细胞错误分化是钙化性肌腱病的潜在发病机制的观点[46],试图从肌腱干细胞的力学生物学角度阐述肌腱钙化与机械刺激或过度机械负荷的关系。该观点认为,肌腱损伤是一种细胞介导的愈合失败过程,急性肌腱损伤发生后,正常肌腱愈合过程中肌腱干细胞增殖并分化为腱细胞参与组织修复,然而,当机械负荷改变导致其对正常运动的愈合能力受损或微损伤积累时,肌腱干细胞向成骨细胞和∕或软骨细胞的错误分化(骨—软骨发生),可能是钙化性肌腱病发生软骨发育不全和异位骨化的原因。研究人员分别对正常肌腱组织和病变组织中的肌腱干细胞生物学特性进行研究发现,与健康肌腱组织中分离的肌腱干细胞相比,病变组织中的肌腱干细胞具有更高的成骨分化潜能[47]。Shuji 等[48]在小鼠肌腱病模型的跟腱组织中分离出两个肌腱干细胞的亚群CD105Pos肌腱干细胞和CD105Neg肌腱干细胞,其中CD105Neg肌腱干细胞被认为是导致肌腱软骨样变性的主要原因;过度的机械负荷下肌腱干细胞会异常分化为非腱细胞,如重复的周期性牵拉增加了大鼠肌腱干细胞中BMP-2 的表达,BMP-2 可诱导体外肌腱干细胞的成骨分化;ECM排列的改变也可能导致肌腱干细胞在肌腱病变中错误分化[49]。导致肌腱干细胞错误分化的具体机制目前尚不清楚,当前研究认为,机械因素[50]、可溶性生物活性因子和ECM的弹性[51,52]等都可能导致肌腱干细胞错误分化。
5 结论
对肌腱和肌腱干细胞的力学生物学研究能够更有助于理解肌腱的稳态、肌腱损伤发病机制和损伤愈合机制。肌腱干细胞可能通过在过度的机械负荷下进行非腱系分化,从而导致肌腱稳态的破坏,导致肌腱微损伤积累或发生退行性改变。深入了解干细胞对机械信号的转导机制以及肌腱干细胞与细胞外环境的相互作用,肌腱干细胞信号转导与分化之间的信号网络,有望为肌腱疾病的预防或治疗提供新的治疗方法和康复手段。

