运动对雄性小鼠骨内分泌FGF23—Klotho∕FGFR1轴及相关因子表达的影响
徐帅 李世昌 陈祥和
1 淮阴师范学院体育学院(淮安223300)
2 华东师范大学体育与健康学院(上海200241)
3 扬州大学体育学院(扬州225127)
骨骼具有支持、保护、运动等功能,也是其他激素的靶器官。随着研究深入,骨内分泌系统(bone endocrine system)观念得到认可,将骨骼由被动接受器官转变为主动调节组织,提出骨分泌的调节地位。研究发现,骨骼分泌源激素包括:骨钙素(osteocalcin,OCN)、脂质蛋白2(lipocalin 2,LCN2)和成纤维细胞生长因子23(fibroblast growth factor 23,FGF23)共3 种。FGF23 作为调节磷酸盐和维生素D 的骨源性激素,由成骨细胞和骨细胞分泌,经血液循环转移至肾脏组织。体外研究证实,FGF23 和受体Klotho 结合会降低成骨细胞分化和矿化水平[1],在其受体Klotho的协同作用下与成纤维细胞生长因子受体1(fibroblast growth factor receptor 1,FGFR1)共结合,能够调节磷(phosphorus,P)水平和1,25二羟维生素D3[1,25(OH)2D3]活性,提高肾脏对磷的排泄,维持血磷正常水平[2,3],而骨骼损伤会引起机体产生高钙血症和高磷酸盐血症[4]。FGF23磷化活性主要抑制磷酸盐重吸收,使尿磷酸盐增多并降低血磷水平。FGF23 通过作用于Klotho-FGF 受体(Klotho-FGF Receptor,FGFR),进一步下调肾脏近端小管内钠依赖性磷酸盐转运子2a(Na+-dependent phosphate co-transporter 2a,NPT2a)和钠依赖性磷酸盐转运子2c(Na+-dependent phosphate co-transporter 2c,NPT2c)表达,抑制血磷重吸收。FGF23 在调节1,25(OH)2D3变化水平中的体现在:(1)抑制1α-羟化酶表达,其中1α-羟化酶由Cyp27b1基因编码;(2)诱导24-羟化酶表达,其中24-羟化酶由Cyp24α1 基因编码;1α-羟化酶表达降低和24-羟化酶表达升高引起1,25(OH)2D3水平减弱[5]。1,25(OH)2D3与FGF23构成负反馈调节机制,注射FGF23 会引起1,25(OH)2D3的减弱,而注射1,25(OH)2D3 则会导致FGF23 的增加。
本研究基于整合生物学视角,将骨骼调控水平与肾脏功能进行连接,从运动角度出发,探讨多器官交互作用。本研究通过构建不同运动模型小鼠,讨论运动调节骨分泌源激素变化,为运动促进肾脏分泌功能提供数据支持,为了解运动改善慢性肾脏病的发生发展提供参考。
1 材料与方法
1.1 实验动物
清洁级5 周龄C57BL∕6 雄性生长期小鼠28 只,购自于上海斯莱克实验动物有限责任公司,实验动物许可证号码为SCXX(沪)2012-0002,初始体重为18.19± 0.26 g。适用性饲养1 周后,随机分成对照组(control group,C 组)、跳跃组(jumping group,J 组)、游泳组(swimming group,S 组)和下坡跑组(downhill running group,R组)各7只,自由饮用矿物质水。小鼠在华东师范大学体育与健康学院清洁级动物房(独立顺风系统)饲养,室内保持恒温、恒湿,生活环境昼夜比为1∶1(24 h)。每周运动6 天、共8 周,运动强度在65%~70%VO2max。第1 周进行适应性训练,第1、2天为20 min,第3、4 天为35 min,第5、6 天为50 min,之后则每天进行50 min训练。跳跃组跳跃频率为6~7 次∕min;游泳组游泳装置(长×宽×高100 cm×60 cm×80 cm),水深40 cm,温度保持32℃± 2℃;下坡跑组运动跑台坡度为-9°,跑速为0.8 km∕h(见图1)。实验方案获得华东师范大学动物实验伦理委员会审批,伦理审查编号为:M20171202。

图1 运动装置
1.2 实验动物取材
最后一次训练结束后,24 h内处死,用精密度称重仪称取小鼠体重、右侧股骨湿重和右侧胫腓骨湿重;眼球取血后备用取血清;取肾脏组织。所有操作于冰上进行,于-80℃超低温冰箱存置,待测。
1.3 Western blotting检测
称取40 mg骨组织测FGF23;称取40 mg肾脏组织测Klotho 和FGFR1,待测组织分别进行检测。加入210 μl RIPA 裂解液(含磷酸酶抑制剂),用钢珠进行匀浆研磨;结束后,冰上静敷30 min,再以20 min、12000 g、4℃进行离心,取上清;用BCA 试剂盒测定蛋白浓度;设置0、0.025、0.05、0.1、0.2、0.3、0.4、0.5 mg∕ml的标准品浓度,配置成20 μl 体系,每个体系中加入200 μl BCA 溶液,摇匀后放入37℃恒温干燥箱中,预热30 min;预热后,在5 min 内利用多功能酶标仪在562 nm吸光度下进行OD值的测量,根据浓度差异,分别加入不同含量SDS-PAGE 蛋白上样缓冲液(2X)和PBS。用SDS-PAGE 进行凝胶电泳,采用湿膜法先80 V、再120 V 电泳,100 V 转膜80 min,取膜、丽春红染色、洗膜、封闭2 h、洗膜、孵一抗(小鼠源1∶1000)过夜12 h、洗膜3 次各5 min、孵二抗(抗小鼠1∶1500)2 h、洗膜3次;于暗室ECL显影,用Aipha成像系统扫膜,并用Image Studio软件进行灰度值分析,将目的蛋白与内参进行比较计算。其中FGF23 抗体购于Affinity 公司、Klotho 抗体购于abcam 公司、FGFR1 抗体购于CST公司、内参GAPDH抗体购于abcam公司。
1.4 RT-PCR检测
主要包括4 步:(1)RNA 的提取。取肾脏组织,研磨后移入EP管中,加RNAiso PLUS提取;(2)RNA浓度测定和纯度分析;(3)RNA 反转录。RNA 反转录试剂盒反转录为cDNA,再测定cDNA 浓度;(4)RT-PCR 扩增。ABI StepOne 型实时荧光定量PCR 仪检测相关基因表达量,记录Ct值,根据内参样品值和待测样品值计算基因mRNA 的相对表达量,计算公式为2-△△Ct计算法。所有引物均由上海生工生物工程股份有限公司合成(见表1)。

表1 引物序列表
1.5 无机磷测定
血液4℃过夜,以20 min、4000 g、4℃离心取血清,磷测试盒(带标准)磷钼酸法实验分4 步:(1)取0.1 ml血清加0.4 ml 沉淀剂,混匀后离心10 min 取上清;(2)按照20 μl 待测上清液加200 μl 工作液,并设置标准管和空白管;(3)37℃水浴30 min,冷却至室温,波长660 nm,测定吸光度;(4)磷含量(mmol∕l)=(测定OD值-空白OD值)∕(标准OD值-空白OD值)×标准品浓度(0.5 mmol∕l)×样品处理稀释倍数(5 倍)。无机磷测试盒购于南京建成生物工程研究所。
1.6 酶联免疫分析
血液4℃过夜,以20 min、4000 g、4℃离心取上清,设置标准品孔和样品孔,各50 μl(待测样品10 μl 和稀释液40 μl),加入酶标试剂100 μl,37℃温育60 min,去液,洗涤5 次,30 s∕次,加入显色剂,37℃避光15 min,加终止液,450 nm 波长依次测量各孔OD 值。其中1,25(OH)2D3购于上海酶联生物。
1.7 统计学方法
本研究实验数据,均采用平均数±标准差(±s)表示,利用Excel 和SPSS19.0 对实验数据进行统计分析,组间采用单因素方差分析。其中P<0.05 表示差异具有统计学意义。
2 结果
2.1 运动对小鼠体重、单侧股骨湿重和胫腓骨湿重的影响
由表2可见,游泳组体重低于对照组和下坡跑组(P<0.05);跳跃组和下坡跑组单侧股骨湿重高于对照组(P<0.05);跳跃组和下坡跑组单侧股骨湿重高于游泳组(P<0.01);各组间单侧胫腓骨湿重无显著变化。统一单位后,计算其骨湿重与体重变化,跳跃组和下坡跑组股骨湿重∕体重水平高于对照组(P<0.01);胫腓骨湿重∕体重水平无显著差异。
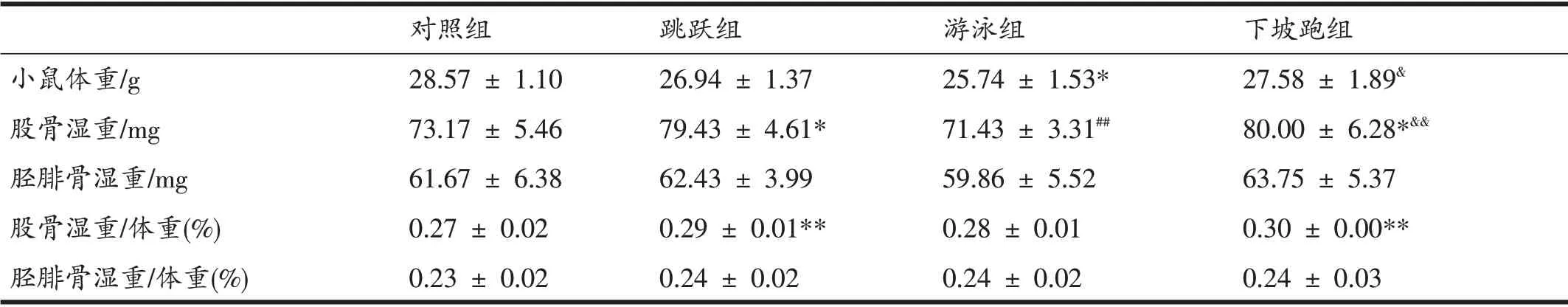
表2 运动对小鼠体重、股骨和胫腓骨湿重的影响(n=7)
2.2 运动对骨中FGF23、肾脏中Klotho和FGFR1蛋白表达的影响
由图2可见,跳跃组、游泳组和下坡跑组骨组织FGF23 蛋白相对表达量高于对照组(P<0.05 或P<0.01)。各组肾脏Klotho蛋白相对表达量没有显著性差异。下坡跑组肾脏FGFR1蛋白相对表达量高于对照组(P<0.05)。

图2 运动对相关蛋白表达的影响
2.3 运动对肾脏中NPT2a、NPT2c、Cyp24α1 和Cyp27b1 mRNA表达的影响
由图3可见,下坡跑组NPT2a mRNA 表达水平低于对照组(P<0.05);各组肾脏NPT2c mRNA 表达水平无显著差异;跳跃组和下坡跑组Cyp24α1 mRNA 表达水平高于对照组(P<0.01),下坡跑组Cyp24α1 mRNA表达水平高于游泳组(P<0.01);下坡跑组Cyp27b1 mRNA表达水平低于对照组(P<0.05)。

图3 运动对NPT2a、NPT2c、Cyp24α1 和Cyp27b1 mRNA表达的影响
2.4 运动对血磷和1,25(OH)2D3的影响
由图4可见,游泳组和下坡跑组血磷水平低于对照组(P<0.01);跳跃组、游泳组和下坡跑组血清1,25(OH)2D3含量低于对照组(P<0.05或P<0.01)。

图4 运动对血清指标的影响
3 分析与讨论
3.1 运动对小鼠体重和骨湿重的影响
规律性运动能够有效减少脂肪含量,减轻体重,提高肌肉和骨骼质量[6]。本研究采用的运动方式,能更为有效地提高骨骼质量。研究发现,经过8 周的运动干预,运动组体重均低于对照组,但是在股骨湿重变化上,跳跃组和下坡跑组明显高于对照组,胫腓骨湿重之间则不存在显著性差异。在股骨湿重∕体重、胫腓骨湿重∕体重的变化上,运动后,运动组骨骼比重远高于对照组,也符合上述骨骼质量变化。整体而言,下坡跑组变化最为显著,说明8 周的直接应力刺激可显著提高小鼠股骨湿重,而游泳所产生的间接应力反而没有对股骨湿重起到直接刺激作用。在应力刺激中有研究指出,50%的负荷跑台训练,可有效提高老龄Wistar 大鼠的股骨湿重,低于(30%)或者超过(70%)该强度都不会显著提高骨骼质量[7],过大强度的应力刺激甚至会导致骨微环境损伤。本研究认为,下坡跑运动与负重训练具有异曲同工之妙,且下坡跑运动的可操作性更强,尤其是对于刺激骨骼发生发展具有直接反馈性作用。
3.2 运动对FGF23、Klotho和FGFR1蛋白表达的影响
骨骼成分主要为钙磷化合物,当机体内出现钙磷紊乱现象,一方面,骨骼通过自身的骨转换改善钙磷平衡;另一方面,通过骨骼内分泌因子与肾脏成纤维生长因子受体(fibroblast growth factor receptors,FGFRs)结合,调节磷吸收水平。但是FGFRs 与FGF23 的结合水平低,需要Klotho 先与FGFRs 结合,形成Klotho∕FGFR1 复合物,再与FGF23 结合发挥作用。FGF23 作为骨分泌性“调磷因子”,其分子量仅为23 KD,能够迅速穿过骨陷窝—骨小管网络系统,进入毛细血管,最终直接到达远端器官和细胞;在骨骼内分泌过程中,FGF23低表达或高表达均会引起骨骼代谢紊乱[8]。在肾脏中,FGF23抑制近曲小管对磷的重吸收和维生素D的再合成,从病理生理学角度,缺乏FGF23或Klotho的小鼠表现出:尿磷排泄受损引起磷酸盐潴留;1,25(OH)2D3的合成增多和降解减慢导致的维生素D 中毒[5]。在肾病综合征患者中,骨骼FGF23 分泌水平减少会导致较低的维生素D水平以及尿失禁等症状[1]。本研究发现,运动能够有效提高骨骼FGF23 分泌,尤其以下坡跑运动最为突出,长期运动会提高骨骼FGF23 合成以及血液循环中FGF23水平。研究还发现,在急性、力竭性和长期耐力运动下,均会提高血清FGF23 水平,考虑到FGF23 mRNA还可在肝脏、心脏、骨骼肌等多种器官中表达[9],而且长期规律运动会提高骨骼质量和分泌能力。由此可认为,短时间运动干预,虽然会显著改善血液FGF23水平,但并不涉及到骨骼分泌程度的改变,只有在长期效果下,运动才会明显改善骨骼内环境,提高FGF23循环水平,整体性改变血清FGF23水平。
FGF23 生物活性需要介质Klotho,其中FGF23 和Klotho共缺陷小鼠由于维生素D中毒出现衰老表征,当FGF23或Klotho缺陷时,小鼠会出现肾近曲小管1α-羟化酶过表达,导致维生素D[1,25(OH)2D3]高度生成;而FGF23 和Klotho 缺陷小鼠,1,25(OH)2D3 循环水平极度升高,引起高血钙症和高磷酸盐血症[4]。本研究发现,在Klotho调节中,不同运动方式对于其蛋白表达并没有显著性改善。分析认为,一方面,受体本身的调节并不是影响下游因子变化的主要问题;另一方面,高FGF23 水平对Klotho 调节还存在一定的抑制作用,其中高磷、低维生素D 和高FGF23 表达,会负性调节Klotho 表达,并积极诱导骨骼中FGF23 合成[10]。Klotho是作为一种抗衰老基因[10],Klotho主要以膜型和分泌型2 种蛋白形式存在,其中膜型Klotho 会与FGF23 共结合,而分泌型Klotho(sKlotho)独立于FGF23,在血液、尿液和脑脊液中可检测到分泌型Klotho 蛋白。由于Klotho 具有延长寿命的效果,Klotho 缺失会引起早衰,而运动会改变基因表达。研究发现,急性有氧运动会显著增加血液Klotho循环水平;同样的,在久坐不动的年轻或老年女性中,急性有氧运动同样会改变血液Klotho 循环水平;且长期有氧运动也会提高Klotho 循环。这些研究表明,Klotho 上调与运动存在必然联系[11],也从侧面证实了运动延缓衰老。
FGFR1 可在肾小管、脉络丛、睾丸、窦房结以及骨组织等少数几个组织中表达,FGFR1-∕-小鼠出现FGF23高表达、肠刷状缘膜囊泡(brush-border membrane vesicle,BBMV)磷酸盐转运水平增加,并提高NPT2c蛋白表达[12]。在FGFR1 运动干预中,运动会提高Klotho 与FGFR1结合率,通过8周运动干预,发现运动会提高肾脏中FGFR1 表达水平,尤其以下坡跑运动效果最佳。本研究认为,运动会改善机体内FGFR1合成水平,对于维持机体血磷稳态等具有良好的调控。Krajisnik 等[13]发现,在长期慢性肾脏病(CKD)中,肾脏FGFR1表达下降,观察到甲状旁腺Klotho 和FGFR1 表达量随着肾功能下降而下降,这与肾功能衰竭相关的矿物质代谢改变有关,也可以解释在晚期CKD 中观察到FGF23 的甲状旁腺抵抗现象,最终出现血清FGF23 升高的异常情况。在成年小鼠中利用单克隆FGFR1 抗体(R1MAb)激活FGFR1表达,会显著提高FGF23水平,同时出现低磷症状;在培养大鼠颅盖骨成骨细胞中,R1MAb 诱导FGF23 mRNA 表达和FGF23 蛋白表达;在培养肾上皮细胞系中,R1MAb 则充当功能性FGF23 模拟物并激活FGF23生成[14]。
3.3 运动对肾脏中NPT2a、NPT2c、Cyp24α1 和Cyp27b1 mRNA表达的影响
NPT2a 和NPT2c 突变与家族性低磷血症患者的肾实质结石(肾结石)和肾实质矿物质沉积(肾钙质沉着症)相关。在全基因组关联研究中,NPT2a与肾结石和肾功能改变有关。当这两种基因突变,表现出1,25(OH)2D高循环水平,以及吸收性高钙尿症。口服磷酸盐补充剂通过降低1,25(OH)2D和吸收性高钙尿症的循环水平,减少NPT2a 和NPT2c 突变携带者的肾矿化风 险[15]。NPT2a-∕-NPT2c-∕-小鼠和单独敲除NPT2a 或NPT2c 小鼠相比,双敲除小鼠的骨骼异常现象更为明显,表明两分子在磷酸盐稳态中具有类似的非冗余作用,基因敲除小鼠的体内血磷含量,80%由NPT2a 调节,20%由NPT2c 调节,研究指出NPT2a 和NPT2c 是由饮食、血磷和三类激素(PTH、1,25(OH)2D3和FGF23)共同调节[16,17]。在小鼠体内,NPT2a在肾脏磷吸收中占到70%~80%,而NPT2c 主要在断奶的动物中起到重要调节作用。成年动物体内,NPT2c 对肾脏磷吸收作用较弱,在人体内,NPT2c对肾脏磷吸收和骨骼矿化具有重要作用[16]。耐力运动会改善生长期慢性肾病大鼠骨骼质量[18],在长期慢性肾脏病中,定期有规律运动训练会改善肾脏功能[19]。同时,Johansen[20]研究指出,肾脏患者中经常采用有氧运动或者抗阻运动方式,会更好地改善肾脏功能。NPT2a和NPT2c能够抑制肾脏磷的重吸收水平。本研究发现,运动组中NPT2a 和NPT2c mRNA 水平均有所下降,其中下坡跑组NPT2a mRNA表达水平显著下降。
Cyp24α1 在维生素D3 的代谢中起着核心作用,1,25(OH)2D3 在Cyp24α1 依赖性代谢中存在物种差异性,人类Cyp24α1 表现出由C-23 和C-24 羟基化途径,鼠系Cyp24α1 表现出C-24 相对C-23 途径的优势性。此外,维生素D 类似物也存在Cyp24α1 依赖性代谢的种属差异[21]。在哺乳动物细胞和大肠杆菌细胞中表达的Cyp27b1 突变体均未显示对1,25(OH)2D3 活性影响。另外Sawada等[22]指出,Cyp27b1突变位的氨基酸残基与Cyp24α1相同,Cyp24α1缺陷导致脑黄疸性黄瘤病(CTX),这是一种常染色体隐性脂质贮积病。在中医研究中,衰老大鼠肾上腺皮质Cyp27b1 表达下降,Cyp24α1 表达上升;在淫羊藿苷对衰老大鼠肾上腺皮质中Cyp24α1和Cyp27b1的药物干预下,淫羊藿苷不同剂量组大鼠肾上腺皮质Cyp27b1表达上升,Cyp24α1则相对下降[23],表明衰老大鼠出现维生素D 失衡,反而需要提高1,25(OH)2D3 水平。通过对生长期小鼠的运动干预,本研究发现,跳跃组和下坡跑组Cyp24α1 mRNA 表达水平极显著高于对照组,下坡跑组Cyp27b1 mRNA 表达水平低于对照组。说明24-羟化酶表达水平升高,1α-羟化酶表达水平降低,共同减弱1,25(OH)2D3水平。
3.4 运动对血磷和1,25(OH)2D3的影响
骨矿物盐中的羟基磷灰石主要由钙和磷构成,由于骨重建是一个持续动态过程,磷可通过骨释放入血,引起血磷水平变化,对于肾脏功能不全的患者,会导致磷含量过高,其中高磷血症是CKD 最常见的并发症之一。而运动可有效改善血磷水平,在为期50周的耐力运动中,当摄入钙磷比为2∶1 时,运动可有效提高股骨湿重和股骨钙含量[24]。本研究在不改变饲养配料的基础上,发现长期运动干预会有效缓解血磷水平,尤其是在游泳运动和下坡跑运动中,血磷水平具有极显著性差异,显著低于对照组血磷水平。其中血磷浓度降低,与运动存在必然联系,随着骨骼质量提高,以及骨内分泌系统中FGF23 分泌增加,钙磷结构逐渐发生变化。而对于去卵巢的SD大鼠,不同强度运动下血磷没有显著性改变[25]。
维生素D3 的活性形式1,25(OH)2D3 在钙和磷稳态、免疫反应和细胞分化中起着重要作用,超过1000种维生素D 类似物用于I 型佝偻病、骨质疏松症、肾性骨营养不良、白血病和乳腺癌等[21]。本研究发现,伴随着血磷下降的还有血清1,25(OH)2D3 的含量下降。对老年人的高维生素D 摄入和运动干预下,Scott 等[26]也认为,受试者身体机能的提高主要是由于运动引起的效果。在健康男性中,维生素D 通过肝脏(25-羟化酶)形成25(OH)2D3 后,经过肾脏(1-羟化酶)转化为1,25(OH)2D3,其中1,25(OH)2D3 对于血钙稳态、骨代谢平衡和神经肌肉稳态具有重要作用,还具有抗恶性细胞增生、促进分化和免疫调节[27]。
4 结论
与跳跃运动和游泳运动相比,下坡跑运动能够显著提高生长期雄性小鼠的骨骼质量,增加股骨湿重,引起FGF23 表达水平升高,并通过FGF23--Klotho∕FGFR1 轴调节肾脏功能,降低NPT2a 和NPT2c 表达,降低血磷水平;提高Cyp24α1表达,降低Cyp27b1表达,降低1,25(OH)2D3水平。

