基于形态学及生理学的黄檗性别差异研究
张 玲 张东来
(1.黑龙江省林业科学研究所,哈尔滨 150081; 2.黑龙江省林业科学院,哈尔滨 150081)
植物界中雌雄异株植物约占6%,在被子植物中占959个属,是陆地生态系统的重要组成部分,在维持生态系统结构、功能和稳定性方面发挥着至关重要的作用[1~4]。雌雄异株植物具有性别特化和对资源需求不同等特点,因此在植株形态、生理、生化上存在不同程度的差异[5]。林业生产中,尤其在种子园营建及杂交育种等方面,常常根据经营目的与利用方向选择特定性别的植株,因此,研究雌雄株的特性及差异尤为重要[6]。
植物内源激素与抗氧化防御酶均是与性别表达相关的生理指标,其各具作用和特点,二者在合成和分泌上相互影响,共同调控机体的抗性[7]。植物激素参与调控植物生长发育的每一个过程,包括植物自身的生长和发展和形态建成[8]。很多学者研究雌雄株内源激素含量变化后,认为实生树内源激素含量存在一定的性别差异[9~10]。植物通过防御酶活性、内源激素的变化来调节某些生理过程,以达到适应不同环境条件的目的[11]。
黄檗(PhellodendronamurenseRupr.),雌雄异株植物,为我国特有种,是东北三大珍贵硬阔叶用材树种之一。同时也是我国名贵中药关黄柏的药源植物。由于其具有药用和木材双重经济价值而被大量砍伐,导致资源量锐减,现已被列为国家一级珍贵树种、国家2级保护树种和易危物种[12]。开展黄檗雌雄植株的形态及生理生化差异研究,可以揭示雌雄植株个体生长和生理特性,为探究雌雄植株对不同环境的适应机制以及该物种濒危机制、制定及时有效的保护措施提供科学参考。
1 材料与方法
1.1 材料与处理
以哈尔滨市香坊区劳动公园黄檗成树为研究对象,树龄平均为46年,郁闭度为0.7左右,林内伴生种为白桦(BetlaplatyphyllaSuk.)、水曲柳(FraxinusmandshuricaRupr.)、山杨(PopulusdavidianaDode)、春榆(Ulmusjaponica(Rehd.)Sarg.)等,灌木为紫丁香(Syringaoblata)、金银忍冬(Loniceramaackii(Rupr.)Maxim.)等。选取同龄、长势相当的黄檗雌雄株各6株(通过开花、结实确定性别),在每株样树树冠的上、中、下3个层次的东、南、西、北4个方向采摘顶尖第3对叶片,将同株样树上所采摘的叶片充分混合装入袋内,迅速放入冰盒,带回实验室放入冰箱中,冷藏,待测。抗氧化防护酶活性分别在6~9月中旬,其它指标测定时间为8月。
1.1.1 形态学测定
将采摘的雌雄叶片分别按同位、同龄叶片进行编号。用便携式叶面积仪测量叶长、叶宽等指标。每个层次、每个方向各3次重复,所有数据以平均的标准差Mean±SD表示。
1.1.2 叶绿素含量的测定
根据赵世杰的方法进行测定[13],提取液为80%的丙酮。
1.1.3 内源激素含量测定
使用LC-20A高效液相色谱法测定[14]。
1.1.4 抗氧化酶活性的测定
MDA含量采用硫代巴比妥酸法测定;SOD活性采用氮蓝四唑(NBT)光化还原法测定;POD活性采用愈创木酚法测定;CAT活性采用过氧化氢法测定[14]。
1.2 数据处理与分析
采用Excel和SPSS19.0进行数据统计与处理,雌雄株间差异的显著性用配对样本(Paired-samples T test)检验,origin9.0作图。
2 结果与分析
2.1 黄檗雌雄植株形态学差异
分别对黄檗雌雄株的叶长、叶宽、叶柄长度及枝间夹角等形态特征进行统计,结果表明,同一性别、同类枝条上的叶片其叶长、叶宽、叶柄长度及枝间夹角等形态特征参数具有良好的稳定性。从表1中可以看出,相同树龄、相同环境条件下黄檗雌雄植株形态上存在显著差异,雌株叶长大于雄株,但差异不显著;雌雄植株叶宽差异显著(P<0.05),雌株叶片较雄株叶片宽1.66±0.148 cm;雌雄植株枝间夹角差异极显著(P<0.001),相同条件雌株枝间夹角大于雄株17.5±1.21°,黄檗雌株枝干平状伞形开叉,雄株为尖顶伞状,黄檗雌雄植株叶片长、叶柄长度差异不显著(表1)。由于黄檗成树叶形及枝间夹角发育成熟后具有稳定性,因此叶宽及枝间夹角差异可以作为黄檗性别鉴定的重要依据。
2.2 黄檗雌雄株叶绿素含量差异
叶绿素作为反映植物叶片光合性能、衰老程度和营养状况的重要因素,其含量变化是植物敏感的生理指标之一。雌雄植株叶片颜色有一定差异,雌株叶片颜色为浅绿色,雄株叶片深绿色。黄檗雄株总叶绿素含量平均值为16.09±1.32 mg·L-1,雌株平均值为21.69±8.34 mg·L-1。雄株叶绿素a含量为10.08±0.58 mg·L-1,雌株为14.24±5.02 mg·L-1;雄株叶绿b含量为6.02±0.83 mg·L-1,雌株为7.46±3.35 mg·L-1。黄檗雌雄植株叶片叶绿总量、叶绿素a、叶绿素b含量差异均不显著(图1),说明黄檗雌雄植株叶绿素的合成与降解效率基本一致。
表1 黄檗雌雄株形态特征
Table 1 Morphological characteristics ofP.amurensein male and female
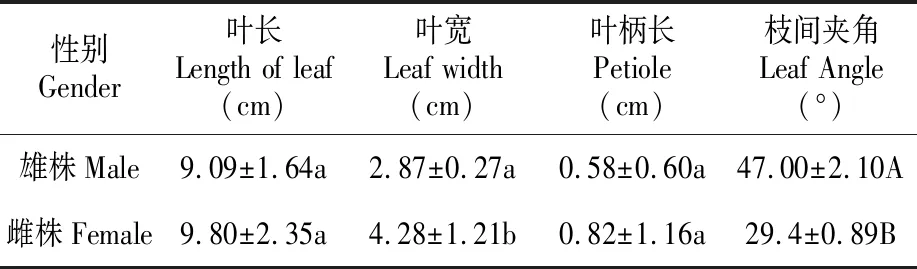
性别Gender叶长Length of leaf(cm)叶宽Leaf width(cm)叶柄长Petiole(cm)枝间夹角Leaf Angle(°)雄株Male9.09±1.64a2.87±0.27a0.58±0.60a47.00±2.10A雌株Female9.80±2.35a4.28±1.21b0.82±1.16a29.4±0.89B
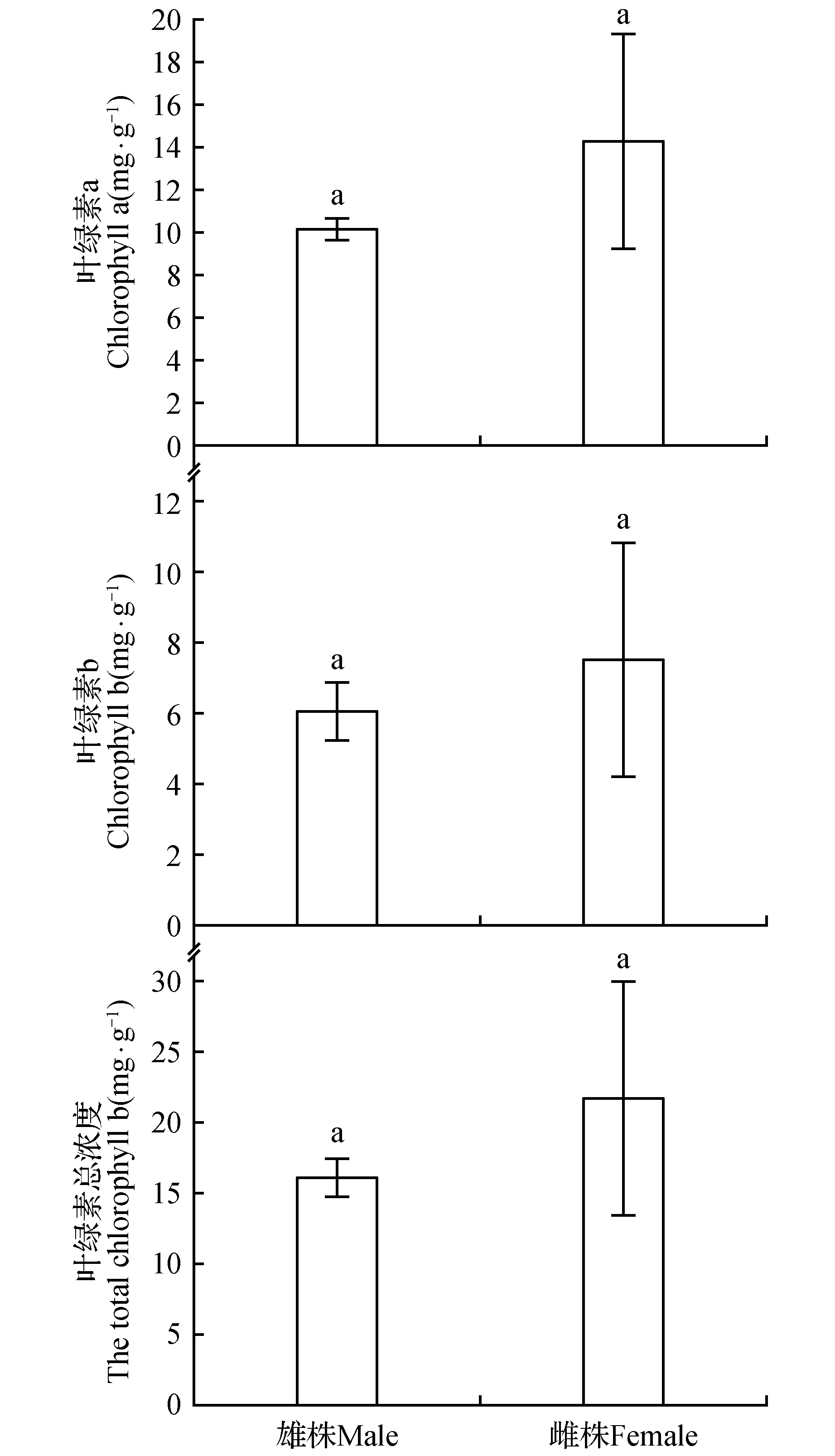
图1 黄檗雌雄植株叶绿素含量差异Fig.1 The difference chlorophyll content in female and male plants of P.amurense
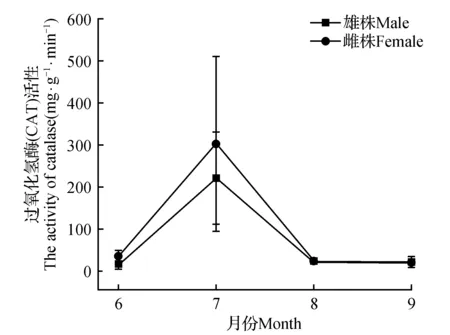
图2 黄檗雌雄株过氧化氢酶活性差异Fig.2 The difference CAT activity in female and male plants of P.amurense
2.3 黄檗雌雄植株叶片抗氧化防御酶活性
2.3.1 黄檗雌雄植株过氧化氢(CAT)酶活性季节动态
从图2可以看出,黄檗雌雄植株叶片CAT酶活性在6~9月4个月间出现单峰状态,在7月最高,雌雄植株差异极显著(P<0.001),在6~7月均表现雌株CAT含量大于雄株。8月到9月黄檗雌雄植株CAT含量差异不显著,说明黄檗在6~8月生长旺盛期,雌株比雄株机体过氧化氢酶活性和抗氧化防御能力要强。
2.3.2 黄檗雌雄植株过氧化物酶(POD)酶活性季节动态
POD是活性较强的适应性酶,能够反映植物体内代谢状况和对外界环境变化的适应性。黄檗雌雄植株叶片POD酶活性差异不显著,但同一性别季节间差异显著(P<0.05)。雌雄植株POD酶活性总体表现为升降升趋势,6月最高,7~8月黄檗POD酶活性趋于稳定,9月逐渐开始升高,均表现为雄株大于雌株(图3)。

图3 黄檗雌雄株过氧化物酶(POD)活性差异Fig.3 The difference POD activity in female and male plants of P.amurense
2.3.3 黄檗雌雄植株超氧化物歧化酶(SOD)活性季节动态
黄檗雌雄植株超氧化物歧化酶活性差异不显著,同一性别季节间差异显著(P<0.05)。雌雄植株季节动态有一定差异,雄株表现为6~9月逐渐升高,9月SOD酶活性雄株均值为510.16±319.27 U·g-1·min-1,雌株为294.22±248.80 U·g-1·min-1;雌株SOD酶活性表现为先升高后下降再升高,8月呈下降趋势,SOD酶活性均为雄株大于雌株(图4),说明相同环境条件黄檗雄株抗性要比雌性强。
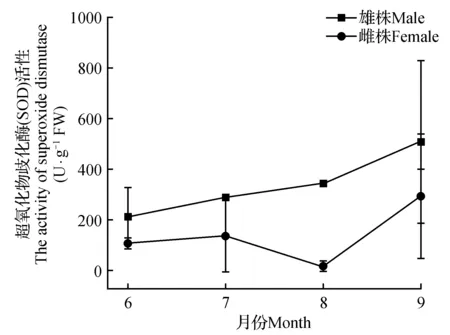
图4 黄檗雌雄株超氧化物歧化酶(SOD)活性差异Fig.4 The difference SOD activity in female and male plants of P.amurense
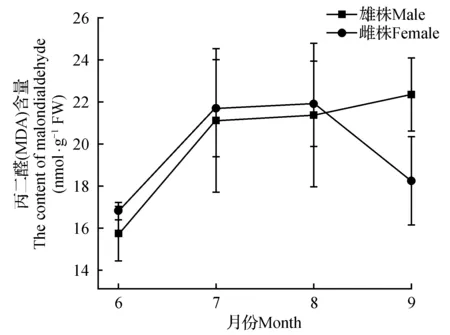
图5 黄檗雌雄植株丙二醛含量差异Fig.5 The difference MDA in female and male plants of P.amurense
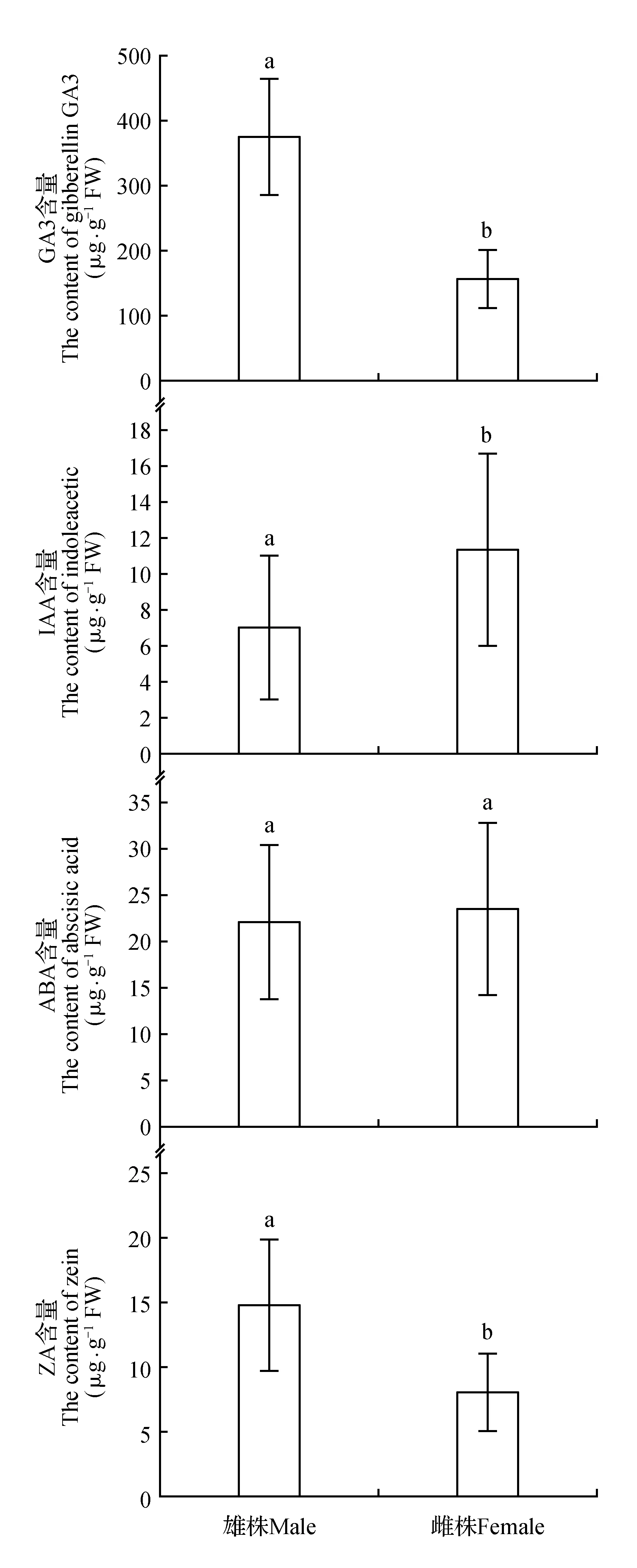
图6 黄檗雌雄株内源激素含量差异Fig.6 Difference endogenous hormone contents in female and male plants of P.amurense
2.3.4 黄檗雌雄植株丙二醛(MDA)含量季节动态
通过连续4个月黄檗雌雄株叶片MDA活性测定,发现雌雄株的MDA酶活性在6~8月间表现为逐渐升高的趋势,雌株MDA酶活性略高于雄株,但在9月,表现出较大的差异,雄株MDA持续升高,雌株MDA含量迅速下降且远低于雄株(图5),这一现象有待于进一步研究验证。
2.4 黄檗雌雄植株内源激素含量差异
植物性别分化的影响也可能是通过调节植物内源激素的生物合成途径来实现的,因为植物的生长发育、基因表达均受体内激素水平的制约。在同一时间采样的46年生黄檗雌雄株内源激素进行对比分析,内源激素ABA含量为雌株大于雄株,但性别间差异不显著;GA3和ZA含量均表现为雄株大于雌株且差异显著(P<0.05);IAA含量表现为雌株大于雄株,呈现显著差异(P<0.05)(图6)。
3 讨论
雌雄株之间这种不同的进化方向决定了其不同的生长模式。沙棘雌雄植株不仅在冬态、形态、植株分布等存在显著差异[15]。水曲柳雌雄株在株高、胸径、枝间角等明显差异[6,16]。栝楼雌株在叶柄、卷须、叶片和茎尖等组织器官显著高于雄株[17]。成年银杏雌雄植株短枝、长枝叶片叶长、叶宽、叶基夹角、叶面积和叶形指数都分别显著小于雄株对应枝条上相应叶片形态特征,而叶柄显著大于雄株叶柄[18~19]。葎草的茎、叶、花穗性状表现出显著的性别差异[20]。木兰雌雄株叶、花、茎外部形态存在显著差异[21]。本研究黄檗雌雄植株雌株叶长、叶宽及叶柄长度均表现为雌株大于雄株,反映出雌株为了满足繁殖成本,快速积累能量的需要而在叶片生长方面出现的功能适应模式。
激素通过与细胞膜或细胞内受体相结合而引起一系列生物学效应,以此来调节酶的活性,进而影响植物生长发育。赤霉素GA3有利于雄性性别的表达,而细胞分裂素和吲哚乙酸(IAA)更有利于雌性性别的表达,但这种激素对性别表达的作用并不是对所有的雌雄异株植物都适用。王白坡等测定了银杏雌雄株实生树内源激素在生长季节的变化,结果表明雌雄株间内源激素在含量水平上有一定差异,雌株的GA3和ZA含量高于雄,IBA和ABA则低于雄株[9]。华中五味子从营养期到花期ABA含均为雌株大于雄株,IAA、GA3、ZR含量为雄株大于雌株[25]。内源激素GA3雄株大于雌株银杏雌、雄株实生树内源激素在生长季节的变化研究发现,雌株叶片中玉米素(ZT)的含量较雄株高,吲哚乙酸(IAA)和脱落酸(ABA)则相反,雄株较雌株高。本研究内源激素IAA为雌株大于雄株,玉米素ZA为雄株大于雌株,原因可能是物种间生物学特性的差异导致不同的结果。

