麦粒灸对双转基因AD 小鼠GFAP 与Aβ1-42斑块共定位的影响
樊振宇,包烨华,张永生,楚佳梅
(1.浙江医院,杭州 310016;2.杭州市中医院,杭州 310007;3.浙江中医药大学,杭州 310053)
阿尔茨海默病(Alzheimer’s disease, AD),是一种以认知记忆障碍为特征的进行性中枢神经系统退行性疾病。其主要病理特征为细胞外β-淀粉样蛋白(β-amyloid protein, Aβ)沉积形成的老年斑(senile plaque, SP)、Tau 蛋白异常聚集形成的神经元纤维缠结、突触减少和神经元丢失以及脑萎缩[1]。老年斑主要是由 Aβ沉积形成,细胞内神经元纤维缠结主要是微管相关蛋白 tau 的过度磷酸化导致[2]。多数学者认为Aβ沉积形成的老年斑是AD 病理发展的核心机制[3]。可溶性 Aβ过度表达,其生成和清除失衡,从而加剧神经原纤维的缠结、炎性反应和细胞死亡,是导致AD 的直接因素[4]。星形胶质细胞是中枢神经系统内胶质细胞的重要组成部分,通过与脑内其他细胞接触和连接,具有营养和支持神经元、调节神经递质释放、离子缓冲、信号转导、能量代谢、血流控制等功能[5-6]。Aβ沉积亦会激活星形胶质细胞,在神经胶质细胞中,星形胶质细胞数目最多,散布最广,担负着神经胶质细胞的大部分功能,激活的星形胶质细胞对神经系统既有保护作用又有毒性作用。且激活的星形胶质细胞可以释放多种炎症因子来调节AD 的病情发展。许多报道称在AD 脑组织的 Aβ沉积周围含有的星形胶质细胞数量极多,神经胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)是星形胶质细胞内的中间丝蛋白,是其特异性标记物。保护星形胶质细胞的正常功能,使其发挥对神经系统的保护作用,将成为AD 治疗的新方向。
迄今为止,治疗AD 并没有特效药物和良好的治疗方法。因此,应该在还未发病或发病早期对AD 进行干预,阻止或延缓 Aβ异常沉积产生神经毒性作用所激发的一系列AD 病理过程。随着科学的发展,医学发展也开始着重于以疾病预防为主,符合中医学“治未病”思想。艾灸作为我国传统治疗方法,近年来在防治阿尔茨海默病方面体现出了较好的疗效,实验研究表明,艾灸不仅具有远红外线辐射的功能,而且具有近红外线辐射的功能,一般远红外线能直接作用于人体较为浅表的部位,而近红外线能渗入人体较为深层的组织,且能通过毛细血管网将热能传递到更广泛更深层的部位,从而进一步调整人体的免疫功能。麦粒灸属于艾灸疗法中的一种,具有患者易于接受、热力深透、操作方便、疗效显著的特点。用麦粒灸疗法时,艾炷与小鼠皮肤接触更为紧密,艾灸刺激的强度、渗透度比其他艾灸疗法更为显著,麦粒灸作为本研究的特色治疗方法,其治疗效果更出色。目前大多数的针灸临床研究偏向于对AD的后期治疗,在后期治疗效果不理想的情况下,早期对该病的防治显得极为重要。本实验的目标在于通过观察AD 小鼠脑内Aβ沉积与GFAP 的病理学改变来研究麦粒灸治疗AD 的作用及机制,从而为临床麦粒灸法治疗AD 提供理论依据,为进一步研究AD 发病机制奠定基础。
1 材料与方法
1.1 模型制备
由中科院上海生命科学院生化所景乃禾研究员惠赠饲养于动物实验研究中心。B6SJL-Tg(APPSwFlLon,PSEN1*M146L*L286V)6799Vas/J 品系双转基因AD 小鼠杂合体种鼠4 只,配种鼠由中科院上海实验动物中心/上海斯莱克实验动物有限公司提供[SCXK(沪)2007-0005],已经由所在SPF 级实验动物中心繁殖并形成建立了规范的饲养条件,由 SPF 级转基因实验动物中心提供饲养条件,繁衍所产生后代。出生的子鼠在 3~4周后剪尾鉴定。本研究中动物实验严格遵循保护原则、动物福利原则、伦理原则和综合性科学评估原则。
1.2 主要试剂与仪器
琼脂糖凝胶和溴乙锭(上海生工生物工程有限公司提供)、10%水合氯醛(02030,上海化学试剂有限公司)、PBS 磷酸盐缓冲液(ZLI-9062,北京中杉金桥生物技术有限公司)、驴血清封闭液(sigma 分装)抗荧光淬灭封闭液(P0128,碧云天生物技术研究所)、Anti-beta Amyloid 1-42 antibody(Ab10148,abcam 公司)、Anti-GFAP antibody(Ab53554,abcam 公司)、AF488 Donkey Anti-Rabbit IgG(H+L)(DW-DAR4881, abcam公司)、Cy3 Conjugated Donkey Anti-Goat IgG (H+L)(DW-A0502, abcam 公司)、PTC-200 PCR 扩增仪(Biorad 公司)、EPS 601 水平电泳仪(GE 公司)、台式冷冻离心机(Thermo 公司)、倒置荧光显微镜 IX71(Olympus 公司)、冰冻切片机(Thermo Fisher 公司)。
1.3 PCR 法鉴定APP/PS1 转基因小鼠基因表型
1.3.1 提取基因组DNA
所生子代小鼠 3~4 周龄时,剪取小鼠鼠尾约0.5 cm 放入1.5 mL 离心管内,每管中加入0.5 mL 裂解液,以 12000 r/min、56℃转动 2 h 以上或过夜,离心 20 min,取上清,加入等体积异丙醇混匀,放置30 min,12000 r/min 离心 10 min,沉淀 DNA。琼脂糖凝胶电泳检测DNA 片段,制备2%琼脂糖凝胶加溴化乙锭 5 μL,加入扩增后 DNA10 μL,120 V、30 min 电泳,观察PCR 产物长度。
1.3.2 引物设计
以Primer5.0 软件设计小鼠Tg(APP)、Tg(PS1)序列引物,如表1。

表1 小鼠Tg(APP)、Tg(PS1)序列引物
1.3.3 PCR 扩增
按照Takara 公司产品说明书,根据定量体系摸索的实验研究条件,确定最佳反应体系,以目的DNA 为模板进行 PCR 扩增反应,采用相同的数据记录标准进行数据记录。具体方法如下。
1.3.3.1 配制PCR 反应液
按照下列组分配制 PCR 反应液(反应液配制在冰上进行)。
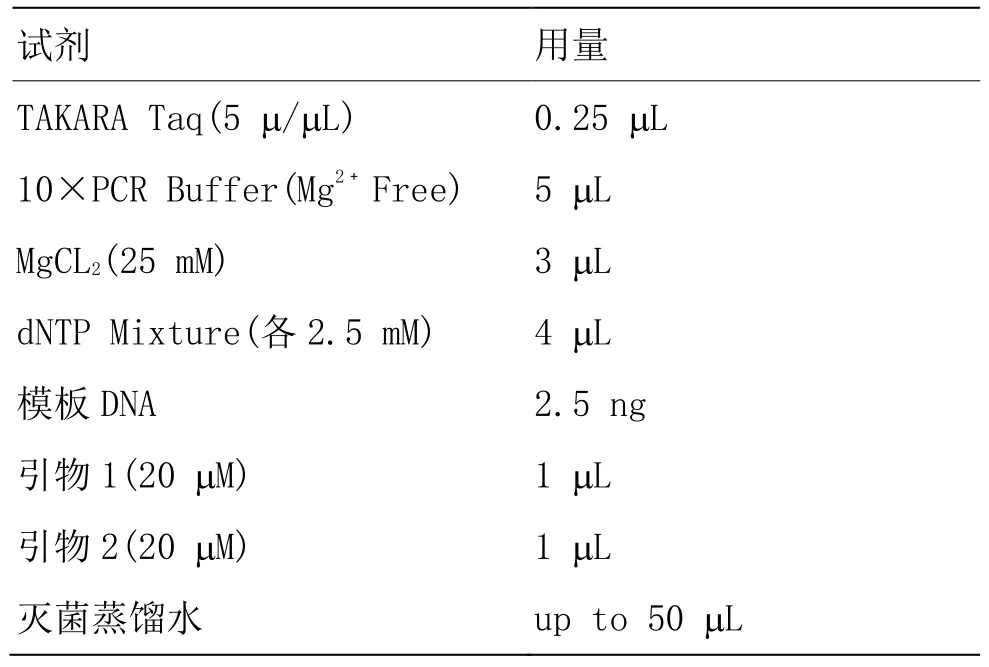
表2 PCR 反应液配制
1.3.3.2 反应程序
以 Tg(APP)Tg(PS1)DNA 为模板,进行 PCR 反应,反应条件如下:
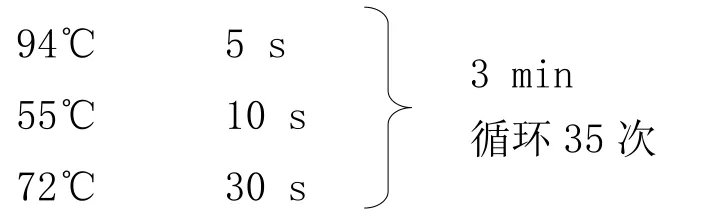
1.3.3.3 琼脂糖凝胶电泳
制备 2%琼脂糖凝胶加 EB 5 μL,加入扩增后DNA10 μL,120 V、30 min 电泳,观察 PCR 产物长度。
1.4 动物分组
PCR 检测结束后APP/PS1 双转基因鉴定结果为阳性的小鼠40 只(1.5 月龄)按随机数字表法随机分为模型组20 只和治疗组20 只。同龄同背景的C57BL6J 阴性纯合子野生型小鼠20 只(1.5 月龄)为正常组。饲养期间给予动物标准颗粒饲养及自由饮水。温度 22±1℃,相对湿度 50%~70%,换风次数 15~20 次/h,光照150~200 Lx,12 h 明暗交替,噪音<50 dB,设有温度、湿度、光照、压力梯度等自动控制和显示系统,饮用水及饲料均高温蒸汽灭菌,喂养期间可自由饮水和进食。
1.5 干预方法
小鼠穴位定位参照中国针灸学会实验针灸分会制定的《动物针灸穴位图谱》及比较解剖学方法,取心俞(第5 胸椎下两旁肋间)、肾俞(第2 腰椎下两旁)穴。治疗前,3 组小鼠均剃除穴位区域毛发。采取人工固定小鼠,治疗组 AD 小鼠穴位区涂少量凡士林(可粘住艾炷即可),以麦粒大小艾炷(5 mm×8 mm)艾灸双侧心俞、肾俞,当艾炷燃烧至 3/5(以小鼠的耐受度为限),即去除,每次灸1 壮,若有皮肤烫伤,涂湿润烧伤膏少许。正常组和模型组给予抓取、固定及放置未燃烧的艾炷等刺激,小鼠治疗时间均为每日1 次,连续治疗 10 d,中间休息2 d,再继续下一次治疗,总共治疗5.5 个月(全部治疗结束后小鼠为7 月龄)。
1.6 样本取材处理
1.6.1 灌注固定
将实验动物小鼠麻醉、取脑。用10%水合氯醛(一般 0.1 mL/10 g)腹腔注射麻醉小鼠成功后,将其仰卧伸展四肢固定于平台上,开胸暴露并游离出心脏和肝脏。将输液器针头从心尖部位穿入左心室,并用止血钳固定于左心室,然后将右心耳剪口以使血液和灌注液流出。快速灌注0.9%生理盐水50 mL 左右至肝脏完全变白,右心室流出澄清液体后,改灌 4%多聚甲醛固定液,先快速再缓慢灌注60 mL 左右,若观察到小鼠尾巴翘起或四肢抽搐,表明多聚甲醛进入体循环,即完成固定。灌注固定后断头,完整取出小鼠脑,投入4%多聚甲醛溶液中固定。
1.6.2 脱水
将固定好的标本投入 10%蔗糖进行脱水处理。待标本于10%蔗糖溶液中下沉至容器底部后,换至30%蔗糖溶液,4℃过夜。
1.6.3 包埋与冷冻
脱水后的标本用OCT 胶充分包埋,编写样本序号,液氮速冻,放置-80℃冰箱贮藏。
1.6.4 冰冻切片
每只小鼠脑组织在恒冷箱冰冻切片机切片,于视交叉前、后连续冠状切片,片厚约20 μm。剩余暂未实验切片继续放置于-80℃冰箱贮藏。
1.7 指标检测
采用免疫荧光双标实验检测皮层及海马 Aβ1-42与GFAP 的共表达。①脑组织进行冰冻切片,片厚约20 μm,贴片法,37℃,1 h。②PBS 洗4 次,一次10 min,取出玻片,用纸小心擦去多余水分,但不能使组织干燥。用组化油笔将待染组织圈好。③滴加封闭液 37℃孵育30 min。④同时加入一抗兔来源(Aβ1-421:1000)、山羊来源(GFAP1:1000),置于湿盒,37℃孵育2 h 后转入4℃过夜。⑤次日拿出湿盒,37℃复温1 h,弃一抗,PBS洗4 次,一次10 min。⑥滴加二抗Cy3 红色荧光标记的驴抗兔(1:150)、AF488 绿色荧光标记的驴抗山羊(1:500),37℃避光 2 h。⑦弃二抗,PBS 洗 4 次,一次10 min,避光。⑧晾干后,滴加抗荧光猝灭封片液,用处理干净的盖玻片封片。⑨激光共聚焦显微镜下观察、拍片,在免疫荧光染色切片的海马区和额叶皮层各取6 个视野(20×),应用图像分析软件测量每个视野内Aβ1-42与GFAP 共表达指标的阳性细胞率。
1.8 统计学方法
采用SPSS17.0 对数据进行统计分析。符合正态分布的计量资料均以均数±标准差表示。组间两两比较,方差齐时采用LSD检验,方差不齐采用Dunnett’s T3检验。以P<0.05 为差异具有统计学意义。
2 结果
2.1 APP/PS1 转基因小鼠基因型的鉴定结果
本实验所用的 APP/PS1 双转基因小鼠表型稳定,PCR 法鉴定小鼠基因型。详见图1。

图1 PCR 法鉴定APP/PS1 转基因小鼠的凝胶电泳分析
2.2 艾灸治疗对早期AD 小鼠脑内Aβ1-42及GFAP 共表达的影响
荧光显微镜下,小鼠大脑GFAP 免疫阳性细胞广泛分布,GFAP 免疫阳性细胞胞体膨胀、肥大,突起较多,呈树枝状,且突起增厚、浓染,数个阳性细胞可聚集成团,为活化的星形胶质细胞。淀粉样斑块沉淀呈红色荧光。GFAP 与 Aβ1-42淀粉样蛋白免疫荧光双标染色结果显示,小鼠大脑皮层和海马内活化的绿色星形胶质细胞GFAP 成簇状围绕在红色Aβ斑块周围,胞体膨胀、肥大;突起较多,呈树枝状,有的突起伸入到红色斑块内。
实验观察发现,模型组小鼠脑内 GFAP、Aβ1-42的阳性细胞表达率较对应的正常组明显增多,但是经过麦粒灸治疗后的AD 小鼠脑内GFAP、Aβ1-42的阳性细胞表达率比模型组显著减少,提示了早期麦粒灸疗法治疗AD 有显著治疗效果,可以抑制AD 小鼠星形胶质细胞的炎症反应,抑制Aβ异常聚集。详见表3。
表3 各组小鼠脑内Aβ1-42及GFAP 共表达的比较 (±s,%)
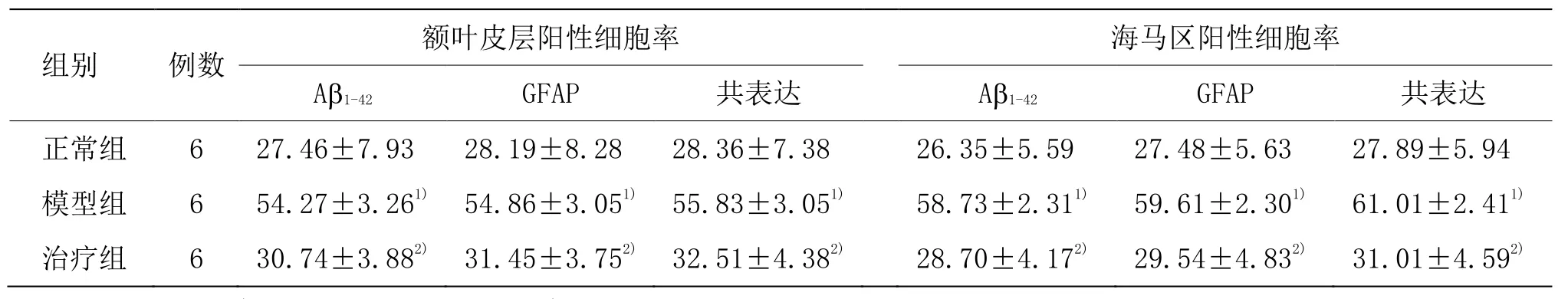
表3 各组小鼠脑内Aβ1-42及GFAP 共表达的比较 (±s,%)
注:与正常组比较1)P<0.01;与模型组比较2)P<0.01
组别 例数 额叶皮层阳性细胞率 海马区阳性细胞率Aβ1-42 GFAP 共表达 Aβ1-42 GFAP 共表达正常组 6 27.46±7.93 28.19±8.28 28.36±7.38 26.35±5.59 27.48±5.63 27.89±5.94模型组 6 54.27±3.261) 54.86±3.051) 55.83±3.051) 58.73±2.311) 59.61±2.301) 61.01±2.411)治疗组 6 30.74±3.882) 31.45±3.752) 32.51±4.382) 28.70±4.172) 29.54±4.832) 31.01±4.592)
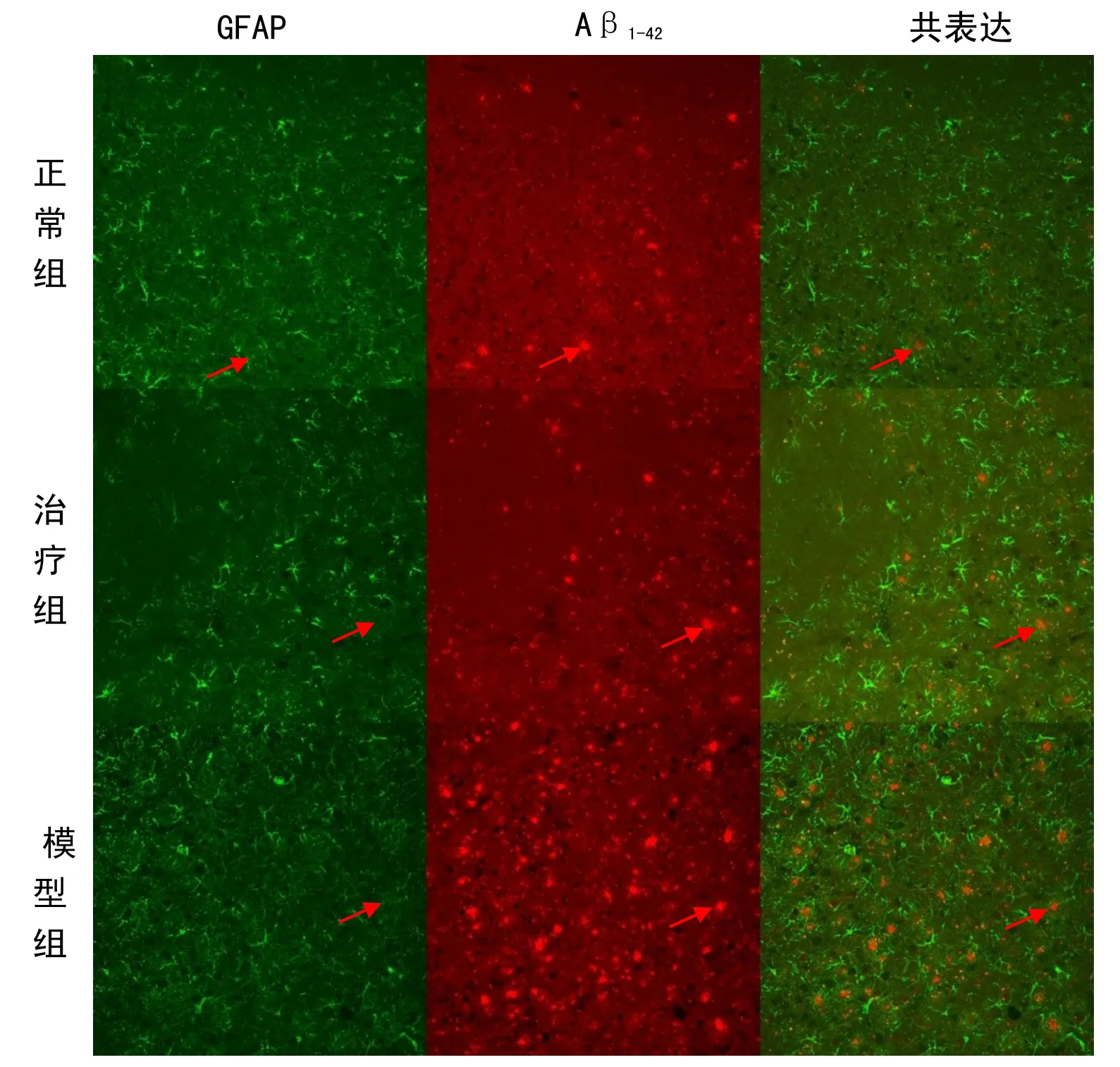
图2 额叶皮层区Aβ1-42及GFAP 共表达(×20)
3 讨论
β-淀粉样蛋白(Aβ)具有很强的自聚性,极易形成极难消融的沉淀并逐渐沉积于脑中[7]。Aβ沉积亦会激活星形胶质细胞,在神经胶质细胞中,星形胶质细胞数目最多,散布最广,担负着神经胶质细胞的大部分功能,星形胶质细胞的功能发生变化将影响其对神经元的保护作用。许多研究称在AD 脑组织中的淀粉样斑块周围含有的星形胶质细胞及小胶质细胞的数量极其多,且伴有不同程度的形态改变,如星形胶质细胞胞体肥大、变性及萎缩等[8],激活的星形胶质细胞对神经系统有双重作用,既有保护作用又有毒性作用[9]。许多研究表明神经炎症在AD 病变发展过程中起着很重要的作用,激活的星形胶质细胞可以释放多种炎症因子来调节AD 的病情发展[10-11]。
Aβ主要是由其前体蛋白(amyloid precursorprotein, APP)经过β-分泌酶、γ-分泌酶裂解形成,根据肽段的长度不同,在体内以多种形式存在,Aβ是细胞的固有成分,在正常人脑脊髓液中可溶性Aβ和AD 中出现的浓度相同,这说明 Aβ是一种自然而非病理性的产物[12]。Aβ是脑内主要的兴奋性和抑制性神经递质,包括 Aβ1-40、Aβ1-42、Aβ1-43三种,而在脑内发挥神经毒性作用的主要是 Aβ1-40和 Aβ1-42两种[13-14]。除了介导正常的突触传递外,还参与突触的可塑性[15]、学习和记忆[16]、神经发育[17]以及神经毒性[18]等诸多生理病理功能。其中 Aβ1-40是主要成分,Aβ1-42聚集性最强,有更强的神经细胞毒性。Aβ1-42已被证实具有较高的聚集倾向,同时被认为是老年斑中最主要的淀粉样物质[19],过渡态的Aβ1-42寡聚物或纤维会导致线粒体功能阻滞,神经细胞的凋亡,神经回路障碍,尤其与突触和神经元的损失相关,最后引起痴呆症[20]。Aβ1-42聚集是引起Aβ1-42毒性蛋白的主要原因,Aβ1-42毒性蛋白是引起AD 发病的主要原因,所以,抑制Aβ1-42的聚集可以有效防止AD 的发生[21]。
胶质纤维酸性蛋白(GFAP)是星形胶质细胞内的中间丝蛋白,是公认的星形胶质细胞的标志蛋白,GFAP表达上调的程度代表星形胶质细胞增生活跃程度,在脑损伤的炎症中会出现以GFAP 为特征的纤维化。通过研究 GFAP 的表达强或弱可反映在正常及病理条件下星形胶质细胞的功能状态[22]。星形胶质细胞通过形态和功能的改变由静息状态转化为激活、增生状态时,可以造成中枢神经系统功能的损伤,这一激活的过程以 GFAP 表达水平的增多为主要表现[23]。国外学者Landfield PW 等[24]发现老年记忆损害的大鼠海马内的星形细胞肥大,并认为GFAP 与老年学习记忆能力减退之间有一定的关联性。
AD 患者脑内伴有明显胶质细胞反应,斑块周围出现大量星形胶质细胞,激活星形胶质细胞在老年斑的形成中起到重要作用。激活的星形胶质细胞具有吞噬功能,可吞噬并降解 Aβ,有研究发现 Aβ可促进星形胶质细胞释放细胞因子,如 IL-1β、IL-6、IFN-γ、IL-13、IL-17、IP-10 等,这些物质对神经元有毒性作用,而星形胶质细胞的激活又能够诱导 Aβ神经毒性的产生,使神经元凋亡并坏死。蔡志友等[25]所做实验的直线相关分析表明Aβ1-42与GFAP 表达呈显著正相关。星形胶质细胞的增强激活会增加炎症介质的分泌,使得 Aβ1-42产物增加,而 Aβ1-42产物增多则进一步激活星形胶质细胞释放炎症因子而增加 Aβ1-42产物的生成,从而发生级联放大作用。所以笔者认为Aβ1-42与GFAP 的表达有一定的关联性。
古人云:“药之不及,针之不到,必须灸之。”《名医别录》:“艾味苦,微温,无毒,主灸百病。”艾属菊科多年生草本植物,其气味芳香、易燃,艾灸可通过艾叶辛温之性,激发人体经络之气,温阳补虚,以达到补益人体正气,防病保健“治未病”的目的[26]。艾灸是中医传统治疗方法,具有防病保健的作用,在疾病的早期干预治疗方面具有其特定的优势。《扁鹊心书》:“保命之法,灼艾第一。”《类经图翼》:“神阙行隔盐灸,艾灸至三五百壮,不惟疾愈,亦且延年。”《外台秘要》:“三里养先后天之气,灸三里可使元气不衰,故称长寿之灸。”近年来,艾灸在延缓衰老方面的研究取得了较大突破,大量研究表明艾灸具有延缓衰老的作用。吴巧凤等[27]对学习记忆能力减退的SD 老年大鼠进行艾灸治疗,发现艾灸具有促进学习记忆能力减退的老年大鼠海马神经发生的作用。陈兴华等[28]观察艾灸五脏背俞穴对模型大鼠海马神经元形态结构的影响,提示艾灸治疗可抑制大鼠海马神经元凋亡,对大鼠的脑损伤也具有一定的保护作用。乔秀兰等[29]发现艾灸能够抑制快速老化小鼠皮层神经干细胞向成熟星形胶质细胞和少突胶质细胞分化。
由此可见,艾灸疗法相对其他疗法来说具有一定的优势,是治疗与学习记忆相关疾病的良好治疗方式。但是到目前为止关于麦粒灸疗法治疗 AD 的机制的研究很少,所以本研究在双转基因小鼠1.5 月龄时,脑内刚开始发生Aβ聚集的AD 病理过程早期介入麦粒灸治疗,通过艾灸治疗后,与模型组比较,治疗组小鼠额叶皮层和海马区Aβ1-42的表达明显减少。研究结果表明,早期麦粒灸疗法对治疗AD 有显著治疗效果,可以抑制AD 小鼠星形胶质细胞的炎症反应,抑制 Aβ异常聚集,从而延缓AD 病理过程进展,达到“既病防变”的目的。

