应用单层和双层密度梯度离心法处理男性不育症患者精液效果对比
梁嘉颖 郑毅春 张杰 黄志承 张曦倩
广东省妇幼保健院生殖健康与不孕症科(广州510010)
选择合适的精子优选方法是辅助生殖技术成功的重要条件之一。优选技术能将精子从精浆中分离出来,对精子获能十分重要,但精子在受精培养基中的染色体不规则变化也会对受精和胚胎发育产生影响[1],精子核DNA 碎片含量与受精率和植入率呈负相关,与流产率和部分后代疾病发病率呈正相关[2]。此类染色体结构变化无法通过精子浓度,活动力和形态学等检查进行评估,因此,有效的优选技术不仅能筛选出高活力精子,还应回收到内部结构完整和受精功能良好的精子。
非连续密度梯度离心法是世界卫生组织人类精液检查与处理实验室手册第5 版[3](简称“WHO第5 版”)推荐的精子优选方法。使用不同体积、浓度和层数的梯度液能回收不同质量的精子[4]。目前对单层密度梯度离心法的临床评价不一,部分学者认为单层法具有试剂用量少和操作简便的优点,并可提高精子回收率和活动率[5];也有研究指出,单层法优选后的精子活力与优选前无显著差异[6]。此外,密度梯度离心法对精子细胞DNA完整性的影响亦存争议,一些研究表明其可有效分离存在缺陷DNA 和低聚染色质的精子[7],90%梯度液界面的精子DNA 完整性显著优于70%界面[8];有研究[9]则显示,其在选择高双链DNA 完整性的精子方面并不起作用。
本研究目的是比较单层(70%)和双层(45%+90%)密度梯度离心法优选后的精子质量,包括活动精子回收率、精子形态、DNA 碎片和成熟度等的差异,及其行夫精宫腔内人工授精(artificial insemination with husband′s sperm,AIH-IUI)的临床妊娠率,以期综合评估单层和双层密度梯度离心法的应用效果。
1 资料与方法
1.1 一般资料连续收集500 例(正常精子100例、轻度少精子症和轻度弱精子症各200 例)于2018年1月至12月在广东省妇幼保健院生殖健康与不孕症科行AIH-IUI 治疗的男性精液标本。诊断标准参照WHO 第5 版标准,正常精子:精液体积≥1.5 mL,精子浓度≥15 × 106/mL 或精子总数≥39 × 106,前向运动精子百分率(PR)≥32%,正常形态精子百分率(NP)≥4%;轻度少精子症:10 ×106/mL≤精子浓度<15 × 106/mL;轻度弱精子症:20% ≤PR% <32%[3]。所有受试者均签署知情同意书,研究经医院伦理委员会同意。
受试者年龄、精液体积、精子浓度、PR%、(PR+NP)%、诱发顶体反应率(AR)、DNA 碎片化指数(DFI)、成熟度和精液白细胞浓度等指标组间差异见表1。
表1 各组受试者精液标本参数Tab.1 The baseline semen samples characteristics of different groups±s
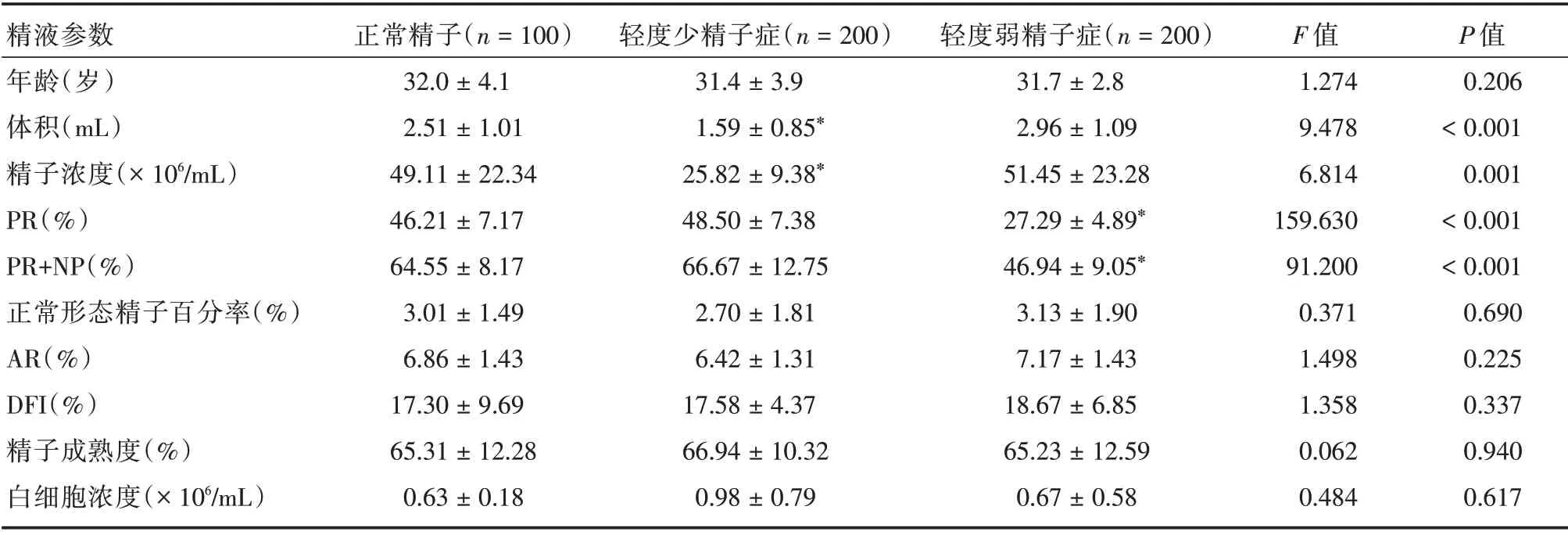
表1 各组受试者精液标本参数Tab.1 The baseline semen samples characteristics of different groups±s
注:与其他两组比较,*P <0.05
精液参数年龄(岁)体积(mL)精子浓度(×106/mL)PR(%)PR+NP(%)正常形态精子百分率(%)AR(%)DFI(%)精子成熟度(%)白细胞浓度(×106/mL)正常精子(n=100)32.0±4.1 2.51±1.01 49.11±22.34 46.21±7.17 64.55±8.17 3.01±1.49 6.86±1.43 17.30±9.69 65.31±12.28 0.63±0.18轻度少精子症(n=200)31.4±3.9 1.59±0.85*25.82±9.38*48.50±7.38 66.67±12.75 2.70±1.81 6.42±1.31 17.58±4.37 66.94±10.32 0.98±0.79轻度弱精子症(n=200)31.7±2.8 2.96±1.09 51.45±23.28 27.29±4.89*46.94±9.05*3.13±1.90 7.17±1.43 18.67±6.85 65.23±12.59 0.67±0.58 F 值1.274 9.478 6.814 159.630 91.200 0.371 1.498 1.358 0.062 0.484 P 值0.206<0.001 0.001<0.001<0.001 0.690 0.225 0.337 0.940 0.617
1.2 试剂瑞典Vitrolife 公司的SpermGrad、SpermRinse 和GIVF;珠海贝索生物技术有限公司的精子(细胞)形态学Diff-Quik 快速染色液;南京欣迪生物药业工程有限责任公司的白细胞过氧化物酶染色试剂盒;深圳博锐德生物科技有限公司的SCD 法精子DNA 碎片检测试剂盒和固相捕获法精子透明质酸结合试验试剂盒等。
1.3 主要仪器西班牙Microptic 公司的SCA 计算机辅助精液分析系统(CASA);日本Olympus 公司的BX53 普通光学显微镜;德国Eppendorf 公司的移液器;上海齐欣科学仪器有限公司的CU-600 电热恒温水浴箱等。
1.4 方法
1.4.1 精液采集受检者禁欲2~7 d,手淫方式采集精液于洁净无菌一次性采精杯中,记录采集时间,放置37 ℃孵育箱20 min。
1.4.2 精液常规检测记录精液体积、pH 值、性状等,CASA 系统检测精子浓度、PR 和PR+NP,并自动算出精子总数、PR 精子总数和PR+NP 精子总数。计算值:PR 精子回收率(%)=优选后PR 精子总数/优选前PR 精子总数×100%,PR+NP 精子回收率(%)=优选后PR+NP 精子总数/优选前PR+NP 精子总数×100%。
1.4.3 精子形态分析采用Diff-Quik 染色法,普通光学显微镜下1000×倍油镜观察分析至少200条精子,计数正常形态和异常形态(头部缺陷、颈部和中段缺陷、主段缺陷和过量残留胞浆ERC 等)精子数,并计算出正常形态精子百分率。
1.4.4 指标观察精子诱发顶体反应率(AR)、DNA 碎片化指数(DFI)、成熟度和精液白细胞浓度分析均严格按照各试剂盒操作规程进行。
1.4.5 精液优化处理精液液化后,制备1 mL+1 mL 90%+45% SpermGrad 双层梯度液或2 mL 70%SpermGrad 单层梯度液,小心在最上层加入不超过2 mL 精液;340×g离心20 min 后弃上清,吸取底部沉淀,置5 mL SpermRinse 中混匀,340×g离心8 min 后弃上清,吸取底部沉淀置0.6 mL GIVF 液中混匀作授精液,记录每份精液优选后的精子浓度、PR 和PR+NP,计算回收率;留取0.1 mL 作精子功能检测,其余根据WHO 第5 版[3]和前期研究结果[10],置5%CO2、37 ℃、95%湿度培养箱孵育20 ~40 min,行AIH-IUI 手术。
1.5 统计学方法用SPSS 17.0 软件进行统计分析,多样本组比较采用方差分析,两两组间比较采用q检验,成对样本比较采用t检验,率的比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 正常精子组精液优化处理前后参数比较正常精子组精液经优选后,单层法(45 份)精子浓度高于双层法(55 份),PR%和PR 精子回收率低于双层法(P<0.05),两种方法的PR + NP 和PR + NP精子回收率差异均无统计学意义(P>0.05);经两种方法优选后,正常形态精子百分率、AR、DFI、成熟度和精液白细胞浓度等指标,与优选前的差异有统计学意义(P<0.05)。见表2。
表2 正常精子组精液经两种密度梯度方法处理前后的精子参数对比Tab.2 Semen parameters by two gradient centrifugation in group normozoospermia ±s
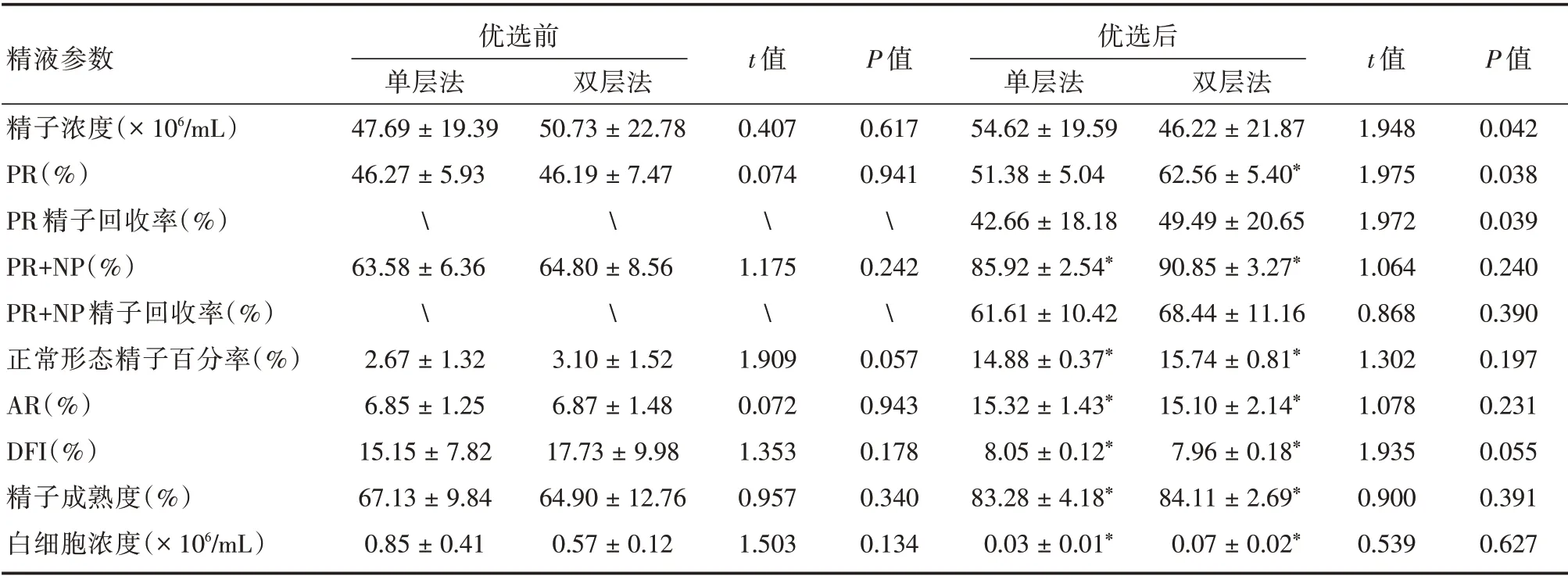
表2 正常精子组精液经两种密度梯度方法处理前后的精子参数对比Tab.2 Semen parameters by two gradient centrifugation in group normozoospermia ±s
注:与优选前比较,*P <0.05
精液参数精子浓度(×106/mL)PR(%)PR 精子回收率(%)PR+NP(%)PR+NP 精子回收率(%)正常形态精子百分率(%)AR(%)DFI(%)精子成熟度(%)白细胞浓度(×106/mL)优选前单层法47.69±19.39 46.27±5.9363.58±6.362.67±1.32 6.85±1.25 15.15±7.82 67.13±9.84 0.85±0.41双层法50.73±22.78 46.19±7.4764.80±8.563.10±1.52 6.87±1.48 17.73±9.98 64.90±12.76 0.57±0.12 t 值0.407 0.0741.1751.909 0.072 1.353 0.957 1.503 P 值0.617 0.941�.242�.057 0.943 0.178 0.340 0.134优选后单层法54.62±19.59 51.38±5.04 42.66±18.18 85.92±2.54*61.61±10.42 14.88±0.37*15.32±1.43*8.05±0.12*83.28±4.18*0.03±0.01*双层法46.22±21.87 62.56±5.40*49.49±20.65 90.85±3.27*68.44±11.16 15.74±0.81*15.10±2.14*7.96±0.18*84.11±2.69*0.07±0.02*t 值1.948 1.975 1.972 1.064 0.868 1.302 1.078 1.935 0.900 0.539 P 值0.042 0.038 0.039 0.240 0.390 0.197 0.231 0.055 0.391 0.627
2.2 轻度少精子症组精液优化处理前后参数比较轻度少精子症组精液经优选后,单层法(90份)精子浓度、PR+NP 和PR+NP 精子回收率高于双层法(110 份),差异有统计学意义(P<0.05),两种方法的PR 和PR 精子回收率差异均无统计学意义(P>0.05);经两种方法优选后,PR、PR + NP、AR、DFI、精子成熟度和精液白细胞浓度等指标,与优选前的差异有统计学意义(P<0.05)。见表3。
2.3 轻度弱精子症组精液优化处理前后参数比较轻度弱精子症组精液经优选后,单层法(90份)和双层法(110 份)的PR 和PR+NP 精子回收率差异无统计学意义(P>0.05);经两种方法优选后,PR 、PR+NP、AR、DFI、精子成熟度和精液白细胞浓度等指标,与优选前的差异有统计学意义(P<0.05)。见表4。
2.4 3 组精液经单层法和双层法优选前后精子参数的比较经两种方法优选后,轻度弱精子症组PR 和PR+NP 精子回收率高于正常精子组和轻度少精子症组,差异有统计学意义(P<0.05)。见表5。
表3 轻度少精子症组精液经两种密度梯度法处理前后的精子参数对比Tab.3 Semen parameters by two gradient centrifugation in group mild oligospermia ±s
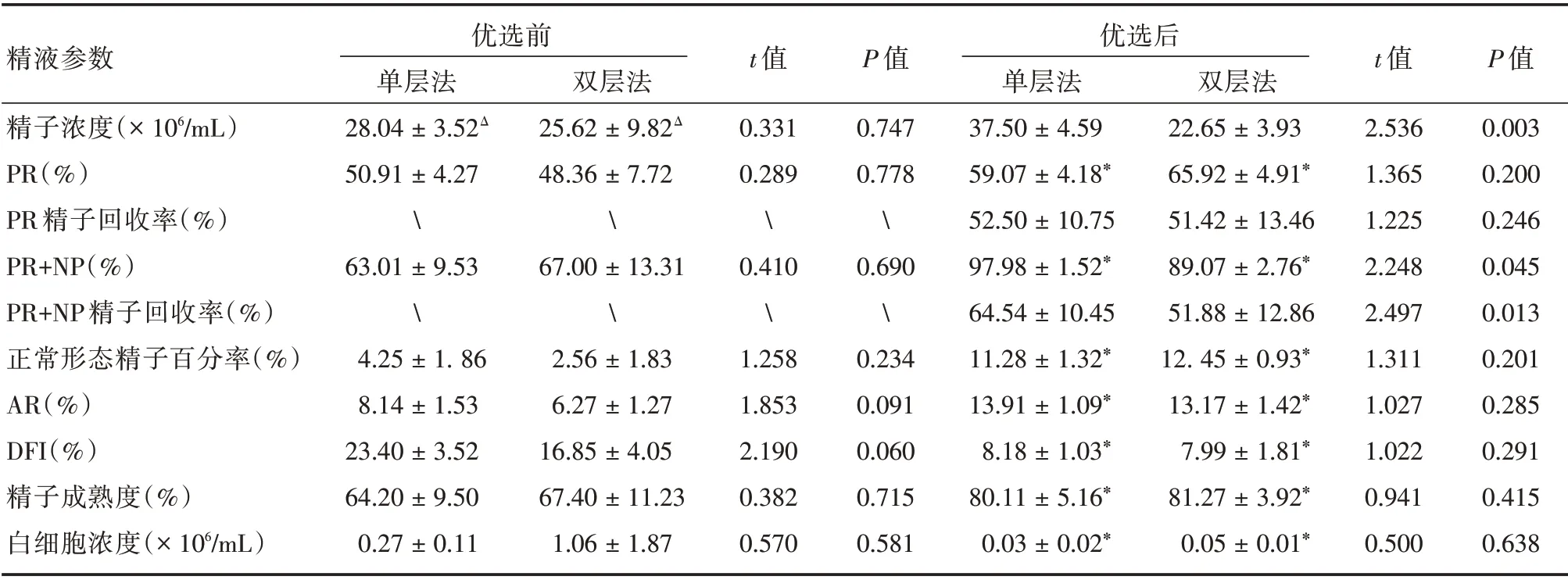
表3 轻度少精子症组精液经两种密度梯度法处理前后的精子参数对比Tab.3 Semen parameters by two gradient centrifugation in group mild oligospermia ±s
注:与优选前比较,*P <0.05;与正常精子组和轻度弱精子症组相比,ΔP <0.05
精液参数精子浓度(×106/mL)PR(%)PR 精子回收率(%)PR+NP(%)PR+NP 精子回收率(%)正常形态精子百分率(%)AR(%)DFI(%)精子成熟度(%)白细胞浓度(×106/mL)优选前单层法28.04±3.52Δ 50.91±4.2763.01±9.534.25±1.86 8.14±1.53 23.40±3.52 64.20±9.50 0.27±0.11双层法25.62±9.82Δ 48.36±7.7267.00±13.312.56±1.83 6.27±1.27 16.85±4.05 67.40±11.23 1.06±1.87 t 值0.331 0.289�.4101.258 1.853 2.190 0.382 0.570 P 值0.747 0.778�.690�.234 0.091 0.060 0.715 0.581优选后单层法37.50±4.59 59.07±4.18*52.50±10.75 97.98±1.52*64.54±10.45 11.28±1.32*13.91±1.09*8.18±1.03*80.11±5.16*0.03±0.02*双层法22.65±3.93 65.92±4.91*51.42±13.46 89.07±2.76*51.88±12.86 12.45±0.93*13.17±1.42*7.99±1.81*81.27±3.92*0.05±0.01*t 值2.536 1.365 1.225 2.248 2.497 1.311 1.027 1.022 0.941 0.500 P 值0.003 0.200 0.246 0.045 0.013 0.201 0.285 0.291 0.415 0.638
表4 轻度弱精子症组精液经两种密度梯度法处理前后的精子参数对比Tab.4 Semen parameters by two gradient centrifugation in group mild asthenospermia ±s
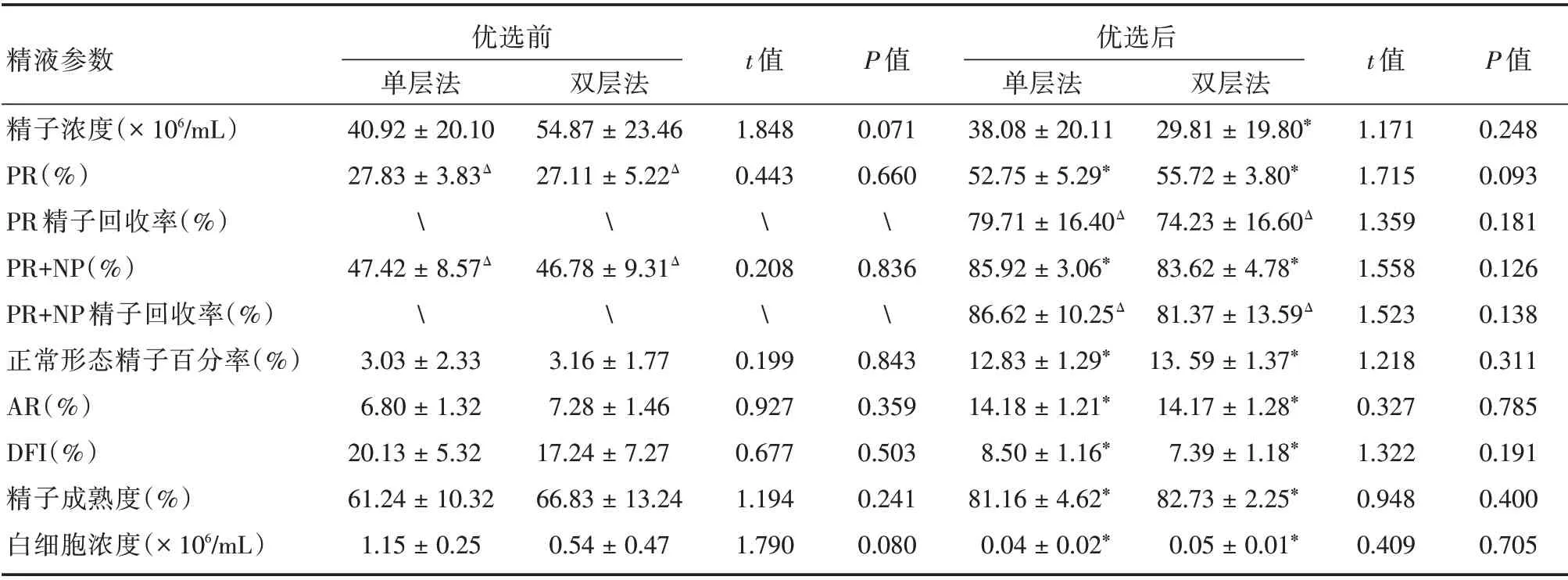
表4 轻度弱精子症组精液经两种密度梯度法处理前后的精子参数对比Tab.4 Semen parameters by two gradient centrifugation in group mild asthenospermia ±s
注:与优选前比较,*P <0.05;与正常精子组和轻度少精子症组相比,ΔP <0.05
精液参数精子浓度(×106/mL)PR(%)PR 精子回收率(%)PR+NP(%)PR+NP 精子回收率(%)正常形态精子百分率(%)AR(%)DFI(%)精子成熟度(%)白细胞浓度(×106/mL)优选前单层法40.92±20.10 27.83±3.83Δ47.42±8.57Δ3.03±2.33 6.80±1.32 20.13±5.32 61.24±10.32 1.15±0.25双层法54.87±23.46 27.11±5.22Δ46.78±9.31Δ3.16±1.77 7.28±1.46 17.24±7.27 66.83±13.24 0.54±0.47 t 值1.848 0.443�.208�.199 0.927 0.677 1.194 1.790 P 值0.071 0.660�.836�.843 0.359 0.503 0.241 0.080优选后单层法38.08±20.11 52.75±5.29*79.71±16.40Δ 85.92±3.06*86.62±10.25Δ 12.83±1.29*14.18±1.21*8.50±1.16*81.16±4.62*0.04±0.02*双层法29.81±19.80*55.72±3.80*74.23±16.60Δ 83.62±4.78*81.37±13.59Δ 13.59±1.37*14.17±1.28*7.39±1.18*82.73±2.25*0.05±0.01*t 值1.171 1.715 1.359 1.558 1.523 1.218 0.327 1.322 0.948 0.409 P 值0.248 0.093 0.181 0.126 0.138 0.311 0.785 0.191 0.400 0.705
2.5 单层法和双层法的AIH-IUI 临床妊娠率选择研究时间内,妻子采用来曲唑(LE)促排方案行AIH-IUI 治疗的334 个周期,分析了正常精子组、轻度少精子症组和轻度弱精子症组精液经单层法和双层法优选后,行AIH-IUI 的临床妊娠率,精液质量分组之间和两种优选方法之间差异均无统计学意义(P>0.05)。见表6。
3 讨论
密度梯度离心法是目前ART 中常用的精子优选方法。研究[11]报道,与其他方法相比,此法既能回收更多正常形态活动精子,亦可提高辅助生殖治疗妊娠率[12];单层密度梯度离心法能改善正常精液和男性不育患者精液质量[13];双层法梯度离心后精子回收率约40%[14];在85%~100%的梯度液界面,活动精子含量最高,异常精子和非精成分能被大量清除[15]。
本研究结果显示,使用单层法优选后的精子浓度高于双层法;正常精液经双层法优选后,PR和PR 精子回收率高于单层法,PR 和PR+NP 高于优选前;轻度少精子症精液经单层法优选后,PR+NP 和PR+NP 精子回收率高于双层法,两种方法优选后PR 和PR+NP 高于优选前,差异均有统计学意义(P<0.05)。这些数据都说明单层法和双层法对不同质量的精子其回收能力有所不同。本研究还发现,轻度弱精子症组精液经两种密度梯度离心法优选后,PR 和PR+NP 精子回收率均高于其他两组,差异有统计学意义(P<0.05),提示密度梯度离心法可能较适宜于轻度弱精子症精子的优选。
表5 3 组精液经单层法和双层法优选前后精子参数的比较Tab.5 Semen parameters by two gradient centrifugation in all groups ±s
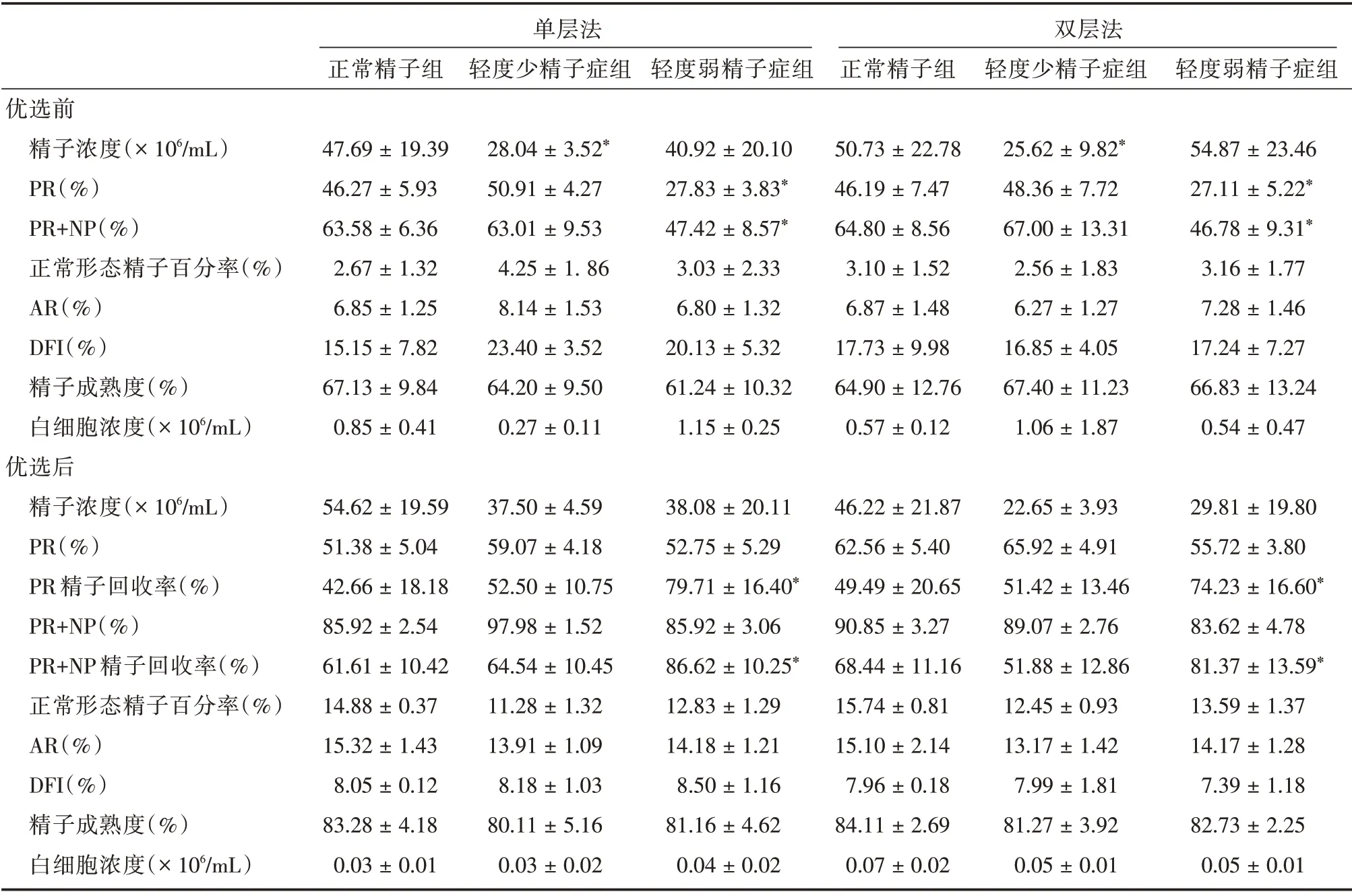
表5 3 组精液经单层法和双层法优选前后精子参数的比较Tab.5 Semen parameters by two gradient centrifugation in all groups ±s
注:与其他两组相比,*P <0.05
单层法正常精子组轻度少精子症组轻度弱精子症组双层法正常精子组轻度少精子症组轻度弱精子症组优选前精子浓度(×106/mL)PR(%)PR+NP(%)正常形态精子百分率(%)AR(%)DFI(%)精子成熟度(%)白细胞浓度(×106/mL)优选后精子浓度(×106/mL)PR(%)PR 精子回收率(%)PR+NP(%)PR+NP 精子回收率(%)正常形态精子百分率(%)AR(%)DFI(%)精子成熟度(%)白细胞浓度(×106/mL)47.69±19.39 46.27±5.93 63.58±6.36 2.67±1.32 6.85±1.25 15.15±7.82 67.13±9.84 0.85±0.41 28.04±3.52*50.91±4.27 63.01±9.53 4.25±1.86 8.14±1.53 23.40±3.52 64.20±9.50 0.27±0.11 40.92±20.10 27.83±3.83*47.42±8.57*3.03±2.33 6.80±1.32 20.13±5.32 61.24±10.32 1.15±0.25 50.73±22.78 46.19±7.47 64.80±8.56 3.10±1.52 6.87±1.48 17.73±9.98 64.90±12.76 0.57±0.12 25.62±9.82*48.36±7.72 67.00±13.31 2.56±1.83 6.27±1.27 16.85±4.05 67.40±11.23 1.06±1.87 54.87±23.46 27.11±5.22*46.78±9.31*3.16±1.77 7.28±1.46 17.24±7.27 66.83±13.24 0.54±0.47 54.62±19.59 51.38±5.04 42.66±18.18 85.92±2.54 61.61±10.42 14.88±0.37 15.32±1.43 8.05±0.12 83.28±4.18 0.03±0.01 37.50±4.59 59.07±4.18 52.50±10.75 97.98±1.52 64.54±10.45 11.28±1.32 13.91±1.09 8.18±1.03 80.11±5.16 0.03±0.02 38.08±20.11 52.75±5.29 79.71±16.40*85.92±3.06 86.62±10.25*12.83±1.29 14.18±1.21 8.50±1.16 81.16±4.62 0.04±0.02 46.22±21.87 62.56±5.40 49.49±20.65 90.85±3.27 68.44±11.16 15.74±0.81 15.10±2.14 7.96±0.18 84.11±2.69 0.07±0.02 22.65±3.93 65.92±4.91 51.42±13.46 89.07±2.76 51.88±12.86 12.45±0.93 13.17±1.42 7.99±1.81 81.27±3.92 0.05±0.01 29.81±19.80 55.72±3.80 74.23±16.60*83.62±4.78 81.37±13.59*13.59±1.37 14.17±1.28 7.39±1.18 82.73±2.25 0.05±0.01
表6 单层和双层密度梯度法与AIH-IUI 临床妊娠率的关系Tab.6 Correlation of clinical pregnancy with the two gradient centrifugation ±s
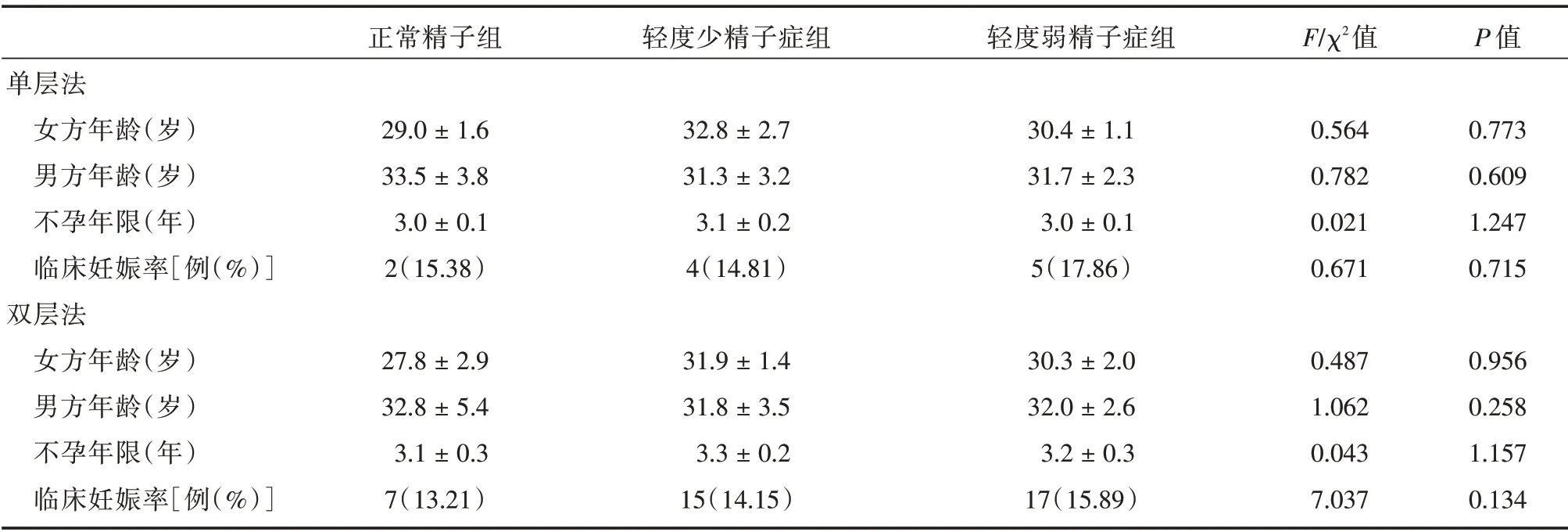
表6 单层和双层密度梯度法与AIH-IUI 临床妊娠率的关系Tab.6 Correlation of clinical pregnancy with the two gradient centrifugation ±s
正常精子组轻度少精子症组轻度弱精子症组F/χ2值P 值单层法女方年龄(岁)男方年龄(岁)不孕年限(年)临床妊娠率[例(%)]双层法女方年龄(岁)男方年龄(岁)不孕年限(年)临床妊娠率[例(%)]29.0±1.6 33.5±3.8 3.0±0.1 2(15.38)32.8±2.7 31.3±3.2 3.1±0.2 4(14.81)30.4±1.1 31.7±2.3 3.0±0.1 5(17.86)0.564 0.782 0.021 0.671 0.773 0.609 1.247 0.715 27.8±2.9 32.8±5.4 3.1±0.3 7(13.21)31.9±1.4 31.8±3.5 3.3±0.2 15(14.15)30.3±2.0 32.0±2.6 3.2±0.3 17(15.89)0.487 1.062 0.043 7.037 0.956 0.258 1.157 0.134
本研究中,单层和双层密度梯度离心得到的正常形态精子百分率均高于优选前,差异有统计学意义,与AUGER 等[16]研究结果相似。亦有研究发现密度梯度离心后精子形态并无改善[17]。这些差异可能是由于使用不同成分的梯度液、精子功能自然异构和精子形态判断标准不一等原因造成。
精子DNA 高度碎片化可能以多种方式影响辅助生殖的结局,包括受精率、胚胎卵裂率和临床妊娠率等[2,18]。因此,进行ART 治疗前应将精子DFI降至病理阈值以下。关于密度梯度离心法对精子细胞DNA 完整性的影响仍有争议。STEVANATO等[9]发现由于离心会使精子暴露于氧化应激,密度梯度离心法并不能筛选出双链DNA 完整性较高的精子,对于精子DNA 碎片较高的患者建议使用其他优选技术。本研究结果显示,使用单层和双层密度梯度离心法优选后,精子DFI 均低于优选前(P<0.05),但两种方法间差异无统计学意义(P>0.05),与MORRELL 等[15]研究结果相似,其认为密度梯度离心法优选后的精子,具有良好的活力、形态和DNA 完整性,可用于辅助生殖治疗。
本研究还发现,单层法和双层法密度梯度离心后,精子诱发顶体反应率(AR)、精子成熟度和精液白细胞浓度均显著优于处理前(P<0.05),两种方法间差异无统计学意义(P>0.05),且使用两种方法优选精子行AIH-IUI 的临床妊娠率差异亦无统计学意义(P>0.05),提示两种方法均可提高精子质量。
综上所述,本次研究证实了单层和双层密度梯度离心法各具优点,单层法分离后精子浓度较高,对轻度少弱精子症患者精液的活动精子回收能力较强;双层法分离后前向运动精子百分率更高;两种方法均能优选出功能较优精子,使用其进行人工授精的临床妊娠率无显著性差异。因此,应根据男性不育症患者的精子情况选择不同的优化处理方法。

