基于PacBio SMRT技术的婴幼儿配方奶粉微生物安全性评价
边燕飞 席晓霞 郑 艺 侯强川 孙天松 孙志宏
(内蒙古农业大学 乳品生物技术与工程教育部重点实验室农业部奶制品加工重点实验室 呼和浩特 010018)
作为母乳不足时的替代品,婴幼儿配方奶粉在牛乳或豆乳的基础上,调整和强化蛋白质、脂肪、维生素等主要营养素,从而适合不同阶段婴幼儿生长和营养的需求。我国是世界第二大婴幼儿配方奶粉消费市场,仅2017年1月,我国进口婴幼儿配方奶粉15 091 t,价值2.16亿美元[1]。由于婴幼儿配方奶粉使用人群的特殊性,所以其质量安全监控备受关注。随着婴幼儿配方奶粉生产审查的逐渐细化,彻底杜绝了物化污染的发生,然而,原料乳营养丰富、生产工艺要求特殊,影响其质量安全的一个重要因素——微生物污染,依然存在。
活性致病微生物是影响婴幼儿配方奶粉品质和安全的重要因素,特别是沙门氏菌和阪崎肠杆菌等,能导致新生儿脑膜炎和坏死性肠炎等疾病的发生[2-3]。虽然奶粉加工过程中的热处理工艺可将大量微生物灭活使其符合产品要求,但微生物所产生的耐热脂肪酶和蛋白酶仍具有活性,能够降低奶粉溶解度并使之产生异味[4-5]。此外,亦有研究指出许多病原性细菌在死亡裂解后会释放出大量的细菌内毒素并对机体造成潜在的危害[6-7]。防止婴幼儿配方奶粉中细菌的污染对其质量与安全至关重要。
近年来,我国加强了对婴幼儿配方奶粉污染微生物的监管,食品安全国家标准GB 10765-2010《婴儿配方食品》[8]基于传统的细菌纯培养技术规范了婴幼儿配方奶粉中污染微生物的具体检测方法。然而此技术仅适用于检测具有活性、丰度较大且可培养的微生物,无法全面反应婴幼儿配方奶粉的微生物污染情况。目前一些分子生物学检测技术因其快速、灵敏的特点,正被广泛采用,已成为食品安全监督的有力工具。其中PacBio SMRT(Single molecule real-time)测序技术采用宏基因组学的研究策略,通过将环境样品中微生物的基因组混合作为一个整体进行研究,打破了传统微生物学基于纯培养研究的局限性。而且相比于Illumina、454焦磷酸等高通量测序技术,此技术无需进行PCR扩增,可以直接读取目标序列,在细菌种水平上揭示样品的微生物菌群结构及丰度信息[9-11]。此外,ddPCR(Droplet digital PCR)是继qPCR之后的一种新型定量技术,此技术灵敏度高、精确度高以及耐受性高,无需制备标准品即可直接获得靶分子的浓度或拷贝数,能够更加精确地对环境样品中的微生物进行绝对定量分析[12-13]。
本研究采用PacBio SMRT测序技术,在分类学地位“种水平”上精确地揭示婴幼儿配方奶粉的污染微生物情况,同时通过ddPCR技术对其中的致病菌蜡样芽孢杆菌和大肠杆菌进行定量分析。通过本研究,初步建立了婴幼儿配方奶粉中污染微生物检测技术,为大型乳品企业的污染微生物标准化控制体系提供有力工具。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集 某一品牌不同批次的婴幼儿配方奶粉样品6份(IF1-IF6)。
1.1.2 试剂 OMEGA DNA isolation kit(货号:D5625-01)试剂盒,美国 OMEGA 公司;2×EasyTaq PCR SuperMix,北京全式金生物技术有限公司;SMRT Cell、SMRTbellTM Template Prep Kit 1.0试剂盒、DNA Polymerase Binding Kit P6 v2试剂盒、MagBead Buffer Kit v2试剂盒和Qubit定量试剂盒,美国Pacific Biosciences公司;ddPCR Supermix和Droplet Generation Oil,美国 Bio-Rad公司;平板计数琼脂(PCA)培养基、结晶紫中性红胆盐琼脂(VRBA)培养基、亚硫酸铋琼脂(BS)培养基、Baird-Parker琼脂培养基、胰蛋白胨大豆琼脂(TSA)培养基和乳平板计数琼脂(MPC)培养基,北京奥博星生物技术有限责任公司。
1.2 仪器与设备
5810R台式高速冷冻离心机,德国Eppendorf公司;CDS8000型UPV凝胶成像分析系统,北京赛智创业科技有限公司;DYY-12电泳仪,北京六一仪器厂;DHP-9272型电热恒温培养箱,上海一恒科学仪器有限公司;ND-1000型微量紫外分光光度计,美国Nano Drop公司;veriti梯度基因扩增仪,美国AB公司;QX200TM微滴式数字PCR仪,美国Bio-Rad公司;SMRT RS II测序仪,美国Pacific Biosciences公司。
1.3 试验方法
1.3.1 基于细菌纯培养技术的婴幼儿配方奶粉微生物计数 根据食品安全国家标准GB 10765-2010《婴儿配方食品》对婴幼儿配方奶粉中细菌菌落总数、大肠菌群、沙门氏菌、金黄色葡萄球菌和阪崎肠杆菌进行计数。参照Y/T 1331-2007《乳与乳制品中嗜冷菌、需氧芽孢及嗜热需氧芽孢数的测定》对婴幼儿配方奶粉中芽孢进行计数[14]。
1.3.2 婴幼儿配方奶粉DNA的提取 取1.0 g奶粉样品,采用OMEGA DNA isolation kit试剂盒提取婴幼儿配方奶粉宏基因组DNA,利用1.0%琼脂糖凝胶电泳和微量紫外分光光度计检验DNA的纯度以及浓度,符合后续试验要求的DNA置于-20℃冰箱备用。
1.3.3 细菌16S rRNA基因序列全长扩增 将1.3.2节中提取的DNA作为模板,以细菌16S rRNA基因全长序列为目的片段进行PCR扩增。扩增体系为:2×EasyTaq PCR SuperMix 25 μL,上、下游引物(10 μmol/L)各 1.5 μL,模板 DNA 2 μL,加ddH2O补充至50 μL。16S rRNA基因序列引物为27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R(5′-ACCTTGTTACGACTT-3′)[15],在正向引物中加入6个核苷酸标签(Barcode)。扩增条件为:95 ℃ 5 min;95 ℃ 1 min,58 ℃ 45 s,72 ℃ 1 min,30个循环;72℃ 7 min,PCR产物置4℃保存备用。
1.3.4 PacBio SMRT三代测序 将1.3.3节中的PCR扩增产物纯化、混样后,用SMRTbellTM Template Prep Kit 1.0试剂盒对纯化后的DNA进行修复,修复后的高质量DNA构建文库,然后使用DNA/Polymerase Binding Kit P6 v2试剂盒及MagBead Buffer Kit v2试剂盒将构建成功的文库进行引物、聚合酶的连接,应用PacBio RS II仪器上机测序。
1.3.5 高质量序列的提取 使用RS_ReadsOfinsert.1对1.3.4节中生成的原始序列进行质量控制,保留符合以下标准的序列:①最小通过率设定为5;②最小预测精确度为90;③最小插入序列长度为1 400 nt;④最大序列长度为1 800 nt。
1.3.6 生物信息学处理 应用QIIME(v1.7.0)平台,对1.3.5节生成的高质量序列进行生物信息学分析。首先采用PyNAST[16]将序列校准排齐后,在100%和98.65%的相似性下进行两步UCLUST[17]归并划分分类操作单元(Operational taxonomic units,OTU);继而从各OTU中选取1条代表性序列,使用 RDP(Ribosomal database project)[18]和Greengenes(v13.8)[19]数据库对其进行序列同源性比对,进而在门、纲、目、科、属和种水平明确其分类学地位;最后使用FastTree[20]构建基于OTU代表性序列的系统发育进化树,并对超1(chao1)指数、发现物种数(Observed species)、香农(Shannon-wiener)指数和辛普森(Simpson)指数等 alpha多样性指数进行计算。本研究中涉及的序列数据已提交至MG-RAST数据库,序列号为mgp81077。
1.3.7 基于ddPCR技术的蜡样芽胞杆菌和大肠杆菌的绝对定量 以1.3.2节中提取的DNA为模板进行PCR扩增,扩增体系为:2×ddPCR Supermix for probes 10 μL,模板 DNA 2 μL,上、下游引物(10 μmol/L)各 1.2 μL,探针(10 μmol/L)0.4 μL,加ddH2O补充至20 μL。将充分混匀的20 μL反应体系转移至微滴发生卡中,并向微滴发生卡中加入 70 μL Droplet generation oil,将微滴发生卡置于微滴发生器中反应。随后将生成的微滴转移至96孔板,封膜后进行PCR扩增反应。扩增条件为:95 ℃ 10 min;95 ℃ 30 s,60 ℃ 40 s,40 个循环;98℃ 10 min,4℃保存。PCR反应结束后将96孔板放入QX200 Droplet Reader进行检测,具体引物探针序列如表1所示。
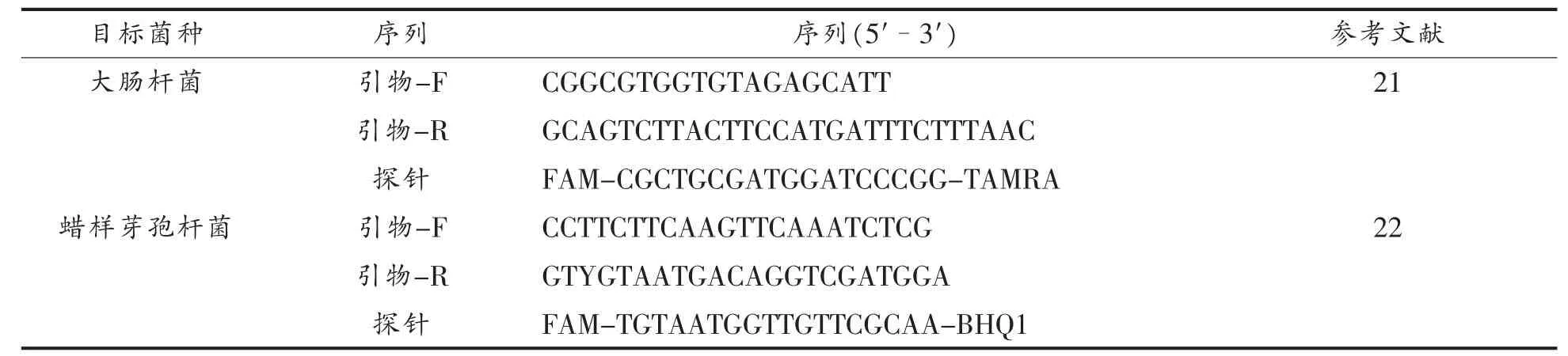
表1 目标菌特异性引物及探针Table1 Specific primers and probes of target bacteria
1.3.8 数据统计分析 使用Origin8.6软件(O-riginLab公司)作图,使用QuantaSoftTMSoftware(Bio-Rad公司)对ddPCR定量结果进行分析。
2 结果与分析
2.1 基于细菌纯培养技术的婴幼儿配方奶粉微生物计数
本研究以GB 10765-2010《婴儿配方食品》为依据,采用基于细菌纯培养技术对纳入本研究的6份婴幼儿配方奶粉样品的细菌菌落总数计数,结果发现其菌落总数分别为40,70,45,50,85,65 CFU/g。值得一提的是,所有样品均未检测出大肠菌群、沙门氏菌、金黄色葡萄球菌、阪崎肠杆菌和芽孢,因而所有样品均符合食品安全国家标准。
2.2 基于PacBio SMRT测序技术的婴幼儿配方奶粉污染微生物及丰度分析
2.2.1 测序量及丰度分析 在提取样品微生物DNA的基础上,本研究采用宏基因组策略,使用PacBio SMRT测序技术对婴幼儿配方奶粉污染微生物进行了研究,样品的测序序列信息和α多样性指数如表2所示。
由表2可知,本研究从6份婴幼儿配方奶粉样品中共获得34 435条高质量完整的16S rRNA基因序列,每个样品平均为5 739条(range=4 034~6 752)。根据序列的98.65%相似度水平划分操作分类单元(OTU)后,共得到4 301条具有代表性的细菌OTU序列。本研究进一步使用RDP和Greengenes数据库对序列进行同源性比对,结果发现仅有3.89%的序列不能鉴定到属水平,8.03%的序列不能鉴定到种水平。由表2亦可知,IF4样品的α多样性指数均低于其它样品,由此可见IF4样品的微生物菌群多样性最低。通过使用稀疏曲线和香农指数曲线,本研究进一步对测序深度是否满足后续生物信息学分析的要求进行了评估,其结果如图1所示。
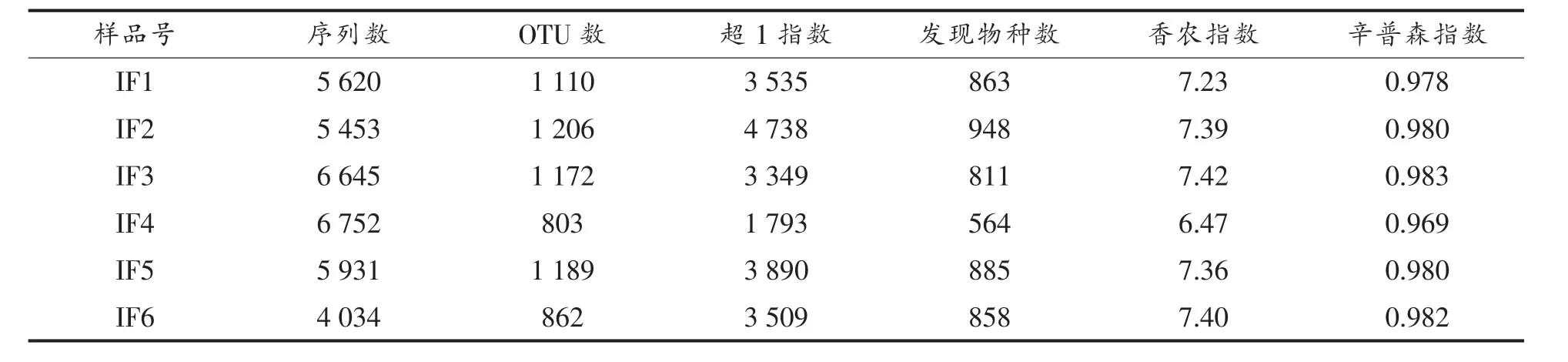
表2 样品的测序序列信息和α多样性指数Table2 Sequence abundance and α-diversity in all samples
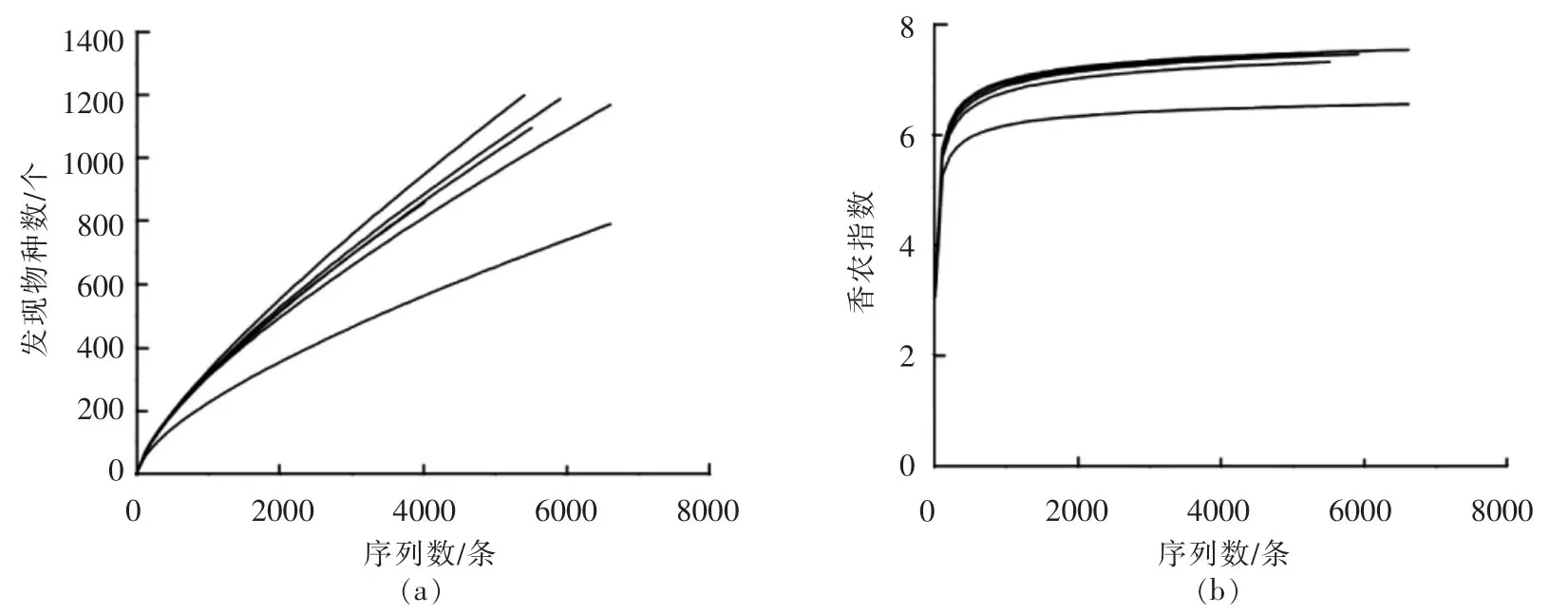
图1 稀疏曲线图(a)和香农多样性图(b)Fig.1 Rarefaction curves(a)and Shannon diversity index curves(b)
由图1可知,尽管依据当前的测序量每个样品的稀疏曲线未能进入平台期(1a),但香农多样性曲线已经达到饱和状态(1b)。由此可见,在本研究的测序深度下,样品中细菌的多样性已得到充分展现,满足后续生物信息学分析要求。
2.2.2 基于门、属和种水平婴幼儿配方奶粉细菌相对含量的分析 本研究进一步使用RDP和Greengenes数据库对序列进行同源性比对,将所有的序列鉴定为14个门、138个属和255个种。基于门水平婴幼儿配方奶粉中主要细菌相对含量的分析如图2所示。
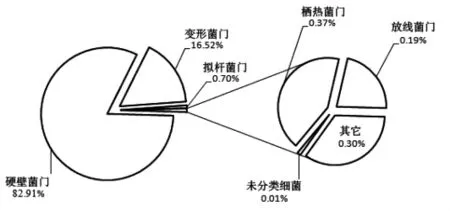
图2 基于门水平婴幼儿配方奶粉中主要细菌相对含量的分析Fig.2 The relative abundance of major bacteria in infant formula at the phylum level
由图2可知,婴幼儿配方奶粉中的细菌主要隶属于硬壁菌门(Firmicutes)和变形菌门(Proteobacteria),其平均相对含量分别为81.91%和16.52%。此外,本研究还发现了隶属于拟杆菌门(Bacteroidetes)、栖热菌门(Deinococcus-Thermus)和放线菌门(Actinobacteria)的细菌菌群,然而其平均相对含量较低,仅为0.70%,0.37%和0.19%。
基于属和种水平婴幼儿配方奶粉中主要细菌相对含量的分析如图3所示。
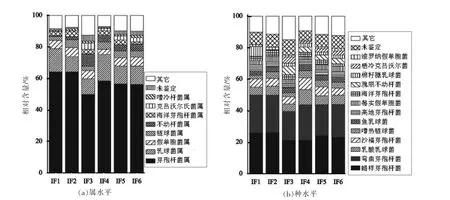
图3 基于属(a)和种(b)水平婴幼儿配方奶粉中主要细菌相对含量的分析Fig.3 The relative abundance of major bacteria in infant formula at the genus(a)and species(b)level
由图3a可知,在属水平上隶属于硬壁菌门且相对含量大于1.0%的细菌属及其含量分别为:芽孢杆菌属(Bacillus,58.19%)、乳球菌属(Lactococcus,12.38%)、链球菌属(Streptococcus,3.89%)和海洋芽孢杆菌属(Oceanobacillus,2.72%)。隶属于变形菌门且相对含量大于1.0%的细菌属及其含量分别为:假单胞菌属(Pseudomonas,5.02%)、不动杆菌属(Acinetobacter,3.80%)、克吕沃尔氏菌属(Kluyvera,1.82%)和嗜冷杆菌属(Psychrobacter,1.03%)。
由图3b可知,在种水平上隶属于硬壁菌门且相对含量大于1.0%的细菌种及其含量分别为:蜡样芽孢杆菌(Bacillus cereus,23.54%)、弯曲芽孢杆菌(Bacillus flexus,21.58%)、乳酸乳球菌(Lactococcus lactis,6.08%)、沙福芽孢杆菌(Bacillus safensis,5.39%)、嗜热链球菌(Streptococcus thermophilus,3.57%)、鱼乳球菌(Lactococcus piscium,3.38%)、高地芽孢杆菌(Bacillusaltitudinis,3.12%)、海洋芽孢杆菌(Oceanobacillus profundus,2.70%)和棉籽糖乳球菌(Lactococcus raffinolactis,2.49%)。隶属于变形菌门且相对含量大于1.0%的细菌种及其含量分别为:莓实假单胞菌(Pseudomonas fragi,2.98%)、栖冷克吕沃尔菌(Kluyvera cryocrescens,1.72%)、瑰丽不动杆菌(Acinetobacter guillouiae,2.58%)和维罗纳假单胞菌(Pseudomonas veronii,1.15%)。此外在 IF3,IF4,IF5,IF6样品中检测到相对含量较低的大肠杆菌,其相对含量分别为0.06%,0.01%,0.15%和0.05%。
2.2.3 基于OTU水平上婴幼儿配方奶粉中主要污染细菌组成分析 由于α多样性分析是基于OTU水平的,因此本研究进一步在OTU水平上对婴幼儿配方奶粉中主要污染细菌组成进行了分析,OTU在6份样品中出现次数的统计如图4所示。
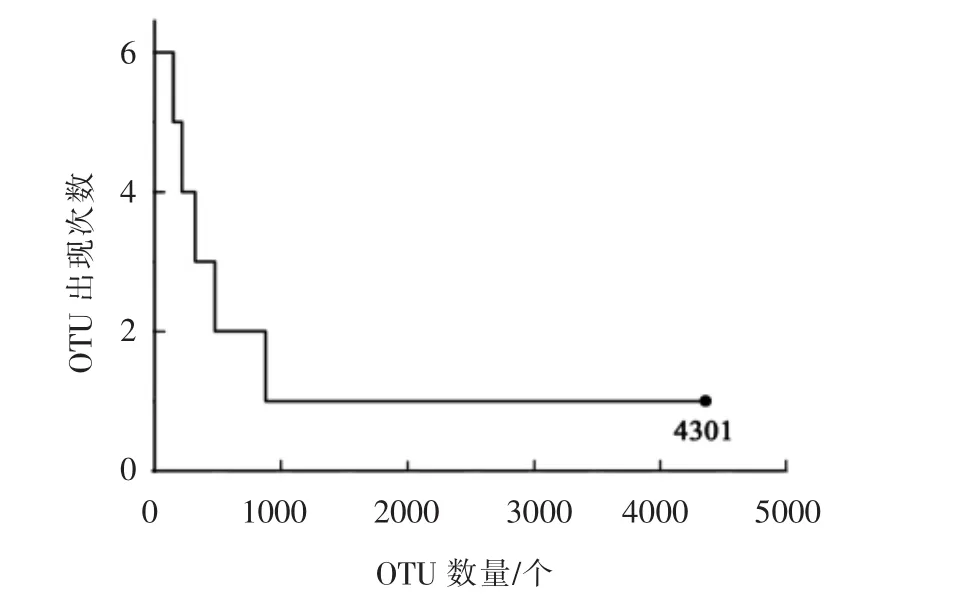
图4 婴幼儿配方奶粉样品中OTU出现次数的统计Fig.4 Frequency of occurences of OTU in the infant formula samples
由图4可知,本研究的6份婴幼儿配方奶粉样品共产生4 301个OTU,其中仅出现1次的OTU有3 243个,占OTU总数的75.40%,然而其所包含的序列数仅为3 572条,仅占所有质控后合格序列数的10.39%。而在6个样品中均存在的OTU为148个,所包含的序列数为25 752条,分别占OTU总数和质控合格序列数的3.43%和74.88%。由此可见,虽然某些样品特有一些种系型,但纳入本研究的6份婴幼儿配方奶粉样品有大量的核心细菌菌群。本研究进一步对不同样品中核心OTU的相对含量进行了分析,其结果如图5所示。
由图5可知,婴幼儿配方奶粉样品中的核心OTU主要由隶属于芽孢杆菌属、乳球菌属、假单胞菌属和链球菌属的部分菌种构成。其中核心OTU中数量最多的两个菌种分别为蜡样芽孢杆菌和弯曲芽孢杆菌,这一结果与种水平上细菌相对含量的分析结果一致。此外,嗜热链球菌、乳酸乳球菌和鱼乳球菌核心OTU的相对含量也较高,就婴幼儿配方奶粉的主要污染菌种而言,嗜热链球菌、乳酸乳球菌和鱼乳球菌均属于无致病性的乳酸菌。本研究进一步对婴幼儿配方奶粉样品间核心菌群的相关性进行了分析,其结果如图6所示。

图5 婴幼儿配方奶粉样品核心OTU的相对含量Fig.5 The relative abundance of core OTU in infant formula samples
2.3 基于ddPCR技术对婴幼儿配方奶粉中蜡样芽孢杆菌和大肠杆菌的定量分析
通过PacBio SMRT测序发现,6份婴幼儿配方奶粉样品中均存在过潜在致病菌蜡样芽孢杆菌,其中 IF3、IF4、IF5、IF6 样品中还存在过大肠杆菌。由于通过SMRT测序技术仅能获得细菌的相对含量,因此为进一步研究这两种菌在婴幼儿配方奶粉中的绝对含量,本研究采用ddPCR技术对蜡样芽孢杆菌和大肠杆菌分别做绝对定量分析,结果如图7所示。
由图6可知,鱼乳球菌与嗜热链球菌和乳酸乳球菌均呈显著正相关(P<0.05),其相关系数分别为0.829和0.886。
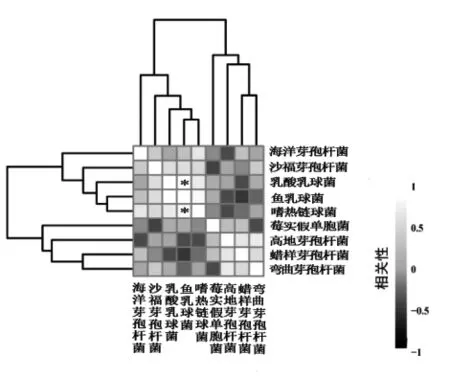
图6 婴幼儿配方奶粉样品间核心菌群的相关性Fig.6 The correlation of core bacterial community among infant formula samples
由图7可知,6份婴幼儿配方奶粉样品中均存在过蜡样芽孢杆菌和大肠杆菌,且蜡样芽孢杆菌的绝对含量高于大肠杆菌。其中每克奶粉样品中蜡样芽孢杆菌的16S rRNA基因拷贝数取对数后分别为5.32,6.02,5.05,5.76,5.05和5.48,大肠杆菌的16S rRNA基因拷贝数取对数后分别为5.38,4.90,4.32,4.85,5.18和4.68。
3 讨论
本研究首先采用细菌纯培养方法,对6份婴
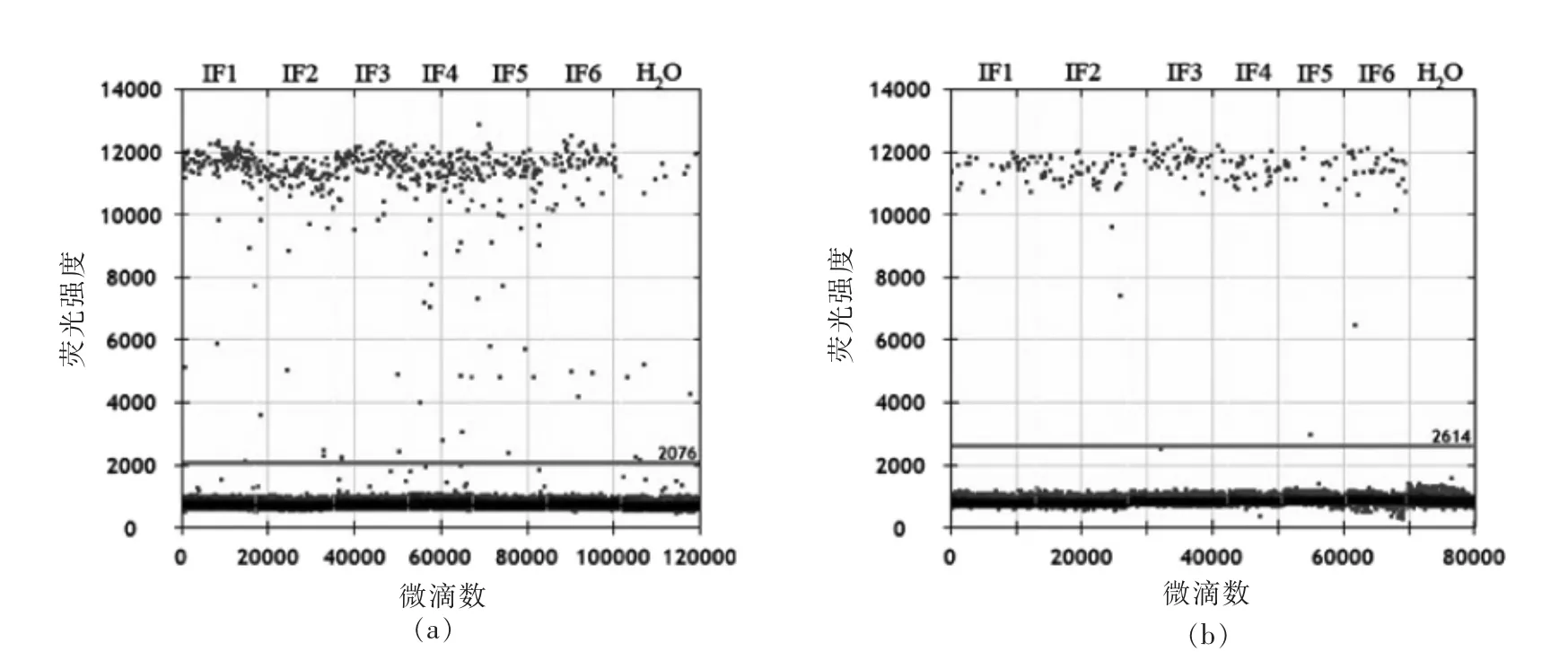
图7 蜡样芽孢杆菌(a)和大肠杆菌(b)定量结果Fig.7 Quantitative results of Bacillus cereus(a)and Escherichia coli(b)
幼儿配方奶粉中的大肠菌群、沙门氏菌、金黄色葡萄球菌、阪崎肠杆菌和芽孢进行检测,结果均呈阴性。采用PacBio SMRT测序技术在种水平上分析婴幼儿配方奶粉中的污染微生物菌群结构,进一步评价产品的微生物质量。在种水平上,纳入本研究的6份婴幼儿配方奶粉共检测到255个细菌种,其中6份样品中均存在过嗜冷菌蜡样芽孢杆菌,其相对含量最高达到了菌群总量的23.54%。而Zheng等[23]对国内外婴幼儿配方奶粉的研究发现乳酸乳球菌和嗜热链球菌为最优势菌种,蜡样芽孢杆菌的相对含量较低,与本研究结果不符。Zhila等[24]研究发现,在干酪的生产过程中,蜡样芽孢杆菌主要来源于原料乳,并易残留在贮藏罐和设备中。因此究其原因本研究婴幼儿配方奶粉中含量较高的蜡样芽孢杆菌极有可能来源于原料乳,或者乳粉加工设备所造成的二次污染。即使蜡样芽孢杆菌在乳粉加工过程中已被灭活,但其产生的耐热胞外蛋白酶,如脂肪酶和蛋白酶的残留仍可在随后的乳粉贮藏过程中继续分解其中的蛋白质和脂肪,进而引起产品乳清分离、变色、凝固和发粘等变质现象,从而直接影响产品的口感、营养以及货架期[5,25]。此外,样品中还存在蜡样芽孢杆菌之外的嗜冷菌莓实假单胞菌,莓实假单胞菌是原料乳及其乳制品中常见的污染菌,容易在热处理过程中被杀死,然而其在产品冷藏过程中产生的耐热肽酶仍具有活性,能够缩短产品货架期[26]。通过细菌菌落总数的检测并不能完全反应产品的微生物污染程度,因为部分嗜冷菌的污染很难通过传统的细菌纯培养检出。因此,采用PacBio SMRT测序技术对婴幼儿配方奶粉中嗜冷菌的检测具有极高的可行性。
采用SMRT测序技术,本研究仅发现IF3、IF4、IF5、IF6样品中存在相对含量较低的大肠杆菌。然而,采用ddPCR对大肠杆菌进行绝对定量检测,发现6份样品中均存在大肠杆菌的16S rRNA基因。造成两种检测结果不同的原因可能在于IF1和IF2样品中大肠杆菌的相对含量太低,仅通过SMRT测序技术无法检出。虽然上述两种技术均检测出大肠杆菌,但是纯培养并未检出,因此推测大肠杆菌曾经存在于原料乳,或是原料乳的加工过程中,并在随后的加热过程中被灭活。然而大肠杆菌属于革兰氏阴性菌,其在死亡裂解时可释放出大量富含脂多糖的细菌内毒素。脂多糖具有很强的热稳定性和化学稳定性,不易失活,能引起肝脏组织产生大量炎症因子和活性氧,从而引发肝损伤和炎症反应[6],过量时还可引起败血性休克和多器官功能衰竭综合征[7],这些污染微生物短期的存在也能够影响产品品质。因此采用基于非培养技术的PacBio SMRT测序和ddPCR定量相结合的技术手段对婴幼儿配方奶粉中污染微生物进行研究是极为必要的。
此外,值得注意的是,在纳入本研究的6份婴幼儿配方奶粉中,IF4样品的污染微生物菌群多样性最低,而其在属和种水平上优势菌群的相对含量最高。这可能是由于样品中的少数微生物过度繁殖导致其相对含量增高,预示着样品的污染情况较为严重。此现象在肠道菌群结构的研究中也有报道,Mcmurtry等[27]在对新生儿坏死性小肠结肠炎的研究中指出,粪便样品中的微生物多样性越低,可能预示着新生儿坏死性小肠结肠炎较为严重。因此,本研究的6份婴幼儿配方奶粉中IF4样品的微生物污染情况可能更加严重。
4 结论
本研究的6份婴幼儿配方奶粉均未检出致病菌,符合食品安全国家标准。然而,其存在过的蜡样芽孢杆菌和大肠杆菌可能增加产品腐败的风险,影响产品的货架期。本研究采用细菌纯培养、PacBio SMRT测序和ddPCR相结合的技术手段全面评价了婴幼儿配方奶粉的微生物污染情况,初步建立了婴幼儿配方奶粉中污染微生物检测技术,为婴幼儿配方奶粉的污染微生物安全控制提供新的理论指导。

