链霉菌L10608来源木聚糖酶xyn-GH10/11基因的克隆与生物信息分析
熊 科 熊苏玥 柳佳芸 高思宇 邓 蕾 裴鹏钢
(1 北京工商大学 北京市食品添加剂工程技术研究中心 北京 100048
2 北京工商大学 北京市质量与安全重点实验室 北京 100048
3 北京工商大学 北京市风味化学重点实验室 北京 100048
4 北京工商大学 北京食品营养与人类健康高精尖创新中心 北京 100048)
木聚糖作为植物半纤维素的重要组分,是自然界中除纤维素以外含量最丰富的可再生生物质资源[1]。这些农业废弃物资源再生利用率极低,大部分被浪费。大力开发利用这些资源可以缓解环境、资源和粮食危机。此农业废弃物再利用成为近十几年各国研究的热点。在众多应用中,以木聚糖制备有较高附加值的功能低聚糖,是富含半纤维素材料的农业废弃物再生利用的有效增值途径,具有巨大的潜在经济效益和环保意义[2-4]。低聚木糖作为一种益生元,是近几年引起广泛关注并逐步发展起来的功能性低聚糖。低聚木糖具有降低癌症风险,抗龋齿,降血压,降低血清胆固醇,抑制病原菌和腹泻润肠通便等作用,可应用于酸奶、焙烤食品、功能性食品等[5]。低聚木糖中的主要有效成分为木二糖与木三糖。而目前酶法生产采用的微生物来源的木聚糖酶水解木聚糖时,除了菌株本身产酶活力低下外,水解产物中木二糖、木三糖等特异性成分含量大多低于30%,且含大量木糖、阿拉伯糖等单糖和其它非功能性成分,后期需要较复杂的工艺和高额的成本来进行提纯,以提高功能低聚木糖纯度(60%~70%)[6]。只有极少数菌株具有底物水解高酶活力,且水解底物时产物中木二糖、木三糖比例超过50%[7]。酶法制取低聚木糖的过程中提高催化过程中木二糖、木三糖特异功效成分,消除和减少产生木糖,避免低聚木糖进一步转变为木糖是亟待解决的一关键问题。而木聚糖酶来源主要依靠真菌、细菌等微生物的发酵产生,低聚木糖的工业生产中采用链霉菌属来源的木聚糖酶已实现初步的应用[8],具有一定的安全性与应用潜力。通过基因工程手段对链霉菌属来源的木聚糖酶蛋白进行改造,以提高其水解产物中功能低聚木糖的产量,降低酶法生产成本,减少后期纯化过程中的能耗、污水排放等,降低环境污染,实现高效利用低值农业废弃物生产高附加值低聚木糖的大规模工业化生产,具有良好的应用前景。
本研究以实验室先前从全国各地300余份土壤样品中筛选得到的水解产物中木二糖与木糖产量较高的菌株L10608为目标菌株,通过高效液相色谱法检测其木糖:木二糖:木三糖的产物比例约为4∶5∶2。该菌株发酵液在酶谱中显示具有两种分子质量的木聚糖酶,在高产木二糖的同时,木糖的产量也在一定程度上限制了其在低聚木糖生产工业中应用。研究拟先通过巢式PCR[9]获得L10608中木聚糖酶基因的全长,并对该木聚糖酶基因进行序列分析。为进一步阐明木聚糖酶结构与水解产物的联系,提高酶蛋白的水解产物中功能低聚木糖等提供基础数据。研究同时对获得的两段木聚糖酶基因GH-xyn10/11进行原核表达验证其酶活力,构建木聚糖酶GH-xyn10/11的原核大肠杆菌(E.coli)BL21(DE3)表达系统,奠定对该基因后续进行更深层次研究的基础。
1 材料与方法
1.1 材料与试剂
菌株L10608为实验室所筛选保藏(CGMCC NO.13271),酶学性质优良,且产物中低聚木糖含量较高,具有潜在的改造应用价值。克隆载体pMD18-T、表达载体pET28-a,日本TaKaRa公司;大肠杆菌(Escherichia coli)DH5α、E.coli BL21(DE3),天根生化科技有限公司。真菌DNA提取试剂盒、胶回收试剂盒,美国OMEGA公司;BCA蛋白浓度测定试剂盒,中国Solarbio公司;琼脂糖,西班牙Biowest;其余试剂均为国产分析纯级。序列测定由华大基因完成。
1.2 仪器与设备
PCR仪,德国Biometra公司;凝胶成像仪ImageQuant300、MultitempIII恒温循环水浴器,美国GE公司;琼脂糖凝胶电泳仪,北京六一;DHZ-DA全温振荡器,江苏太仓培英;Sigma1-14小型台式离心机,美国Sigma公司;HR60-IIA2生物安全柜,青岛海尔特种电器有限公司;恒温培养箱,上海STIK公司;DHZ-DA大容量全温振荡器,江苏太仓实验设备厂;立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂。
1.3 培养基
LB 培养基:酵母粉 5 g/L,NaCl 10 g/L,胰蛋白胨10 g/L,pH 7.0;LB固体培养基需加入琼脂粉20 g/L。
1.4 试验方法
1.4.1 基因组DNA的提取及编码基因保守序列扩增 将菌株L10608接种于LB液体培养基中,37℃,180 r/min培养24 h,吸取菌液1.5 mL置于2 mL离心管中10 000×g室温离心5 min,得到菌体。参考OMEGA基因组提取试剂盒说明书提取细菌基因组。取5 μL混合6*loading buffer上样,进行1%质量分数琼脂糖凝胶电泳。
根据GenBank中已经发表的青霉及曲霉所产GH11/10族木聚糖酶基因序列,在Block Maker网站设计简并引物,引物设计采用primer5.0,引物设计如表1所示。
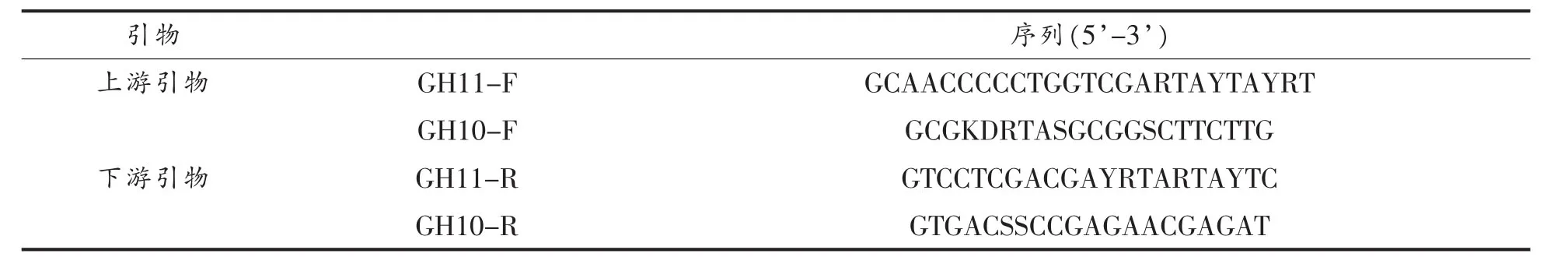
表1 简并引物序列Table1 Primers for xyn-core
以所提取的DNA为模板,进行PCR扩增获得木聚糖酶基因的保守序列;通过基因组步移巢式PCR的方法获得木聚糖酶基因的侧翼,巢式PCR程序参考文献[10]。采用两轮PCR扩增,第2轮扩增以第1轮扩增的PCR产物稀释40倍为模板,将所得保守序列以及侧翼序列运用DNAMAN软件进行拼接得到木聚糖酶基因的全长。引物设计采用primer5.0,引物设计如表2所示。第1轮PCR扩增选用Q5超保真DNA聚合酶,以基因组DNA进行PCR扩增(98℃ 30 s;98℃ 8 s;59℃25 s;72 ℃ 20 s;循环 30 次;72 ℃ 2 min),扩增反应体系参照Q5超保真DNA聚合酶说明书标准体系;第2轮将第1轮的PCR产物胶回收作为模板,选用LA taq酶进行PCR扩增(95℃ 3 min;95℃ 30 s;59 ℃ 30 s;72 ℃ 45 s;循环 30 次;72 ℃10 min)。

表2 扩增木聚糖酶基因xyn A保守序列以及侧翼序列引物设计Table2 Primers for xyn A conserved sequence and flanking sequence
1.4.2 木聚糖酶基因cDNA的扩增对拼接好的含木聚糖酶基因开放读码框(ORF)的一段序列进行分析,根据该基因编码的蛋白质分子质量,确定ORF的起始密码子(ATG)和终止密码子(TGA,TAA,TAG),即得到木聚糖酶基因xyn-GH10与xyn-GH11。在NCBI网站上对基因序列进行BLAST比对,并设计带有酶切位点的引物(表3),以扩增木聚糖酶基因片段。
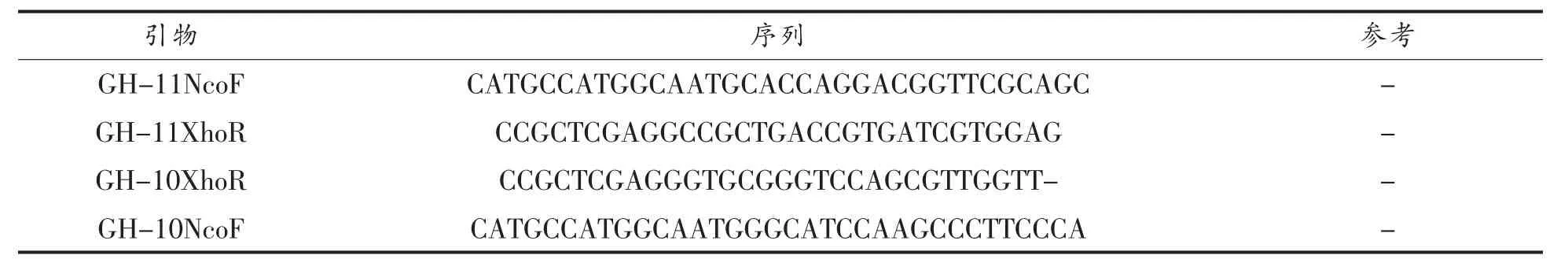
表3 扩增全长序列带酶切位点的引物Table3 Amplification full-length sequence primers with enzyme
按照设计好的全长引物进行常规PCR得到全长序列,将PCR产物经过1%的琼脂糖凝胶电泳检测。胶回收产物与pMD18-T克隆载体在16℃保温3 h进行连接,42℃,60 s热激导入E.coli DH5α 感受态细胞,涂布于含有 IPTG、X-gal、Amp的LB平板,37℃培养过夜,通过蓝白斑筛选,挑取阳性克隆子,送至北京华大基因研究中心测序确认。
1.4.3 木聚糖酶基因序列分析 基因序列分析主要由理化性质、二级结构和三级结构3个部分分析组成。理化性质包括蛋白质理化性质的分析网站:http://web.expasy.org/protparam/;蛋白质的疏水性质分析网站:http://web.expasy.org/protscale/;跨膜区域的预测网站:http://www.cbs.dtu.dk/services/TMHMM/;结构域的预测网站:http://smart.emblheidelberg.de/与 http://blast.ncbi.nlm.nih.gov/;蛋白质结构域中催化位点的预测网站:http://prosite.expasy.org/;蛋白质二级结构的分析网站:http://bioinf.cs.ucl.ac.uk/psipred/和http://www.compbio.dundee.ac.uk/jpred/;蛋白质的三级结构预测网站http://swissmodel.expasy.org/interactive和三级结构的比对http://www.rcsb.org/pdb/secondary.do?p=v2/secondary/search.jsp#search_sequences。
1.4.4 重组质粒pET28a-xyn-GH10/11连接与转化 获得目的基因xyn-GH10/11后,用NcoRⅠ和XhoⅠ同时对表达载体pET28a和带有酶切位点的xyn-GH10/11进行双酶切,37℃反应3 h。酶切过后通过1%质量分数琼脂糖凝胶电泳检测,并切胶回收带有粘性末端的xyn-GH10/11和线性化pET28a。
用T4DNA连接酶将回收的带有粘性末端的xyn-GH10/11和线性pET28a按摩尔比1~7,置于反应体系中连接,25℃中反应1 h,从而构建重组质粒pET28a-xyn-GH10/11。
将10 μL连接体系以体积比1∶5的关系加入到刚融化的BL21(DE3)感受态细胞中,轻柔地混匀,冰浴30 min,42℃热击60 s,随即静置于冰上2 min。并将其混合物转移到装有1 mL预热至37℃的SOC培养基中,37℃,175 r/min振荡1 h使菌体复苏。将上述菌液在无菌条件下涂布至LB抗性筛选平板,37℃倒置培养,直至菌落长出。
1.4.5 重组蛋白表达及酶活力测定 挑取验证成功的转化子对其进行IPTG诱导表达[11]。(1)菌种活化:将转化子接种于5 mL LB液体培养基,37℃,200 r/min过夜培养。(2)扩大培养:以2%的接种量,将活化菌液转接至100 mL的LB液体培养基(含 40 μg/mL 卡纳霉素)中,37℃,180 r/min 培养至OD600在0.6~0.8之间。(3)诱导产酶:在无菌条件下,添加IPTG至终浓度为0.5 mmol/L,16℃,200 r/min振荡培养16 h,诱导产酶。(4)超声破壁获得粗酶液:4℃下,8 000×g离心 5 min,弃上清收集菌体,用0.02 mol/L,pH 5.5醋酸缓冲液重悬菌体。对重悬液超声破壁,离心后保留上清即获得粗酶液。木聚糖酶活力的测定参照DNS法[12]。
2 结果与分析
2.1 木聚糖酶基因xynA保守序列以及侧翼序列扩增
电泳如图1a,其中泳道1,2,3为xyn10族核心片段,大小接近200 bp左右的条带,泳道4,5,6大小为250 bp左右的条带xyn11族的核心片段,切胶回收,连接T载体pMD18-T进行测序,分别得到一段大小为176 bp与239 bp的序列,即为10族和11族的核心序列xyn-Core。
依据基因组步移巢式PCR的方法对11族片段3’端与5’端以LAD1-4为引物进行侧翼序列的扩增。经二次扩增后得到了1 500 bp和2 000 bp大小的两条亮带,切胶回收,连T克隆载体测序。分别得到L10608-xyn11的3’端与5’端侧翼序列片段。依照方法1.4.1节中10族核心片段进行扩增时,经第1轮扩增后,以LAD1-3为引物扩增时在750 bp左右均出较为单一且特异性较好的条带,可直接切胶回收连T克隆载体测序得到5’端侧翼序列。同时以LAD-4为引物时在750 bp与1 500 bp处均出现较为单一的条带,为避免侧翼步移长度不足,将1 500 bp处条带切胶回收连T克隆载体测序得到3’端侧翼序列。
将连接PMD18-T的送出测序后得到的基因序列进行对接,特异性设计引物是基于核心片段的两侧所设计的,因此得到的侧翼片段与核心有部分重叠,使用DNAMAN对两个片段重叠一致部分进行拼接,在基因组步移距离足够的情况下,得到基因的全长。
2.2 木聚糖酶基因序列全长及cDNA序列的获得
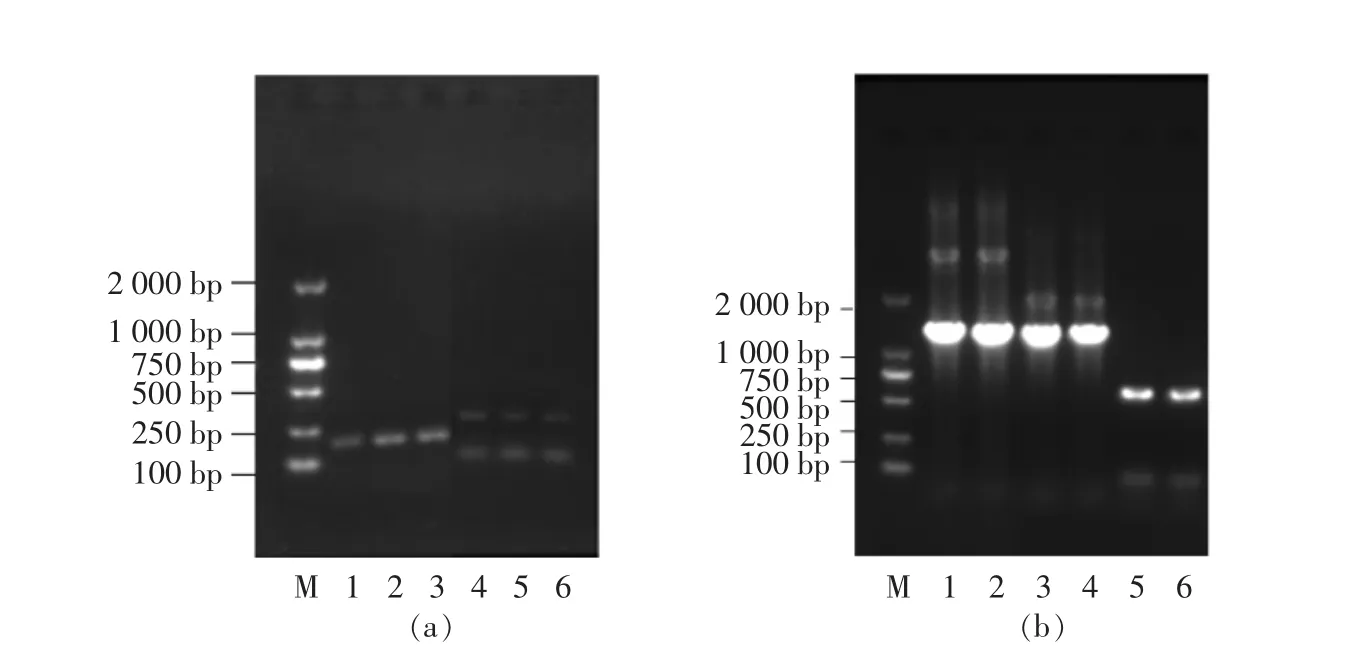
图1 核酸电泳图Fig.1 Nucleic acid electrophoresis
拼接核心序列和侧翼序列得到基因全长xyn-GH10/11。经NCBI比对可以确定分别得到以ATG为起始密码子,TGA为终止密码子的木聚糖酶10族与11族基因。得到两段基因全长为之后进行序列的生物信息学分析及水解产物研究提供了材料。采用带有酶切位点的引物进行PCR扩增全长片段,结果如图1b所示,1~4泳道为xyn10族基因在1 500 bp处有明显的目的基因条带,5、6泳道为xyn11族基因在700 bp左右处有明显的目的基因条带。分别切胶回收连接T载体测序,测序结果表明未发生突变。可将所得连接木聚糖酶10族与11族基因的PMD18-T质粒用于后续研究。基因的全序列经测序后如图2a、图2b所示,找到完整的开放阅读框,10族木聚糖酶基因全长1 462 bp,11族木聚糖酶基因全长729 bp。经测序可得xyn-GH10/11序列如图2所示。


图2 基因序列全长Fig.2 Full length of gene sequence
2.3 木聚糖酶基因的序列分析
xyn-GH11蛋白序列中包含242氨基酸;预测氨基酸分子质量:24.003 ku;理论pI等电点:8.98;氨基酸组成中最多为Gly(G)有42个占17.4%;带负电的氨基酸残基数目(Asp+Glu)为13个;带正电的氨基酸数目(Arg+Lys)为17个;预测分子式:C1142H1685N323O363S8;蛋白质不稳定系数:25.92,低于阈值40,因此判断为稳定蛋白;图3a为各个位点的亲疏水系数,平均亲水系数:-0.5369可判断为亲水蛋白。由xyn-GH10的预测结果可知,xyn-GH10蛋白序列包含476个氨基酸;预测氨基酸分子质量:50.677 ku;理论 pI等电点:6.98;氨基酸组成中Ala(A)有57个占12.0%最多;带负电的氨基酸残基数目(Asp+Glu)为41个;带正电的氨基酸数目(Arg+Lys)为41个;预测分子式:C2188H3399N653O705S17;蛋白质不稳定系数:27.33,低于阈值40,因此判断为稳定蛋白;图3b为各个位点的亲疏水系数,平均亲水系数:-0.365可判断为亲水蛋白。
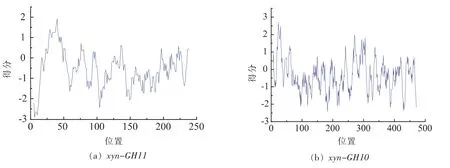
图3 氨基酸亲疏水性分析Fig.3 Hydrophilic-hydrophobic property analysis of amino acid
如图4a可见xyn-GH11酶蛋白唯一可能存在的跨膜区域位22-48处于信号肽部分。信号肽预测为“MHQDGSQQDRTQNPAPFGGLSRRGFLV GAGTGAAALAAGSGLLLPGTAHA”1-50 位 氨 基酸。而xyn-GH10蛋白很可能不存在任何跨膜蛋白如图4b。经信号肽预测可知其含有一段1-41位氨基酸“MGIQALPRAAVRQKLRTPLPALAAGVL GLTAALVPPTNADA”的信号肽序列。
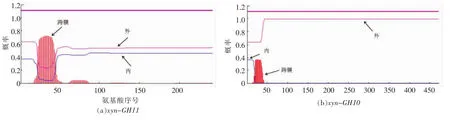
图4 跨膜蛋白预测分析Fig.4 Analysis of transmembrane protein
蛋白序列的二级结构分析如图5a所示,xyn-GH11蛋白质序列共含2个α螺旋,有一个在信号肽中,有14个β片层。如图5b所示,xynGH10蛋白质序列共含12个α螺旋,有一个在信号肽中,有15个β片层。
如图6中NCBI的结构域预测显示:氨基酸第61位到第239为Glyco_hydro11结构域,e-value为3.2e-73,小于10-6,证明其结构预测可靠。无其它有效的结构域。经NCBI与Streptomyces sp.JHA19 11家族木聚糖酶(NCBI accession number:WP_055619964)序列相似度为100%,可以确定其为木聚糖酶11家族基因序列。
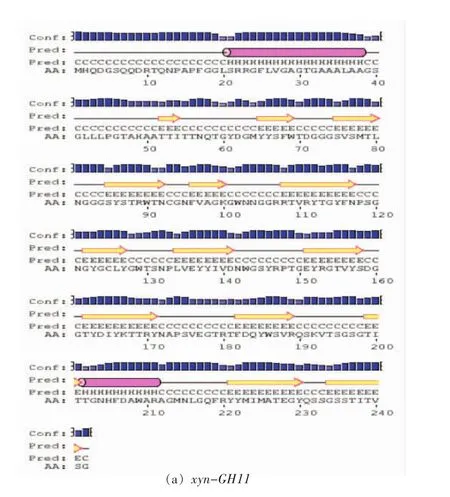

图5 酶蛋白二级结构预测Fig.5 Prediction of enzyme protein secondary structure

图6 xyn-GH11预测的结构域Fig.6 Structural domain prediction of xyn-GH11
如图6b所见,该序列分析具有:功能区域双精氨酸易位信号(双精氨酸易位(TAT)途径提供跨越传感能量膜输送折叠的蛋白质,该区域属于信号肽部分);以及功能区域GH11_3糖苷水解酶家族 11(GH11)域:56-241 与图6a的NCBI预测接近;预测催化位点(在图中为红点表示)136位谷氨酸为亲核体228位谷氨酸为质子供体。
如图7a在NCBI的结构域预测显示:氨基酸第46位到第338为Glyco_hydro10结构域,e-value为4.5e-69,小于10-6,证明其结构预测可靠。366-472为RICIN_B_lectin结构域,预测该结构域有纤维素酶活性。基因序列与 Streptomyces sp.JHA19 10家族基因木聚糖酶(GenBank accession number:WP_055619031)相似度为100%,可确定其为10家族木聚糖酶基因序列。
如图7b所见,该序列分析具有:功能区域GH10_2为40-340位,与NCBI预测结果相近;以及功能区域RicinB-typelectin篦麻毒素结构域在362-476位与图7a的NCBI同样预测接近,同时其中包含三对二硫键 365-384,407-424,448-465;预测催化位点(在图中为红点表示)277位谷氨酸为亲核体169位谷氨酸为质子供体。
蛋白序列的三级结构的分析使用建模网站SWISS-MODEL对已知序列建立模型,如表4中所示RMSD<2.0Å,在规定的范围内是可靠的。且从图8a和图8b中可以看出重合度较高,xyn-GH11相似度为84.4%,xyn-GH10相似度为72.6%,均高于40%,属于可信的模板。
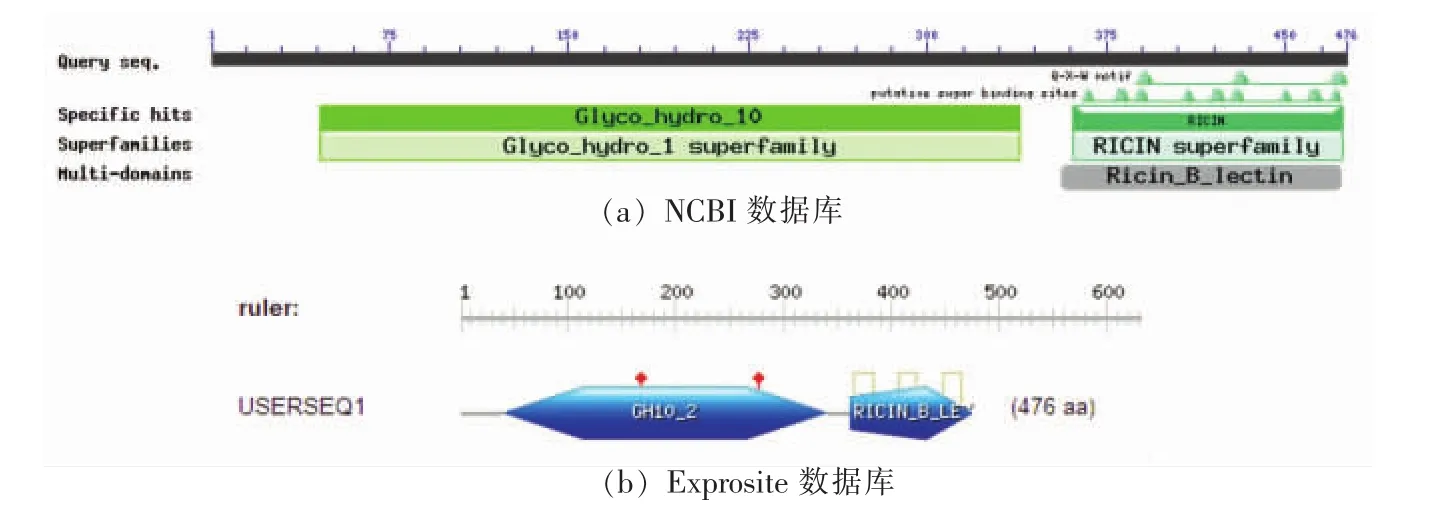
图7 xyn-GH10预测的结构域Fig.7 Structural domain prediction of xyn-GH10

表4 GH10/11序列建模RMSD预测Table4 GH10/11 sequence modeling RMSD prediction
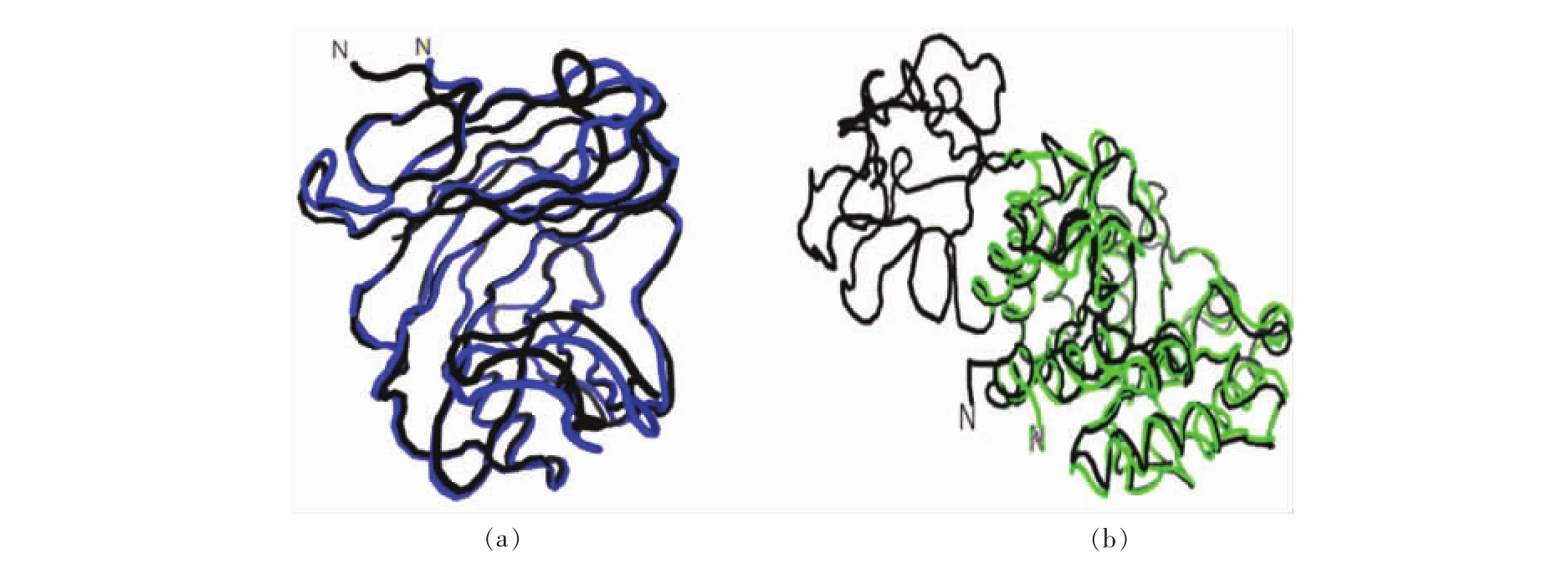
图8 酶蛋白序列的三级结构的分析(a)xyn-GH11经SWISS-MODEL建模与其模板1hix的比对;(b)xyn-GH10经SWISS-MODEL建模与其模板1XYF比对(模板不包括RicinB-lectin结构域)Fig.8 Analysis of tertiary structure of enzyme protein(a)xyn-GH11 by SWISS-MODEL modeling and its template 1hix comparison;(b)xyn-GH10 by SWISS-MODEL modeling and its template 1XYF comparison(without RicinB-lectin structure)
2.4 重组质粒的构建及验证
采用T4DNA连接酶将经过双酶切的xynAGH10/11和pET28a进行连接,并得到重组质粒。按方法3.3.2节中构建重组质粒pET28a-xyn的构建,NcoRⅠ和XhoⅠ将外源片段导入pET28a中,并利用Kan抗生素进行筛选。
将随机挑选的转化子进行菌落PCR,采用T7与T7ter做为引物时,会在目的片段两端加约150 bp左右的PET28A质粒的片段,如图8a与图8b中可以看到749 bp的xyn-GH11加上质粒的部分在接近1 000 bp的位置出现了明亮的条带,1 462 bp的xyn-GH10加上质粒的部分在接近2 000 bp的位置出现了明亮的条带,用LB培养基培养20 h后送出菌液测序,均与得到的基因序列一致。
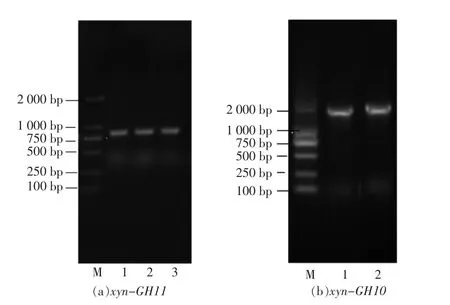
图9 克隆子验证PCR电泳图Fig.9 Clone of xyn-GH11 and xyn-GH10 was verified by PCR
2.5 重组蛋白IPTG诱导表达
按照1.4.5节中DNS法测定酶活。如表5可见信号肽对表达酶活影响较大,10族与11族木聚糖酶未剪切信号肽的重组酶酶活均高于剪切信号肽重组酶酶活。可能由于信号肽部分位于木聚糖酶基因的N端,N端的改变对木聚糖酶酶活有一定影响,李琴等[13]分别对通过N端延伸与定点突变结合的技术手段,构造了3个突变体SrxynF,SrxynM与SrxynFM酶活分别上升了 2.1倍,3.2倍和5.3倍,与此同时,其水解产物中具有益生元作用的低聚木糖含量上升,木糖含量下降。Zheng等[14]研究的N端改造体xyn△NC4在以榉木木聚糖、桦木木聚糖和燕麦木聚糖为底物时,酶活分别上升了1.78倍,2.23倍和1.4倍。Cheng等[15]对来自Neocallinmastix patriciarum的木聚糖酶切除了N端的11个氨基酸后,酶活力在55℃与75℃时的的残余酶活分别为61.5%与19.5%。

表5 重组蛋白的酶活测定Table5 Determination of enzyme activity of recombinant proteins
3 结论
随着低聚木糖在诸多领域的广泛应用,采用木聚糖酶酶解生产低聚木糖的生产方式相较物理化学等其它方式体现出环保、高效的优势[16]。然而通过筛选的天然产木聚糖酶菌株来生产低聚木糖的模式存在天然酶产量低,催化效率低,产酶不稳定等问题。因此实现木聚糖酶的实际工业应用逐渐成为人们研究的焦点[17]。随着生物技术的不断发展,利用基因工程改造菌株特性,构建工程菌株的方法成为解决这些问题的有效手段[18]。常用的基因工程手段如通过定点突变木聚糖酶序列中的氨基酸,除了影响酶自身的性质还会改变与底物的结合能力,当改变结合方式时,水解产物的种类或所占比例会受影响。
研究根据GenBank上已发表的来源于链霉菌属的两个不同家族木聚糖酶基因序列,通过巢式PCR方法从克隆出Streptomyces.sp L10608的两段编码木聚糖酶基因序列xyn-GH10和xyn-GH11。xyn-GH10蛋白序列包含476个氨基酸,12个α螺旋,15个β片层。预测氨基酸分子质量:50.677 ku;理论等电点 pI:6.98;经信号肽预测可知其含有一段1-41位氨基酸 “MGIQALPRAAVRQKL RTPLPALAAGVLGLTAALVPPTNADA”的信 号 肽序列;除催化域结构外,第366-472位为RICINB-lectin结构域,该非催化结构域有纤维素酶活性。277位谷氨酸为亲核体169位谷氨酸为质子供体。xyn-GH11蛋白序列中包含242氨基酸,共含2个α螺旋,有一个在信号肽中,有14个β片层;预测氨基酸分子质量:24.003 ku;理论等电点pI:8.98;信号肽预测为“MHQDGSQQDRTQNPAPFG GLSRRGFLVGAGTGAAALAAGSGLLLPGTAHA”的1-50位氨基酸;预测催化位点为136位谷氨酸为亲核体228位谷氨酸为质子供体。
研究在对Streptomyces.sp L10608来源的木聚糖酶基因xyn-GH10/11进行分子克隆的基础上,采用分子生物学手段分析其酶结构,通过原核表达的方式得到了具有生物活性的酶蛋白,并对其是否带信号肽基因序列进行表达,发现保留信号肽的重组酶表达酶活更高,研究为后续深入研究不同家族的木聚糖酶的水解特性,以及针对基因序列的改造等基因工程研究提供了基础材料及理论依据。

