螺旋藻多糖对酪氨酸酶的抑制作用及抗氧化性能
丁小梅 何善生 王 力 李 健 李桂玲
(集美大学食品与生物工程学院 福建厦门 361021)
螺旋藻多糖(Polysaccharide from S.platensis,PSP)是一种具有多种生物活性的水溶性功能性生物大分子[1],其分子结构较复杂,主要是由D-葡萄糖、D-半乳糖及葡萄糖醛酸等通过糖苷键连接而成[2-3]。研究发现,螺旋藻多糖在抗肿瘤[4-5],抗氧化[6-7],抗病毒活性[8],免疫机能的调节[9-10],血糖调节[11],抗疲劳[12],抗衰老[13]等方面发挥着重要作用。积极开展螺旋藻多糖的深入研究,必能在食品添加剂、功能性药品、保健品等领域的研究与开发方面提供极大助力[14]。
酪氨酸酶(EC1.14.18.1,TYR)是一种活性中心含有Cu2+的多功能氧化酶[15],同时也是反映黑色素生物合成中限速效应的关键酶[16]。酪氨酸酶可通过两步催化使L-酪氨酸转化为多巴醌,这是果蔬褐变的重要原因[17]。开发安全、高效的酪氨酸酶抑制剂对抑制果蔬褐变[18]和食品保鲜[19]等方面具有重要意义。螺旋藻多糖作为一种无毒、高效,具有多种生物活性的功能性生物大分子[1],具有重要的研究价值。本文在酶动力学试验的基础上,以螺旋藻多糖为效应物(抑制剂),探究其对酪氨酸酶活力的抑制作用,希望能为以螺旋藻多糖为主要活性组成的新型食品保鲜剂的研究、开发与应用提供一定数据基础和理论依据[20]。
螺旋藻多糖分子中含有大量的糖醛酸、酚羟基等基团[21-22],具有抗氧化,清除自由基的活性[2],可有效延缓食品氧化过程,防止食品氧化变质[20]。本文以试验所得螺旋藻多糖为主要试剂,通过DPPH自由基清除法,对其自由基清除能力进行验证,以期为其在抗氧化剂、食品保鲜等方面的应用研究提供更为客观、综合的理论依据。
1 材料与方法
1.1 主要试剂
螺旋藻干粉,福建省神六保健食品有限公司;无水乙醇、三氯乙酸、丙酮、L-抗坏血酸、硫酸、二甲基亚砜(DMSO)、NaH2PO4、Na2HPO4,西陇化工股份有限公司;NaOH,上海化学试剂总厂;L-多巴、蘑菇酪氨酸酶,上海西格玛有限公司;蒽酮、盐酸,国药集团化学试剂有限公司;DPPH、葡萄糖,上海麦克林生化科技有限公司。
1.2 主要仪器及设备
Nicolet Avatar 330型傅里叶变换红外光谱仪,美国Thermo Electron公司;Cintra 2020型紫外可见分光光度计,澳大利亚GBC仪器公司;3-30KS高速冷冻离心机,德国Sigma公司。
1.3 试验方法
1.3.1 绘制葡萄糖标准曲线(硫酸-蒽酮法[23-24]) 配制质量浓度为0.113 mg/mL的葡萄糖标准溶液,分别取不同体积的该葡萄糖标准溶液,蒸馏水定容至10 mL,配制成一系列浓度梯度的葡萄糖标准溶液,摇匀,再各取1 mL上述葡萄标准溶液于具塞试管中,同时取1 mL蒸馏水作空白对照,冰浴5 min。再加入4 mL 0.2%硫酸-蒽酮溶液,摇匀后沸水浴15 min,随后冷却至室温,静置10 min,测定其在620 nm波长处的吸光度值。以吸光度值(A)为纵坐标,葡萄糖标准品的浓度(C)为横坐标,得到二者之间的标准关系曲线,用于计算螺旋藻多糖提取物中的多糖含量。
1.3.2 螺旋藻多糖提取工艺的优化研究
1.3.2.1 螺旋藻多糖的提取与纯化[25]取一定质量的螺旋藻干粉,在95%乙醇中浸泡过夜,离心后取沉淀,37℃烘干;加入适量蒸馏水,用1 mol/L NaOH溶液调pH值为10,80℃水浴加热3 h;离心取上清液,用1 mol/L盐酸调节上清pH值为7.0,逐滴加入5%三氯乙酸,4℃静置3 h后离心取上清液,重复上述操作,去除上清液中的蛋白;加入约3倍上清液体积的95%乙醇,4℃下放置过夜;离心取沉淀,用丙酮洗涤2~3次,对沉淀进行冷冻干燥处理后,即可得到螺旋藻多糖产品。
1.3.2.2 螺旋藻多糖提取条件的优化 选取对试验结果具有较大影响的4个因素,即提取时间(t),料液比(M),提取温度(T)和pH 值,进行 4 因素3水平的正交试验,优化螺旋藻多糖的提取条件,获得最佳提取工艺,正交试验设计如表1所示。
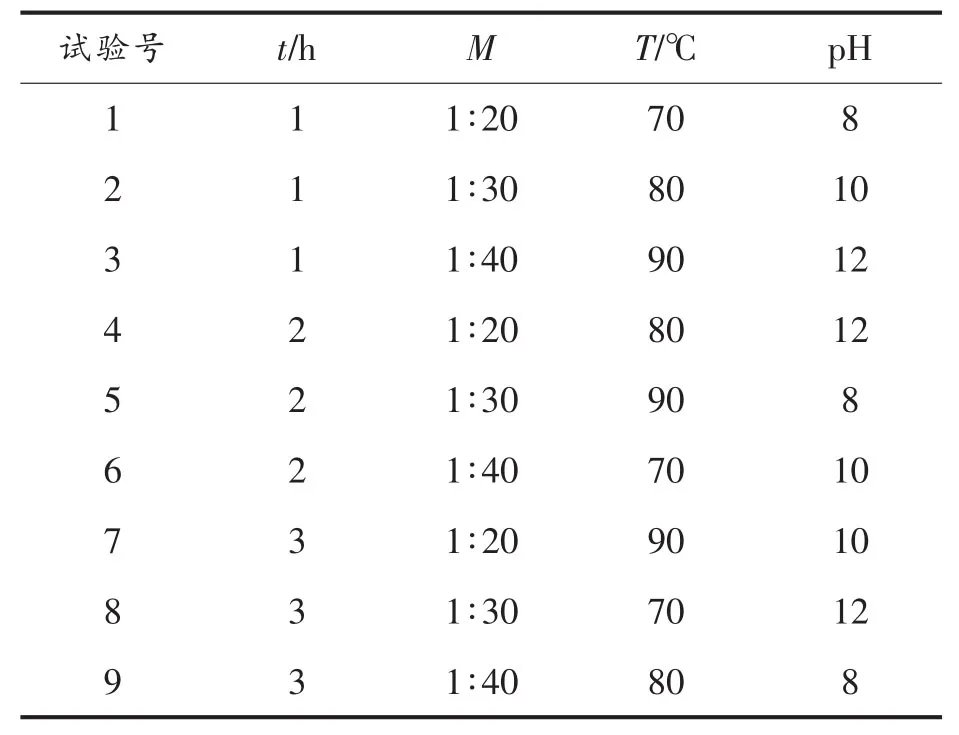
表1 正交试验设计Table1 Orthogonal experimental design
1.3.3 螺旋藻多糖对酪氨酸酶抑制效果的研究酪氨酸酶可以催化L-多巴生成多巴色素,多巴色素在波长475 nm处具有最大吸收[26-27]。具体操作根据参考文献[20]所提供的方法:取0.1 mL的酪氨酸原酶溶液,与0.9 mL的PBS溶液(pH 6.8)混匀,在0℃暂存。称取不同质量的螺旋藻多糖,用DMSO 配制成不同质量浓度(4,12,20,28,36,40,44,52,60,80,100 mg/mL)的多糖溶液(效应物)。取一定量的0.5 mmol/L L-多巴溶液,在30℃下水浴10 min。在比色皿中,加入2.8 mL的L-多巴溶液,0.1 mL效应物,混匀后调零,再加0.1 mL酪氨酸酶溶液,混匀后立即在475 nm波长进行连续扫描,得到吸光度与时间的变化关系曲线。同时用0.1 mL不含效应物的DMSO空白对照,消光系数ε=3700 L·mol-1·cm-1[28],直线的斜率为相对酶活,绘制相对酶活与多糖浓度(CI)之间的关系图。
1.3.4 螺旋藻多糖对酪氨酸酶抑制机理的研究 以0.5 mmol/L的L-多巴溶液为底物,在上述反应体系中,研究螺旋藻多糖对酪氨酸酶的抑制机理[20,29]。 分别取酶酪氨酸原酶 40,60,80,100,120 μL,用pH 6.8的PBS溶液稀释,定容至1 mL;分别称取螺旋藻多糖样品 0.1,0.3,0.5,0.7 g,用 DMSO配制成不同浓度的多糖溶液(效应物),测定不同浓度的效应物对酪氨酸酶抑制活力的影响。以剩余酶活为纵坐标,以酶浓度(CE)为横坐标,绘制剩余酶活与酶浓度之间的关系曲线。根据直线的相交、平行情况,直线斜率变化情况,探究效应物对酪氨酸酶的抑制机理[20,30]。
1.3.5 螺旋藻多糖对酪氨酸酶抑制类型和抑制常数的测定 抑制剂类型的测定采用上述同样的测定体系,通过固定酶液浓度(酪氨酸酶质量浓度6.207 μg/mL),改变底物浓度(L-多巴液浓度分别为0.2,0.3,0.4,0.5,0.6 mmol/L)和抑制剂的浓度(螺旋藻多糖溶液质量浓度分别为4,12,20,28 mg/mL),探究不同浓度的抑制剂对酪氨酸酶活力的影响。本试验采用Lineweaver-Burk双倒数作图法,以反应速率的倒数(V-1)对底物浓度的倒数(CS-1)作图,观察直线的相交情况以及横纵轴截距[20,31],以直线斜率为纵坐标,抑制剂浓度(CI)为横坐标,进行二次作图,可得该效应物对酪氨酸酶的抑制常数(KI),从而判断出螺旋藻多糖对酪氨酸酶的抑制类型[32]。
1.3.6 螺旋藻多糖清除DPPH自由基的研究 螺旋藻多糖对DPPH自由基清除能力的研究参照Duan 等[33]的方法:称取 0,5,10,15,20,25 mg 螺旋藻多糖,用DMSO定容至25 mL,然后分别吸取上述不同浓度的螺旋藻多糖溶液2 mL,置于10 mL的具塞比色管中,每管中各加入2 mL的82 μg/mL DPPH溶液,混匀后,室温避光条件下静置30 min,随后倒入比色皿中,测定其在517 nm波长下的吸光度值Ai。其中螺旋藻多糖添加量为0(即未添加螺旋藻多糖)的一组,为空白组,其吸光度值记为A0。取2 mL 95%乙醇于比色皿中,加入2 mL的多糖溶液,测得吸光度值Ai0(即为调零组),以排除样品本身颜色的干扰[20]。通过式(1),判断螺旋藻多糖的自由基清除能力情况。
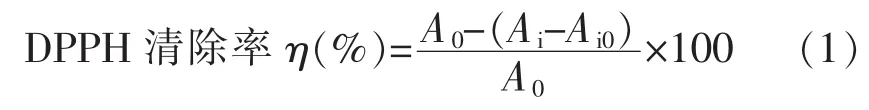
式中,Ai——试验组的吸光度值;A0——空白组的吸光度值;Ai0——调零组的吸光度值。
为了更直观地说明螺旋藻多糖的自由基清除能力的强弱,配制相同浓度的L-抗坏血酸溶液,按上述操作,通过对比对螺旋藻多糖的自由基清除能力进行说明。
2 结果与分析
2.1 绘制葡萄糖标准曲线
根据硫酸-蒽酮法绘制标准的葡萄糖标准曲线如图1所示。
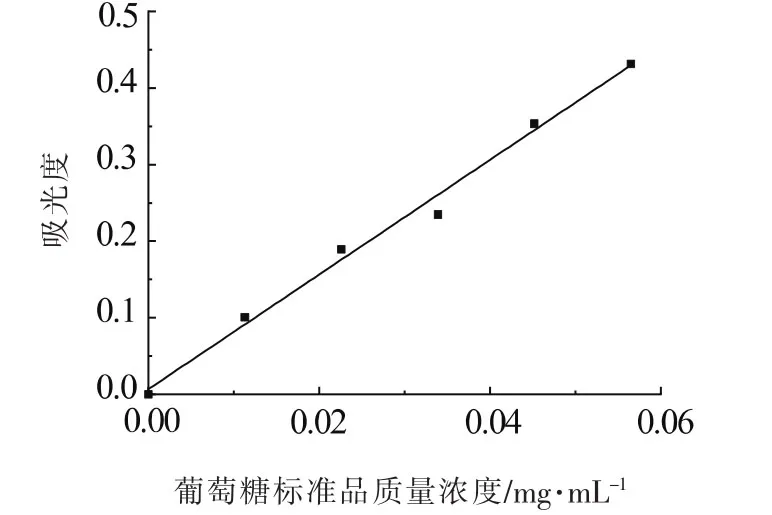
图1 葡萄糖标准溶液标准曲线Fig.1 Glucose standard solution standard curve
由图1可知,所得葡萄糖标准曲线在0~0.565 mg/mL的范围内线性良好,即在0~0.565 mg/mL的范围内,葡萄糖标准溶液浓度(C)与其对应吸光度之间具有良好的线性关系。其回归方程:A=7.4856C+0.0068(R2=0.9918)。
2.2 螺旋藻多糖提取条件的优化
通过正交试验,优化了螺旋藻多糖的提取工艺,获得最佳提取条件。其正交试验结果如表2所示。

表2 正交试验结果Table2 Orthogonal experimental results
由表2可知,在所选的4个因素中,提取温度对多糖提取率的影响最为重要,其次为料液比、pH值,提取时间对多糖提取率的影响则相对最弱。提取螺旋藻多糖的最佳工艺组合:A2B3C3D1,即在提取时间2 h,提取温度90℃,pH 8,料液比1∶40的条件下,理论上可以获得最高的提取率。通过验证试验结果可知,在上述最佳提取工艺条件下,螺旋藻多糖的提取率可高达1.50%。
2.3 螺旋藻多糖对酪氨酸酶的抑制效果
以酪氨酸酶相对活性对效应物(螺旋藻多糖)浓度(CI)作图,如图2所示。
由图2可知,酪氨酸酶活性与多糖溶液浓度成反比,说明该效应物对酪氨酸酶具有抑制作用。当抑制剂质量浓度<2.0 mg/mL时,酪氨酸酶酶活迅速下降,此后,酶活下降速度稍缓。测得导致酪氨酶活力下降50%的螺旋藻多糖质量浓度(IC50)为1.193 mg/mL。
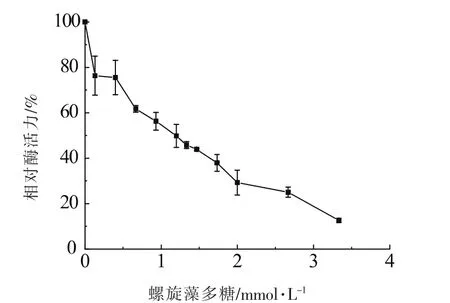
图2 多糖溶液对酪氨酸酶抑制效果Fig.2 Inhibitory effect of polysaccharide inhibitor on tyrosinase
2.4 螺旋藻多糖对酪氨酸酶的抑制机理
以0.5 mol/L的L-多巴溶液为底物,通过测定不同浓度下螺旋藻多糖对酪氨酸酶的抑制效果,从而判断其抑制机理。结果如图3所示。在图3中,以剩余酶活力为Y轴,以酶浓度为X轴绘图,得到5条斜率与效应物浓度呈反比的、交于原点的直线,即螺旋藻多糖对酪氨酸酶的抑制机理属于可逆抑制[32]。说明多糖与酪氨酸酶是通过非共价键结合的,且其结合是可逆的。效应物的抑制作用只是使酶活降低,对其有效酶量并未产生影响[19-20,32]。
2.5 螺旋藻多糖对酪氨酸酶的抑制类型及抑制常数
在不同浓度的螺旋藻多糖和L-多巴底物的反应体系中,酶质量浓度为6.207 μg/mL,测定在不同浓度的螺旋藻多糖溶液中,酶促反应速率的变化情况。即研究效应物多糖对酪氨酸酶活力的影响。以反应速率的倒数(V-1)和底物浓度的倒数(CS-1)为研究指标,采用 Lineweaver-Burk双倒数作图法作图,判断其抑制类型[20,33],结果如图4所示,得到一组直线,该组直线相交于第二象限,且直线在坐标轴上的截距与多糖浓度之间存在一定变化规律,说明螺旋藻多糖对酶促反应的最大反应速率(Vmax)和米氏常数(Km)均产生了影响[19-20]。因为Km与效应物多糖浓度之间成正比关系,而Vmax则相反,故可判断其抑制类型为混合型。以图4中各直线的斜率为Y轴,多糖浓度为X轴,再次作图,即图4中的插图。可求出抑制常数KI为0.544 mg/mL。

图3 多糖溶液对酪氨酸酶抑制机理的测定Fig.3 Determination of tyrosinase inhibitory mechanism by polysaccharide inhibitors

图4 多糖溶液对酪氨酸酶抑制类型及其抑制常数的测定Fig.4 Determination of tyrosinase inhibition type and its inhibition constant by polysaccharide inhibitor
2.6 螺旋藻多糖清除DPPH自由基的效果
螺旋藻多糖、L-抗坏血酸对DPPH自由基的清除效果如图5所示。由图5可知,螺旋藻多糖对DPPH自由基清除能力与其浓度成正比,在质量浓度0~0.6 g/L范围内,DPPH自由基清除能力上升较为迅速,其后变化趋于缓和,得到其半清除率(IC50)为0.463 g/L。由图5可以看出,质量浓度为1.0 g/L的螺旋藻多糖的自由基清除率分别为71.49%和86.42%,故可知螺旋藻多糖具有较强的抗氧化能力[20]。

图5 螺旋藻多糖对DPPH自由基清除效果Fig.5 Spirulina polysaccharide scavenging DPPH free radical
3 结论
本文通过对螺旋藻多糖提取工艺、螺旋藻多糖对酪氨酸酶抑制作用与机理及其抗氧化能力的研究,可以得知:在提取时间2 h,料液比1∶40,提取温度90℃,pH 8的条件下,螺旋藻多糖得率较高,可达到1.50%;螺旋藻多糖对酪氨酸酶具有较好的抑制效果,其IC50为1.193 mg/mL,其抑制过程属于可逆的混合型抑制,抑制常数KI为0.544 mg/mL。螺旋藻多糖对DPPH自由基清除率最高可达71.94%,与同浓度下的L-抗坏血酸相比,可知其具有较强的抗氧化能力。因此,开展螺旋藻多糖在防止果蔬褐变、食品保鲜、抗氧化剂、酶抑制剂等方面的相关研究工作具有重要意义。以期为螺旋藻多糖后续更为深入的实际应用机理及毒理学研究,提供较为综合、科学、客观的试验及理论依据。

