超高压升压和贮藏期胡萝卜软化特征及其机制
孙雅馨 康旭蕾 唐 筝 陈 芳 胡小松
(中国农业大学食品科学与营养工程学院 国家果蔬加工工程技术研究中心农业部果蔬加工重点实验室 食品非热加工北京市重点实验室 北京 100083)
胡萝卜(Daucus carota L.)为伞形花科植物,富含β-胡萝卜素,具有较高的营养价值和保健功能[1]。其较高的脆度和硬度适合于鲜切加工,是现代食品行业广泛使用的食品原材料。硬度和多汁性是影响消费者对果蔬口感评价的两大因素[2]。超高压处理(High pressure processing,HPP)应用于食品加工,能够较大程度保留食品的营养成分和感官品质[3-5],实现微生物的杀灭[4,6],延长食品货架期。长期以来,大量关于高压下果蔬质构品质变化的研究,主要围绕不同温压组合[7]、温压对照[8-9]、预处理结合压力[10-11]以及质构动力学[11]等方面展开。对于压力所致质构损失的机理,研究认为与高压下细胞膜损伤,膨压损失[12-14]以及细胞壁果胶的降解与转化[15-18]密切相关。
高压处理过程涉及升压和保压两个阶段。有研究发现,在较高压力下的升压会导致质构损失[19-20],而在较长的保压阶段,质构变化幅度远小于升压造成的损失[21-22]。针对不同压力下的升压阶段果蔬质构变化的规律及其机制,目前尚未展开系统研究。此外,高压作用往往不能充分钝化,甚至会激活与质构相关的酶活[3],在后期贮藏过程中极有可能引起质构进一步软化。本文研究了升压到不同压力(100~600 MPa)时胡萝卜硬度的变化规律,记录高压处理后(200,400,600 MPa,2 min)14 d低温贮藏期内硬度波动情况,从细胞膜透性、细胞微观结构变化和细胞壁果胶酶促降解与转化方面探究质构变化机制,对于了解HPP对果蔬品质的影响具有重要意义。
1 材料与方法
1.1 材料与设备
五寸参胡萝卜(孟德尔808),山东青岛;D-(+)半乳糖醛酸标准品、果胶(半乳糖醛酸(干基计)≥74.0%),阿拉丁试剂有限公司。
HPP-700-7L型超高压设备,包头科发高压科技有限责任公司;842 Titrando自动电位滴定仪,瑞士Metrohm公司;V1800型可见分光光度计,尤尼柯仪器有限公司;TA-XT2i质地分析仪,英国SMS公司;FE30-Five Easy Plus电导仪,瑞士Mettler Toledo公司;Lecia EM UC6超薄切片机,德国Leica公司;H-7650B透射电子显微镜,日本Hitachi公司。
1.2 试验方法
1.2.1 样品预处理 胡萝卜洗净,去皮,取中部切成厚约5 mm的薄片,混合后随机取约40 g胡萝卜片装入PE袋(10 cm×15 cm),真空包装。
1.2.2 超高压处理 以水为传压介质,于室温下分别升压至 100,200,300,400,500,600 MPa(升压速率120 MPa/min,降压时间短于6 s),保压0~2 min。以未经高压处理的胡萝卜片为空白对照。
1.2.3 硬度测定[8]用直径8 mm的打孔器在胡萝卜片韧皮组织打孔,形成圆柱体小丁。采用TAXT2i质地分析仪,R/36探头,对样品进行2次咀嚼(TPA)测试,触发力值5 kg。胡萝卜的硬度用第1次压缩形变30%的峰值力(N)表示。
1.2.4 相对电导率测定[23]取样方法同硬度测定。取5 g胡萝卜小丁于小烧杯,加入20 mL去离子水(电导率为5.2 μs/cm),于室温下振荡浸泡30 min,用电导仪测定电导率(R1)。沸水浴中加热30 min,冷却至室温后再次测定电导率(R2)。相对电导率为R1与R2比值的百分比。
1.2.5 透射电镜观察[14]韧皮部取1 mm3的胡萝卜小丁,依次固定于2.5%戊二醛、1%锇酸固定液。按顺序用 50%,60%,70%,80%,90%,100%的乙醇、100%的乙醇与丙酮1∶1、100%的丙酮脱水。依次用 1∶1,1∶2,1∶3的纯丙酮与包埋液于室温下各包埋12 h,再用纯包埋液室温包埋过夜。37℃烘箱过夜,60℃烘干24 h。采用超薄切片机切片70 nm,用3%醋酸铀-枸橼酸铅进行双染色后,于透射电镜下观察、拍照。
1.2.6 果胶甲酯酶(PME)活性测定[7]10 g胡萝卜片于20 mL 0.2 mol/L Tris-HCl缓冲液打浆,4℃静置12 h,过滤、离心,上清液即为PME粗酶液。以10 mg/mL果胶溶液为底物,在pH 8.0,35℃下采用自动电位滴定仪测定酶活。酶活以反应前期NaOH随时间消耗的速率表示,酶活大小表示为空白对照的百分比。
1.2.7 多聚半乳糖醛酸酶(PG)活性测定[7]用95%、80%的乙醇、50 mmol/L的乙酸钠缓冲液提取PG粗酶液。酶活测定体系含0.3 mL粗酶液,0.3 mL 0.3%多聚半乳糖醛酸(0.04 mol/L醋酸钠,pH 4.4),40℃反应2 h,加入0.1 mol/L硼酸缓冲液和1%氰乙酰胺,沸水加热10 min,冷却后测定276 nm吸光值。以灭活后的酶液作为对照。标准曲线用 0~100 mg/mL半乳糖醛酸绘制:y=0.0128x+0.007,R2=0.9965。 酶活单位 1 U=1 mg 半乳糖醛酸/(h·gFW),酶活表示为空白对照的百分比。
1.2.8 醇不溶物制备与果胶组分分离[24]80%乙醇与胡萝卜进行匀浆、煮沸,重复3次后,冷却过滤,残渣浸泡于90%二甲基亚砜4℃过夜,不溶物于氯仿与甲醇混和液(2∶1,体积比)浸泡,再用95%乙醇冲洗至均一、白色粉末状固体,烘干恒重,即得细胞壁物质(AIR)。称取0.1 g AIR于沸水中振荡5 min,冷却过滤、定容,即得水溶性果胶(WSP);取水不溶性残渣,以0.05 mol/L的乙二胺四乙酸(含0.1 mol/L KAc,pH 6.5)于 28℃抽提6 h,过滤定容,滤液即为螯合性果胶(CSP);取不溶性残渣,以0.05 mol/L Na2CO3(含0.02 mol/L NaBH4)于4℃ 抽提16 h,然后在 28℃下重复抽提6 h,过滤定容,滤液即为碱溶性果胶(NSP)。
1.2.9 果胶含量测定[25]果胶含量以其生成的半乳糖醛酸含量表示。果胶溶液中加入0.0125 mol/L浓硫酸-四硼酸钠溶液,于沸水浴中降解后,与1.5 mg/mL间苯基苯酚溶液反应,测定520 nm处吸光值。空白为5 mg/mL NaOH溶液。标准曲线采用0~100 μg/mL D-半乳糖醛酸绘制:y=0.0112x-0.042,R2=0.9957。
1.2.10 果胶甲酯化度(DM)测定[20]20 mg AIR溶于去离子水,超声振荡10 min,加入2 mol/L NaOH于20℃反应1 h。加入2 mol/L HCl中和体系,于25℃反应15 min。过滤,滤液用磷酸缓冲液(pH 7.5)定容。取1 mL样液与1 mL乙醇氧化酶(~1 U)于25℃反应15 min。加入乙酰丙酮于58℃反应15 min。冷却后,于412 nm测定吸光值。空白用磷酸缓冲液代替乙酰丙酮。
1.2.11 贮藏试验 将高压处理以及空白对照的胡萝卜置于4℃贮藏14 d,每隔7 d测定以上数据,记录贮藏期内各指标变化。
1.3 数据统计与分析
采用Origin 8.0软件进行数据处理与绘图。用Turkey法进行差异显著分析,P>0.05表示差异不显著,P<0.05表示差异显著。
2 结果与分析
2.1 超高压升压阶段胡萝卜硬度变化及其机制
2.1.1 升压阶段胡萝卜硬度的变化 保压0 min能够反映升压过程中胡萝卜硬度变化的情况。根据表1,升压至200 MPa以上,胡萝卜的硬度显著下降(P<0.05),说明升压阶段直接导致了胡萝卜硬度的损失。100 MPa处理后,胡萝卜硬度仍保持在90%以上,与空白对照无显著差异(P>0.05)。升压至400 MPa硬度降至33.53%,继续升压,硬度无显著变化(P>0.05)。600 MPa保压 0~2 min 硬度出现了回升,这与Basak等[22]观察到的果蔬硬度在保压过程中出现回升相符,他将该现象定义为“瞬时压力软化”。本研究中出现该现象的原因可能是胡萝卜组织受到压力应激后在持续的保压过程中进行自我修复,组织刚性有所增加。

表1 不同保压时间下胡萝卜的硬度(n=10)Table1 Hardness of high pressure(100-600 MPa,0-2 min)processed carrot(n=10)
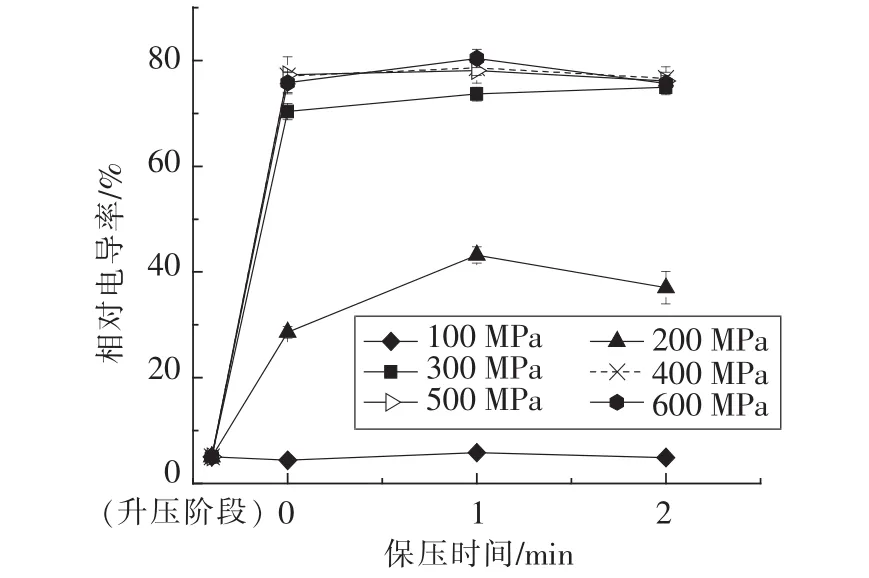
图1 不同保压时间下胡萝卜的相对电导率Fig.1 Relative electrolytic leakage of high pressure(100-600 MPa,0-2 min)processed carrot
2.1.2 升压阶段胡萝卜细胞膜透性的变化 相对电导率用以指示细胞膜通透性的改变,其值越大,细胞渗漏电解质的量越多,细胞膜破损程度越大。从图1可知,除100 MPa外,升压过程中相对电导率均显著增加(P<0.05),说明升压阶段直接导致了细胞膜的损伤。研究发现,超高压处理会增加细胞膜透性[3],一些溶质利用质外体途径、共质体途径或者跨膜运输实现细胞间或细胞内向外的转移[26]。100 MPa处理后,相对电导率低于6%,说明压力在100 MPa以下不足以造成细胞膜的破损。升压至400 MPa时,相对电导率已高达77.09%,随压力继续升高,相对电导率无显著变化(P>0.05)。保压过程中,除200 MPa处理组的相对电导率增加外,其余处理组的相对电导率均无显著变化(P>0.05)。此结果与硬度变化相符,说明压力导致的细胞膜透性显著增加是胡萝卜硬度软化的原因之一,而400 MPa有可能是压力损伤界限值,高于此压力,损伤将不再增加。张红敏[27]在其研究中也得到了类似结果。
基于硬度和相对电导率的变化,本研究选取具代表性的高压处理组(200,400,600 MPa,2 min)探究贮藏期内胡萝卜的硬度变化及其机制。
2.2 高压处理后贮藏期内胡萝卜硬度变化及其机制
2.2.1 贮藏期胡萝卜硬度的变化 图2显示了14 d贮藏期内胡萝卜硬度的变化。200 MPa处理后,胡萝卜的硬度在贮藏第7天出现显著回升(P<0.05),14 d 后又回到初始值。400,600 MPa处理组的硬度在贮藏期内无显著变化(P>0.05),说明高压在一定程度上能够减少贮藏期内胡萝卜的质构软化,而未处理组的胡萝卜在贮藏14 d后硬度下降了17.9%。
2.2.2 贮藏期胡萝卜细胞膜透性的变化 由图3可知,除200 MPa外,胡萝卜在贮藏过程中相对电导率变化不明显,说明细胞膜透性并未发生显著变化。200 MPa处理组在贮藏7 d后相对电导率显著下降(P<0.05),此时硬度有所增加(图2),可能与贮藏前期细胞内抗氧化酶(过氧化物酶、过氧化氢酶)参与的氧化损伤修复有关[23]。

图2 超高压处理后贮藏期内胡萝卜的硬度Fig.2 Hardness change of high pressure(200/400/600 MPa,2 min)processed carrot during storage
2.2.3 贮藏期胡萝卜细胞形态与结构的变化 图4显示了高压处理后胡萝卜的细胞显微结构。未处理的胡萝卜细胞排列整齐,细胞壁光滑,胞间连接紧密,可观察到完整的细胞膜与液泡膜(图4a)。加压处理后,细胞形变严重,细胞壁出现大幅褶皱、弯曲(图4d、4g、4j)。 高压下细胞形态变化与膨压损失、细胞壁的机械性能受损有关[28]。200 MPa处理后细胞膜仍具有一定完整性(图4f),400 MPa以上压力处理后细胞膜出现破损(图4i、4l)。600 MPa处理后细胞溃散严重,胞间层溶解(图4j、4k)。此结果与其它研究结果一致,100~200 MPa会破坏细胞膜的完整性,引起细胞壁轻微的损伤,而300~400 MPa下细胞膜完全破裂,细胞壁增厚[13,20,29-30]。 Jung 等[31]观察到胡萝卜经 400 MPa处理后韧皮部薄壁组织出现了穿孔和破裂;Préstamo等[32]则发现高压处理会使花椰菜细胞破裂,膨压损失,细胞内容物流出;菠菜叶的薄壁组织消失,出现空泡。图4中细胞壁周围的黑色片段可能是细胞膜发生氧化损伤生成的丙二醛,与蛋白质、肽类或脂类聚合、交联形成的脂褐质[33]。

图3 超高压处理后贮藏期内胡萝卜的相对电导率Fig.3 Relative electrolytic leakage of high pressure(200/400/600 MPa,2 min)processed carrot during storage
4℃贮藏使未经处理的胡萝卜胞间空隙增大,细胞壁出现一定程度的弯曲、褶皱,细胞膜与细胞壁有分离趋势(图4a-4c,图5a-5c)。高压处理后,随施加压力增大,细胞壁紧密结构的破坏以及胞间粘连作用的减弱在贮藏期间程度增加。200 MPa处理后第7天细胞膜与细胞壁出现分离(图4f),14 d后则不能观察到完整的细胞膜结构(图5f)。400 MPa和600 MPa处理组在贮藏期内胞间隙明显增加(图4h,图5k),贮藏 7 d 后,600 MPa处理组的胞间隙被溶质填满(图4k),同时胞间分离越来越显著,细胞壁发生降解,表现为细胞壁增厚,边缘不规则,胞间层容散直至消失(图4k,4l,图5k,5l)。洋葱经高压处理后在贮藏过程中同样出现细胞分离,细胞壁降解现象[33],黄桃罐头在贮藏中随贮藏温度升高,细胞分离程度增大[35]。

图4 超高压处理后贮藏7 d胡萝卜的细胞显微结构Fig.4 Microstructure of high pressure(200/400/600 MPa,2 min)processed carrot after 7 days’ storage
2.2.4 贮藏期胡萝卜果胶的酶促降解 果胶的降解与果蔬加工、贮藏过程中质构的软化密切相关[36],PME、PG催化果胶去甲酯化和解聚[37-39]。由图6a可得,未处理组的胡萝卜DM为61.6%,600 MPa以上压力处理会使DM显著降低(P<0.05),且在贮藏过程中400 MPa和600 MPa处理组的DM均有所下降,一方面与压力激活的PME酶活相关(图6b),另一方面压力引起的细胞结构破坏有利于位于不同区室的底物与酶充分接触,加速酶促降解[3,35]。200 MPa处理组在贮藏过程中DM出现下降波动,结合硬度在第7天出现回升的现象,分析其原因可能是去甲酯化的果胶与二价阳离子形成交联,从而有利于质构保持[23,39]。
根据图6b、6c,200~600 MPa的压力均未引起PME、PG的钝化,相反在贮藏期内其活性还得到了显著激活(P<0.05)。PME的耐压性以及热敏性在诸多文献中均有报道[16,40-41],钝化其酶活通常需要600 MPa以上压力[42]。因此,600 MPa下DM的降低与压力下激活的PME有关。而压力处理后胡萝卜在贮藏过程中并未见显著的质构软化,有可能是引起质构软化的果胶酶促降解过程与质构保持相关的果胶交联过程达到了动态平衡。
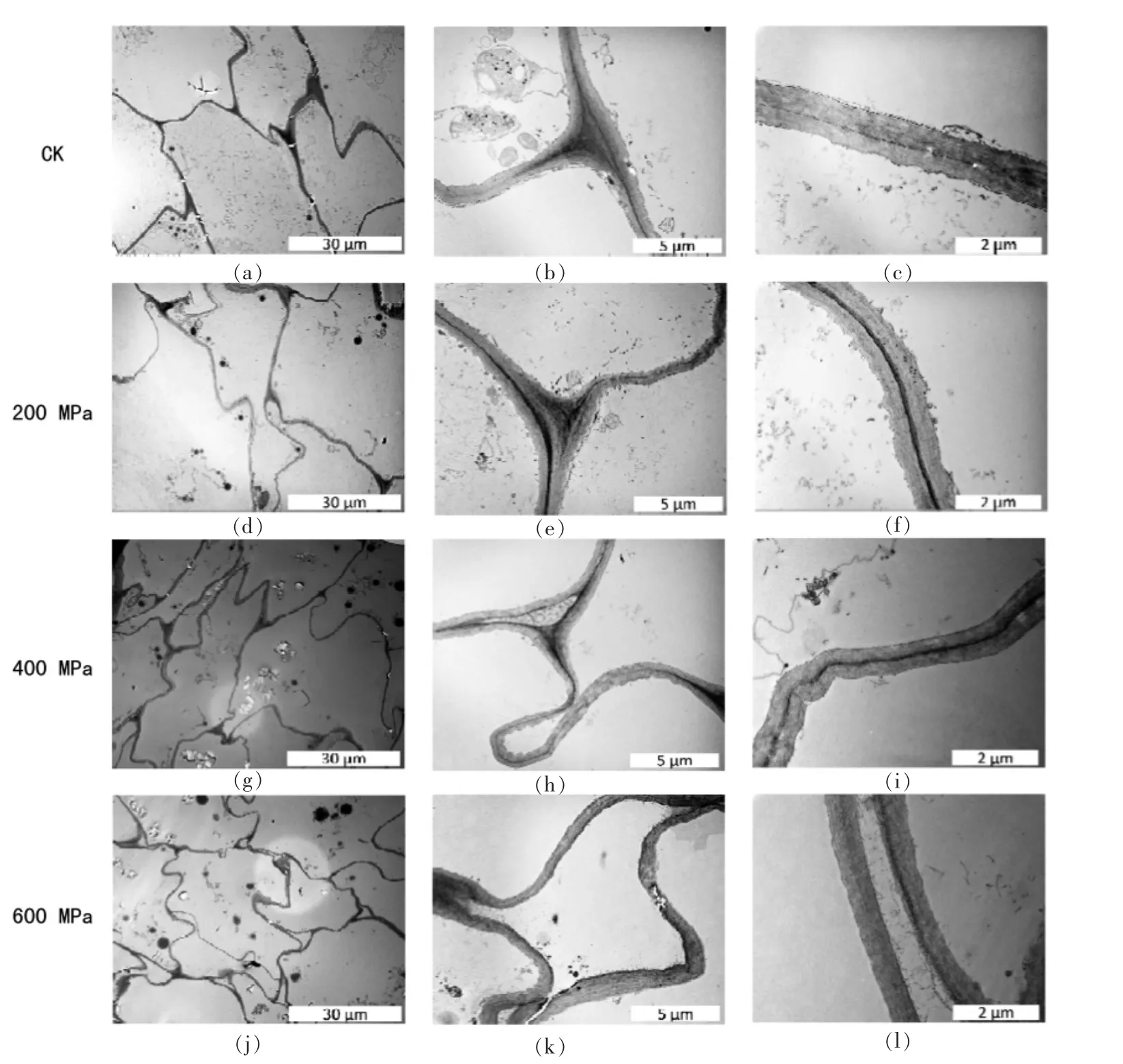
图5 超高压处理后贮藏14 d胡萝卜的细胞显微结构Fig.5 Microstructure of high pressure(200/400/600 MPa,2 min)processed carrot after 14 days’ storage


图6 超高压处理后贮藏期内胡萝卜果胶的酶促降解Fig.6 Enzymatic degradation of pectin in high pressure(200/400/600 MPa,2 min)processed carrot during storage
2.2.5 贮藏期胡萝卜果胶含量与组成的变化 高压处理后不同果胶组分含量在贮藏期内的变化如图7所示。由图7a可知,高压处理会导致总果胶含量降低。在贮藏期内未处理的胡萝卜果胶损失较为严重,14 d后降至64.4%。除600 MPa外,14 d后200 MPa、400 MPa处理组的总果胶含量均高于空白处理,说明高压处理在一定程度上限制了果胶在贮藏期内的降解。由图7b可知,高压处理会引起WSP损失,压力越大,损失越严重,且在贮藏期内损失持续进行。这与DM值的降低相符,去甲酯化会引起果胶水溶性的降低[40]。根据图7c可知,胡萝卜经高压处理后CSP含量有所增加,结合DM的降低,其原因可能是果胶去甲酯化后与阳离子形成了交联。除400 MPa外所有处理组的CSP含量在贮藏7 d后都出现了下降,14 d后又出现回升。NSP在贮藏期的变化如图7d所示,600 MPa处理后NSP含量显著增加(P<0.05),并在贮藏期内保持较高水平,有可能是高压作用下果胶形成了特殊的可以与碳酸盐结合的酯键[23]。贮藏期内400 MPa处理组的NSP含量呈上升趋势。
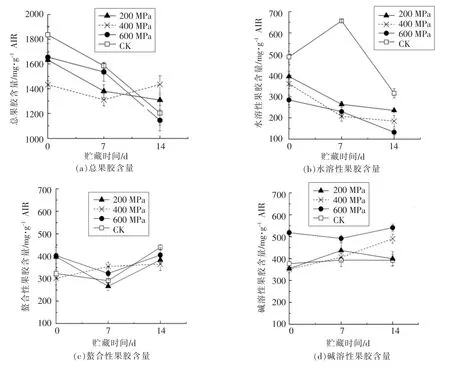
图7 超高压处理后贮藏期内胡萝卜果胶含量的变化Fig.7 Content of total pectin and fractions of high pressure(200/400/600 MPa,2 min)processed carrot during storage
胡萝卜经高压处理后贮藏期内不同果胶组分比例变化如图8所示。未处理的胡萝卜果胶组成为WSP(39.4%),CSP(28.0%),NSP(32.6%)。 400 MPa以上压力会使WSP比例显著下降(图8a),NSP比例显著增加(P<0.05);贮藏期内,所有压力处理组均表现为WSP比例下降,NSP比例增加(图8b-8c)。根据勒夏特列原理,压力几乎不会引起共价键的断裂[43],因此NSP得以保留。研究发现,高温高压(600 MPa/80℃)处理胡萝卜后,WSP仅剩 14%,CSP、NSP 分别增至 44%,40%[23]。 Sila等[44]则发现胡萝卜WSP含量与质构成负相关关系(r<-0.97),NSP含量与质构成正相关关系(r<0.98)。菜豆在贮藏过程中硬度增加也与NSP含量增加有关[45]。本研究中NSP的增加有可能是贮藏期内胡萝卜硬度未进一步软化的原因。

图8 超高压处理后贮藏期内胡萝卜果胶组成的变化Fig.8 Proportion change of pectin fractions of high pressure(200/400/600 MPa,2 min)processed carrot during storage
3 结论
超高压能够引起胡萝卜硬度损失,但能在一定程度上减少贮藏过程中的软化。压力所致的硬度损失主要发生在升压阶段。100 MPa对细胞无实质性损伤;200 MPa时,膜的完整性受到破坏;400 MPa有可能是压力损伤临界值,升压阶段导致了约70%的硬度损失;600 MPa则导致膜完全破裂,细胞壁发生降解,并在贮藏过程中加速细胞分离。超高压引起的细胞膜机械损伤是胡萝卜硬度损失的主要原因,与此同时,超高压激活的果胶甲酯酶和聚半乳糖醛酸酶催化果胶去甲酯化和解聚,然而由于压力作用有助于果胶形成新的连接,最终在贮藏期内并未引起显著的质构软化。本文为高压下鲜切果蔬质构的变化规律及其机理提供了有利证据,然而针对高压下细胞膜、细胞壁的损伤对质构影响程度的大小还有待进一步的定量分析。

