酸枣仁汤对抑郁模型大鼠海马CaMKⅡ基因表达影响的实验研究
田旭升,张策,龚永涛,王超颖,杨彬
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
抑郁症(depression)作为一种精神疾病,具有持久显著的心境低落与认识功能障碍等特征,缺乏愉快感,伴有罪恶感、失眠、厌食、抑郁焦虑等情感功能障碍。根据世界卫生组织统计,全球组织研究显示,目前抑郁症已经成为“世界第三大负担疾病”,抑郁症的平均发生率约为3.1%,在发达国家接近6%[1],被精神科医生和心理学家喻为“精神科的感冒”。 据推测,每年因罹患抑郁症而轻生离世的人数超过了100万人[2]。目前临床上常用药SSRIs类以及SNRIs治疗抑郁症的效果虽然较好,但是两类药物在临床中的安全性、耐药性以及用药成本,成为患者备受关注的焦点。
中医药对抑郁症的防治具有独特的疗效。夏寒星[3]研究发现,酸枣仁汤可以显著改善慢性应激大鼠的兴趣丧失、活动能力下降等精神运动性抑郁症状。张仲景著《金匮要略·血痹虚劳病脉证并治》中记载:“虚烦虚劳不得眠,酸枣仁汤主之。”酸枣仁汤为抑郁症的现代治疗提供了新观念和新角度。
现有众多研究资料显示,通过CaMKⅡ信号转导通路活性,参与海马神经元重塑已经成为对抑郁症发病原因研究的新突破口。本实验以抑郁模型大鼠的建立为基础,通过正常对照组、模型组、氟西汀组的比较,观察酸枣仁汤对抑郁模型大鼠海马内的CaMKⅡ蛋白及基因表达的影响,结合行为学的改变,探索酸枣仁汤可以改善大鼠抑郁症状指标,为酸枣仁汤可以有效治疗抑郁提供依据。
1 实验材料
1.1 动物
清洁级SD雄性大鼠48只,体质量130~230 g;黑龙江中医药大学动物实验中心提供,合格证号:SCXK(黑)2014-0008;实验所需的SD大鼠专用饲料,由黑龙江中医药大学动物实验中心提供,所有饲料利用高压灭菌等步骤,经过了严格的处理。
1.2 药物
酸枣仁汤(酸枣仁20 g、茯苓10 g、知母10 g、甘草5 g和川芎10 g)剂量主要参考《金匮要略》记载,方中所需中药饮片均购买于黑龙江中医药大学附属第一医院药局,水煎浓缩,制备成低(0.5 g/mL)、中(1 g/mL)和高(2 g/mL)3种剂量,放入4 ℃冰箱保存备用。氟西汀(法国礼来苏州制药有限公司,批号:4510A);兔抗多克隆一抗、二抗PV6001、DAB显色剂(北京中山公司,中国);其他试剂为国产分析纯。
1.3 试剂
TRIZOL试剂、氯仿和75%乙醇 (北京索莱宝科技公司);CaMK Ⅱ引物、β-actin引物、MasterMix2溶液(三博远志生物技术公司);Real-time PCR荧光染料(宝生物工程(大连)有限公司,中国);RIPA裂解液、兔抗多克隆一抗、二抗(天津广成化学试剂公司);蔗糖(天津巴斯夫化学试剂公司)
1.4 仪器
免疫组织化学实验试剂盒(基因科技有限公司,中国);恒温冰箱(日本三洋电器有限公司);电子天平、摄像头、烘箱(沈阳龙腾电子公司);低速自动平衡离心机(中国LDZ-2型);7500型荧光定量PCR仪(美国ABI公司);电击箱(北京医科院药研所);石蜡切片机莱卡2135型(德国);Moticam3000显微摄影成像系统(美国);上海恒电热恒温箱;医学数码图像分析系统(麦奥迪克厦门公司)5810R高速低温离心机、移液枪(德国Eppendorf公司);液氮罐(中国亚西有限公司);-80 ℃冰箱(美国Thermo Firsher);自制旷场实验箱。
2 方法
2.1 动物分组方法及给药方法
实验前3天对大鼠进行适应性饲养,参考体质量、蔗糖水消耗以及行为学测试评分,将48只大鼠随机分成6组,每组8只。造模(除空白组)7天以后,连续灌胃21天。大鼠给药量不宜过多,结合大鼠体表面积与成人体表面积的比例进行换算,再按照成人1天的药量给药。
正常对照组和模型组给予10 mL/kg 0.9%生理盐水灌胃,氟西汀组给予0.36 mg/mL氟西汀混悬液灌胃,酸枣仁汤低中高剂量组分别给予浓度为0.5 g/mL、1 g/mL和2 g/mL的酸枣仁汤灌胃,6组均每日灌胃1次。
2.2 抑郁模型制备
空白组大鼠每笼8只,在实验过程中不接受任何形式的刺激,根据实验流程正常饲养。其他组别大鼠进行孤养,每笼1只大鼠。在28天实验时间里,非空白组的大鼠每天都要接受共计7种不同慢性刺激,每天进行1种,构建慢性轻度不可预见性应激大鼠抑郁(CUMS)模型,其中,相同的刺激形式不可以连续进行。应激方法根据Banasr方法略微改进,刺激方式如下:
禁水:给予大鼠12 h断水,于造模当天8:00—20:00进行12 h断水,断水期间内正常给予食物。
禁食:给予大鼠12 h断食,于造模当天8:00—20:00进行12 h断食,断食期间给予正常饮水。
倾斜鼠笼:将鼠笼倾斜45°,持续12 h后将鼠笼恢复到原位。
垫料潮湿饲养:向鼠笼中加水,使垫料潮湿,垫料潮湿状态持续12 h后换掉。
昼夜颠倒:晚上7点将日光灯打开,持续12 h,使大鼠在夜间处于光照状态。
45 ℃烘箱热烘刺激:把大鼠放进温箱,温箱保持在45 ℃,持续10 min。
液态水游泳:将大鼠放入盛有-10 ℃冷水的桶中,让大鼠的足尖离开桶的底部即可,让大鼠在水中持续5 min左右,之后用吹风机将大鼠身体吹干,防止大鼠受凉。
2.3 实验观测内容及方法
氟西汀组和酸枣仁汤各剂量组在造模第8天开始分别给予氟西汀药物和酸枣仁汤各剂量组进行干预。正常对照组和模型组分别急于生理盐水灌胃。实验第0天和第28天,分别测量并观察每只大鼠体质量变化、蔗糖水消耗量、行为学得分情况。在实验第28天,对各组大鼠进行海马取材,应用RT-PCR检测大鼠海马内CaMK II蛋白mRNA的表达情况,Western-blot方法检测CaMK II蛋白的表达情况。
2.3.1 大鼠体质量测量
观察各组大鼠体质量的变化,在实验的第0天、第7天、第14天、第21天和第28天对大鼠进行体质量测量,然后记录。总结数据进而进行统计分析,分析体质量改变与抑郁发作的关系。
2.3.2 大鼠糖水消耗试验
大鼠的糖水消耗检测于实验的第0天、第7天、第14天、第21天和第28天开始进行。大鼠糖水消耗试验前一天,要对各组大鼠进行相应准备,包括禁水及禁食的刺激。之后更换大鼠饮用水,每瓶150 mL,换成1%浓度的蔗糖水,持续禁食状态。实验持续12 h后,整理记下所有瓶中蔗糖水量的剩余量,根据差值得出糖水的消耗量。利用大鼠对糖水的偏好,观察动物快感缺乏情况以及改善情况。
2.3.3 旷场实验测试
大鼠体质量检测完毕后,在实验的第0天、第7天、第14天、第21天和第28天进旷场实验[6]。测试装置是一个木箱,木箱长、宽各为1 m,高约0.8 m,箱底内部有25个16 cm×16 cm的小方格。测量的计分方式是:测量得分分为垂直活动得分和水平活动得分。垂直活动得分标准是大鼠前肢抬起,后肢保持直立。水平活动得分标准是大鼠四肢共同处于1个方格内。测试大鼠达到标准时计1分。测量时,将测试大鼠放在木箱底部的中心处,检测过程中要保证减少额外干扰比如排除光照、温度、时间以及环境噪音的干扰。事先熟练掌握检测标准,有助于再正式检测前减少人为的误差。计时3 min,统计活动时间内大鼠水平、垂直活动得分。计算得分人数为2人或2人以上,其中1人负责观察并记录时间,其他人负责记录大鼠水平及垂直活动得分。
2.3.4 大鼠海马内CAMK II的蛋白测定
实验第28天,检测大鼠体质量、糖水消耗实验及旷场实验得分等指标。之后每组选取4只大鼠,麻醉后断头,打开颅腔,取双侧海马组织,迅速分装于冻存管中,放入-80 ℃液氮罐中速冻,速冻后将组织放入-80 ℃冰箱中保存。
2.3.4.1 RT-PCR法测定大鼠海马内CaMK ⅡmRNA表达方法
1)取冻存细胞,室温放置5 min使其完全溶解,然后放置玻璃匀浆器中,按20:1的比例加入TRIZOL后匀浆至无明显组织块,静置5 min,使组织液达到完全裂解状态。
2)加入100 μL氯纺,振荡均匀,静置15 min,4 ℃,离心12 000 r/min,弃上清,使RNA沉淀于管底,加入1 mL的75%乙醇,振荡离心,清洗沉淀,4 ℃,7 500 g,离心5 min,弃上清,将沉淀晾干,用20 μL无RNA酶水溶解RNA沉淀。
3)加入引物与Mix液:
CaMK II引物:
上游引物序列:5′AAGATGTGCGACCCTGGAATG3′。
下游引物序列:5′TGTAGGCGATGCAGGCTGAC3′。
β-actin引物:
上游引物序列:5′AGCGGGAAATCGTGCGTG3′。
下游引物序列:5′CGTGGTGGTACATGGGAC3′。
配置MasterMix2溶液,4℃,用移液枪将MasterMix2浓缩液、引物、模板加入平行孔中,每个样品至少做3个平行孔,加入平行孔时每孔均要更换新的枪头,所用成分加完后,离心去除气泡。
4)RT-PCR反应:反应过程于荧光定量基因扩增PCR检测系统进行,设置反应条件:94 ℃预变性,5 min,进入下一循环。94 ℃,30 s,退火40 s,72 ℃,40 s,35个循环后,72 ℃延伸10 min,扩增CaMK II片段和β-actin片段。
5)监测各循环荧光值,数据分析由自带系统软件自动完成,同时通过软件可以确定Ct值(所有标准品和样品的起始循环数)。根据Ct值绘制出的标准曲线,可计算出样本的初始拷贝数。用比较阈值法来测定目的基因的相对表达情况。
2.3.4.2 Western-blot法测定CaMK Ⅱ蛋白方法:
1)取冻存细胞,室温放置5 min。将提取的大鼠海马按照100 mg/mL加入200 μL RIPA裂解液,加入蛋白酶抑制剂后匀浆。
2)静置1 h后,将其放置于冰上,在4℃下进行12 000 r/min离心操作,持续30 min。
3)提取上清液测定总蛋白浓度,测得结果后置于-80 ℃冰箱冻存备用。
4)SDS聚丙烯酰胺通过凝胶电泳,使25 μg总蛋白样品分离,使之发生转移,附着到PVDF膜上。
5)TBST配制脱脂奶粉,浓度5%,室温封闭,持续1 h,加兔抗CAMKII单克隆抗体,4 ℃冰箱中孵育过夜。
6)分别加羊抗兔二抗、羊抗大鼠二抗室温孵育2 h。
7)每次孵育完后TBST漂白,持续10 min,反复操作3次。
8)将膜用P10-LightHRP化学发光液室温孵育,时间持续5 min,之后封入保鲜膜,暗室内压入胶片,进行曝光显影。
9)显影后,利用图像分析软件测定目的CAMK II蛋白与内参蛋白β-actin的灰比度。
2.4 统计学处理

3 结果
3.1 酸枣仁汤对大鼠一般状态的影响
第0天各组大鼠反应迅速、皮毛光亮、活泼好动,对外界刺激反应敏感,而在第28天,相较于空白组,模型组大鼠反应迟钝、少动、皮毛灰暗、蜷缩于箱角,对外界刺激少有回应。
3.2 酸枣仁汤对大鼠体质量的影响
第0天各组大鼠体质量无明显差异(P>0.05),第28天后,相较于模型组,酸枣仁汤中、低剂量组增长速度加快,有显著性差异(P<0.05);氟西汀组与酸枣仁汤高剂量组增长速度明显加快,差异极其显著(P<0.01),结果见表1。
3.3 酸枣仁汤对大鼠蔗糖水消耗
第7天各组大鼠糖水消耗无明显差异(P>0.05),实验第28天后,与模型组比较,其余各组糖水消耗增加,有显著性差异(P<0.05),结果见表2。
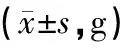
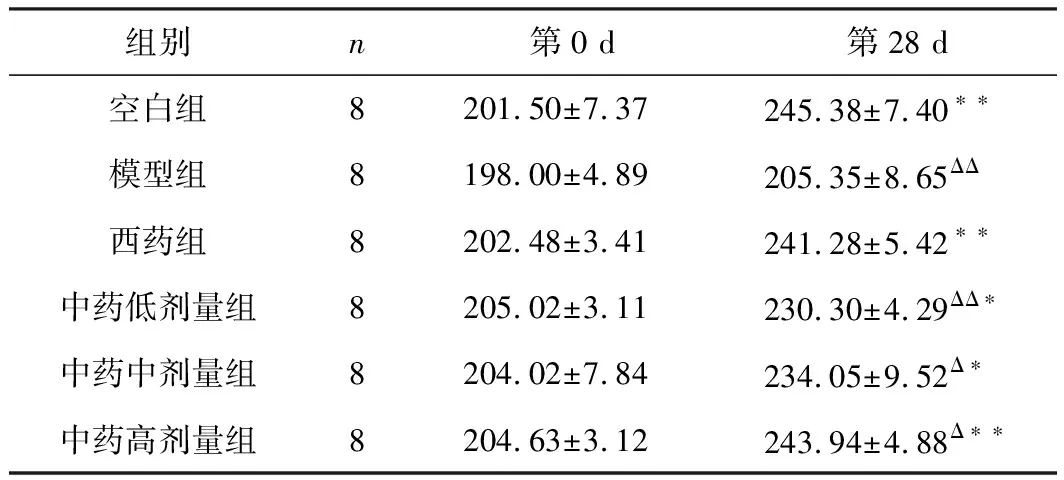
组别n第0 d第28 d空白组8201.50±7.37245.38±7.40∗∗模型组8198.00±4.89205.35±8.65ΔΔ西药组8202.48±3.41241.28±5.42∗∗中药低剂量组8205.02±3.11230.30±4.29ΔΔ∗中药中剂量组8204.02±7.84234.05±9.52Δ∗中药高剂量组8204.63±3.12243.94±4.88Δ∗∗
注:和模型组比较,*P<0.05,**P<0.01;和空白组比较,ΔP<0.05,ΔΔP<0.01。
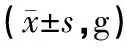
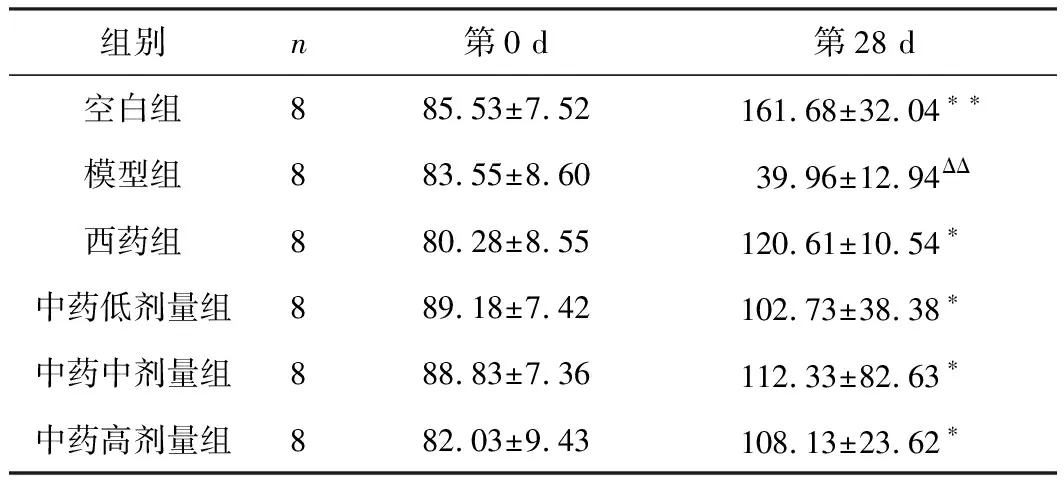
组别n第0 d第28 d空白组885.53±7.52161.68±32.04∗∗模型组883.55±8.6039.96±12.94ΔΔ西药组880.28±8.55120.61±10.54∗中药低剂量组889.18±7.42102.73±38.38∗中药中剂量组888.83±7.36112.33±82.63∗中药高剂量组882.03±9.43108.13±23.62∗
注:和模型组比较,*P<0.05,**P<0.01;和空白组比较,ΔΔP<0.01。
3.4 酸枣仁汤对大鼠旷场实验垂直、水平运动得分的影响
实验第0天,各组大鼠垂直得分无明显差别(P>0.05),第28天,与空白组相比,模型组垂直得分明显减少,有显著性差异(P<0.01),出现类似抑郁症的症状,从行为学的角度观察,可得出抑郁症造模成功;酸枣仁汤低,中剂量组,得分均高于模型组,有显著性差异(P<0.05),酸枣仁汤高剂量组和氟西汀组,得分均明显高于模型组,差异极其显著(P<0.01),结果见表3。
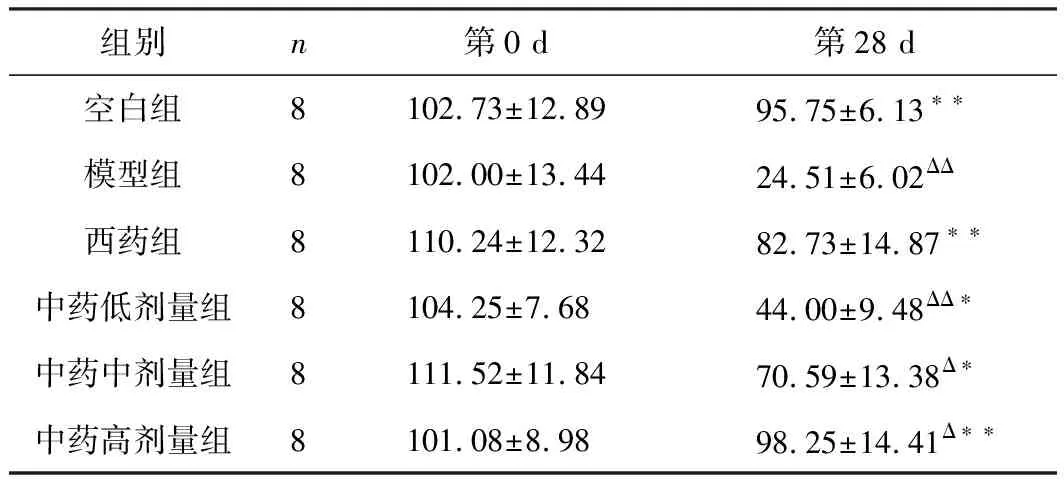
组别n第0 d第28 d空白组8102.73±12.8995.75±6.13∗∗模型组8102.00±13.4424.51±6.02ΔΔ西药组8110.24±12.3282.73±14.87∗∗中药低剂量组8104.25±7.6844.00±9.48ΔΔ∗中药中剂量组8111.52±11.8470.59±13.38Δ∗中药高剂量组8101.08±8.9898.25±14.41Δ∗∗
注:和模型组比较,*P<0.05,**P<0.01;和空白组比较,ΔP<0.05,ΔΔP<0.01。
3.5 酸枣仁汤对大鼠海马CaMK Ⅱ蛋白表达水平的影响
实验结果显示,与空白组比较,模型组大鼠海马CaMK Ⅱ表达水平有显著性差异(P<0.05);与模型组相比,氟西汀组、酸枣仁汤低、中、高剂量组大鼠海马CaMK Ⅱ表达水平无显著性差异(P>0.05)。结果见表4。

组别n相对表达量(CaMKⅡ/β-actin/100%)空白组42.89±0.78∗模型组41.60±0.51Δ西药组42.03±0.82中药低剂量组42.49±0.91中药中剂量组41.83±1.51中药高剂量组31.39±0.74
注:和模型组比较,*P<0.05;和空白组比较,ΔP<0.05。
各组大鼠海马CaMK II蛋白条带印迹的比较,结果显示:模型组大鼠海马CaMK II蛋白的表达条带较正常对照组大鼠明显变细,表明CaMK II蛋白表达减少;与模型组相比,氟西汀及酸枣仁各剂量治疗组的蛋白条带明显变粗。中药高剂量组蛋白条带粗于中药中剂量组;中药中剂量组蛋白条带粗于中药低剂量组。结果见图1。
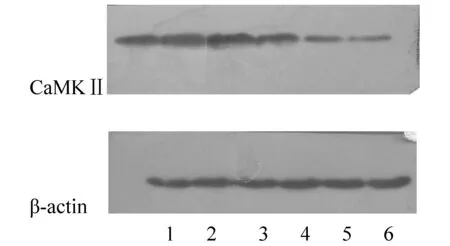
注:1:模型组;2:正常对照组;3:氟西汀药组;4:中药低剂量组;5:中药中剂量组;6:中药高剂量组。 图1 各组大鼠海马中CaMKⅡ蛋白表达
3.6 酸枣仁汤对大鼠海马CaMK ⅡmRNA表达水平的影响
RT-PCR方法检测CaMK ⅡmRNA,实验结果显示,空白组表达量以1为基准,与空白组比较,模型组大鼠海马CaMKⅡ表达水平有显著性增高(P<0.05);与模型组相比,氟西汀组、酸枣仁汤中、高剂量组大鼠海马CaMKⅡ表达水平下降,有显著性差异(P<0.05)。结果见表5,图2。
4 讨论
CaMK II是一种在脑组织尤其是海马内高度表达的蛋白酶,在神经可塑性及记忆形成中具有重要的作用,是神经元内最重要的Ca2+受体蛋白,并且直接参与神经元的应激和修复过程[4-8]。大脑海马区属于脑区的边缘系统,与学习、行为、情绪控制密切相关,也是应激损伤的主要器官。当CaMK II缺乏时可引起环磷酸腺苷/环磷酸鸟苷平衡失调,慢性刺激造成海马神经元损伤,引起结构和功能的改变,影响长时程增强效应(LTP效应),从而影响学习及记忆功能、情绪等方面的改变[9-10]。所以,CaMK II是神经细胞的保护因子,是抑郁症及抗抑郁治疗机制中重要的途径,并在学习及记忆功能方面发挥重要作用。


组别n相对表达量(2-△△CT)空白组41模型组41.97±1.10Δ西药组40.28±0.08∗中药低剂量组40.73±0.25中药中剂量组40.41±0.11∗中药高剂量组40.32±0.09∗
注:和模型组比较,*P<0.05;和空白组比较,ΔP<0.05。
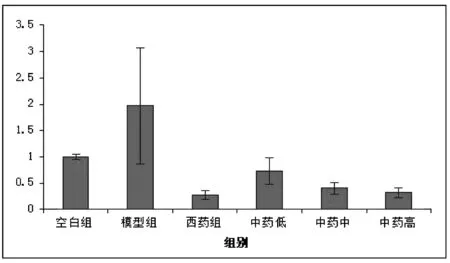
图2 各组大鼠CaMKⅡ mRNA水平比较
CaMK Ⅱ是突触后致密物的重要组成部分之一,作用底物广泛的丝氨酸/苏氨酸磷酸化蛋白激酶,占其蛋白总量约20%~30%。大多数具有激酶活性的蛋白分子在组织中的表达量都相对较低,所以CaMKⅡ在神经系统中高度表达必然具有其特殊意义。在信息传递中起关键的作用,对治疗抑郁症及预防抑郁症发生的发病机制起重要作用。CaMK Ⅱ的功能失调与许多疾病发生有关,如抑郁症、阿尔茨海默症和癫痫等[9-12]。抗抑郁药慢性起效的生物学机制包括神经突触重塑的过程,CaMK Ⅱ蛋白可能通过参与CaM信号传导通路调节神经可塑性,参与抑郁症的发生。同时,CaMK Ⅱ是CaMK通路中重要的调控指标,Ca2+/CaM是主要激活CaMK Ⅱ的信号分子,促使CREB磷酸化,调节下游基因转录,CaMK在钙信号转导通路中起着轴心的作用。其不但受CaM的活化,而且受各种蛋白激酶的调节,蛋白激酶的磷酸化和去磷酸化是CaMK活化的开关。CaMK磷酸化可以进一步活化谷氨酸受体,活化其他离子通道,从而改变神经元的兴奋性,活化下游的CREB以调节某种蛋白的合成。改变神经元的形态、突触的数量以及结构。在突触可塑性和学习中发挥着关键作用[13-15]。在脑组织中,CaMK Ⅱ蛋白及基因的上调,提高了信号转导通路活性,是治疗抑郁症的重要作用机制之一。
本研究结果显示,抑郁症模型组大鼠在旷场实验中垂直水平总得分亦明显低于对照组,强迫游泳实验中的不动时间也明显长于对照组,说明大鼠在慢性应激环境下,自主活动明显减少。模型组大鼠海马组织中CaM、 CaMK II蛋白及基因表达水平低于对照组,说明这些关键分子参与了抑郁症行为学改变和神经元损伤的发生发展。RT-PCR实验结果显示,酸枣仁汤能降低模型组大鼠海马CaMKⅡ的mRNA表达,提示其抗抑郁作用可能与抑制海马神经元细胞凋亡,减少脑损伤有关。有研究表明CaMK Ⅱ可能通过参与钙调蛋白通路调节神经可塑性,参与抑郁症的发生。实验结果表明酸枣仁汤可能对慢性应激导致抑郁的大鼠有一定的治疗作用。 Western-blot实验结果显示,CaMK II蛋白表达无显著性差异,据分析可能存在实验条件下蛋白表达的时间不够充分,因此未能显示出差异。
酸枣仁汤治疗28天后,大鼠在强迫游泳实验的不动时间也明显缩短,说明酸枣仁汤能增进抑郁症大鼠空间学习和记忆能力,改善活动度和绝望状态;大鼠海马组织中CaM、CaMK II蛋白和CREB mRNA表达水平升高,说明酸枣仁汤有抗抑郁效应,其机制可能与激活海马组织中 CaMK Ⅱ基因表达,进而促进 CaMK Ⅱ蛋白磷酸化,最终达到预防及治疗抑郁证的作用。

