美金刚调控Limk抑制MCAO大鼠Cofilin Rod生成从而减轻脑缺血损伤
陈 斌,高兆鹤,游小芳,林晗莹,王 晶,林万庆
目前,中国每年新发脑卒中患者已有250万人[1]。缺血性卒中(ischemic stroke)约占全部脑卒中的80%[2,3]。2014年我国的脑梗死住院费用为470.35亿元[4]。脑卒中不仅严重危害人类的生命健康,而且给社会造成巨大的经济负担。因此,缺血性脑卒中的有效治疗仍然是目前医疗领域研究急需探索的重点项目之一。美金刚(Memantine)是一种具有电压依赖性、中等程度亲和力的非竞争性NMDA受体拮抗剂[5]。较其他的非竞争性NMDA受体拮抗剂,如地卓亚平马来酸盐(dizocilpine maleate)具有更快的脱靶率,且对NMDA受体亲和力低,具有更快的阻滞/解离药物动力学特点,以及类似于Mg2+对NMDAR生理学阻滞作用的电压依赖性的特点,这些阻滞特点使Memantine主要对病理性升高的NMDAR发生阻滞,而不影响NMDAR的正常生理功能[6]。近来的研究表明,Memantine不仅在AD、血管性痴呆、帕金森病和神经性疼痛等神经系统性疾病的基础和临床研究中显示出明显的神经保护作用,而且在脑卒中的基础研究中也显示出良好的效果[7,8]。同时,Memantine治疗缺血性卒中的临床试验目前也正在进行中(clinical trials.gov identifier:NCT02144584)。但Memantine治疗脑缺血损伤的主要分子机制尚不明确,有待进一步阐明。故本研究选用大鼠大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型,探讨Memantine对MCAO大鼠可能的神经保护机制,为Memantine的临床治疗提供一定的理论依据。
1 材料与方法
1.1 实验动物分组 选取体重为(260±15)g的SPF级雄性SD大鼠36只(上海斯莱克实验动物责任有限公司),饲养于福建中医药大学动物实验中心,恒温恒湿控制,12 h~12 h昼夜循环光照,并且给予自由饮食与饮水。使用随机数字表将其分为:假手术组(Sham)、生理盐水组(Saline)及美金刚组(MEM),每组12只。所有试验均按照国际动物保护和使用指南的相关规定严格实施。
1.2 主要试剂和仪器 BCA试剂盒(Thermo Fisher,23227),ECL试剂盒(Thermo Fisher,32109)。一抗:MAP2(Sigma,M4403),Cofilin(Cytoskeleton,ACFL02),GAPDH(Gene Tex,GTX100118),Limk(CST,3842),p-Limk(CST,3841S),p38(Santa cruz,sc-7973),p-p38(Santa cruz,sc-535)。二抗:Alexa Fluor 555 anti-mouse IgG(A31570),Alexa Fluor 488 anti-rabbit IgG(A21206)均购于Invitrogen公司。仪器:SMZ445体视显微镜(Nikon,Japan),LDF100C激光多普勒(Biopac Systems,USA),CM1950冰冻切片机(Leica,Germany),BX58正置荧光显微镜(Olympus,Japan),A1R激光共聚焦系统(Nikon,Japan)。
1.3 动物模型制备 大鼠MCAO模型参考Zea Longa法制备[9],具体方法如下:SD大鼠术前均禁食但不禁水8 h,在22 ℃室温下,2%异氟烷对大鼠进行麻醉,置于俯卧位行固定、消毒后,分离软组织暴露颅骨。应用激光多普勒(LDF100C,Biopac Systems,Goleta,CA)检测脑血流,待血流值稳定后,记录5 min,作为血流基准值。然后,在显微镜下分离左侧颈总动脉(common carotid artery,CCA)、颈内动脉(internal carotid artery,ICA)及颈外动脉(external carotid artery,ECA)(见图1A)。依次结扎CCA近心端、以及ECA与ICA远心端,并在ECA上近分叉处约2 mm处剪一“V”型小口,将已消毒好的尼龙线栓(硅胶包被)经ECA插入ICA,直至有少许阻力感时,从ECA与ICA分叉处起计算插入17~17.5 mm,若脑血流降低80%以上,则表明尼龙线栓成功地阻断了大脑中动脉的血流(见图1B、C)。随后伤口常规缝合与消毒,待缺血1 h后拔出尼龙线栓,使血流再通。试验过程和动物苏醒期间使用恒温加热垫进行保温,维持肛温在37 ℃左右。假手术组大鼠只分离动脉,不结扎和插线。
1.4 药物干预措施 (1)美金刚(Memantine)组:分别于术后5 min给予腹腔注射20 mg/kg的Memantine药物(4 ml/kg),12 h后再给予1 mg/kg的Memantine以维持脑内1~10 μmol的浓度,24 h后处死动物取材;(2)生理盐水(Saline)组:药物对照组则注射同等剂量的生理盐水,其余与Memantine组一样;(3)假手术(Sham)组:注射同等剂量的生理盐水,不予其他任何干预措施。
1.5 检测方法及指标 (1)神经行为学评分:采用Zea Longa神经功能评分方法[9],具体评分标准为:0分,无神经功能缺损体征;1分,提尾时偏瘫侧前肢不能完全伸展;2分,向偏瘫侧转圈;3分,行走时向偏瘫侧倾倒;4分,不能自发行走,意识丧失;5分,死亡。若伴下列情形之一者将不纳入最终的统计分析:①未到取材时间点便死亡者;②取脑时若观察到蛛网膜下腔出血者;③脑组织形态学检测未发现缺血性病理改变者。(2)免疫荧光染色法(immunofluorescence):干预结束后,腹腔注射10%水合氯醛麻醉大鼠,经左心室依次灌注生理盐水和4%多聚甲醛(PFA)溶液各200 ml,使动物呈现出四肢僵硬状态,随后取脑浸泡于4%PFA中进行后固定。12 h后使用不同梯度的蔗糖进行脱水,包埋,切片。染片前,将冰冻切片于室温放置30~45 min,PBS冲洗3次,每次5 min;然后,使用98%甲醇(预冷)破膜3 min,PBS冲洗3次,每次5 min;接着,10%驴血清行封闭60 min;一抗4 ℃冰箱过夜,复温后PBS冲洗3次,每次5 min;二抗(10%驴血清稀释)Alexa Fluor 555/488室温,湿盒中避光室温孵育1 h,PBS冲洗3次,每次5 min;ProLong gold antifade reagent抗荧光淬灭剂封片凝固后,拍摄分析。(3)蛋白免疫印迹法(Western blot):干预结束后,腹腔注射10%水合氯醛麻醉大鼠,将脑组织按照一定部位分离,于液氮内低温保存,以备后续提取蛋白。将脑组织从-80 ℃冰箱取出后,按照350 μl /10 mg的比例添加裂解液提取蛋白质。BCA法测定所提出的蛋白质浓度,95 ℃加热变性,每次取30 μg组织样本进行SDS-PAGE凝胶电泳和转膜。室温条件下,5%的脱脂牛奶封闭60 min,一抗4 ℃过夜孵育,TBS洗涤5次,每次10 min;辣根过氧化物标记的二抗振荡孵育2 h,TBS洗涤5次,每次10 min;ECL化学发光法显色,并采用Bio-Image Analysis System(Bio-Rad,Hercules,CA,USA)显影成像与分析。
2 结 果
2.1 美金刚改善脑缺血大鼠的神经缺损症状 为了确定Memantine对缺血性卒中的神经保护作用,在缺血性卒中后24 h测量MCAO大鼠神经功能缺损得分和脑梗死体积。检测结果显示,Saline组和Memantine组的神经功能缺损得分分别为(2.2±0.2)(n=12)和(1.7±0.1)(n=12),表明Memantine显著改善MCAO模型的神经系统行为学症状(P<0.05)(见图2)。
2.2 美金刚减小脑缺血大鼠的脑梗死体积 微管相关蛋白(Microtubule associated protein,MAP2)主要在神经元细胞树突和胞体中表达,可以用来评价脑缺血中神经元损伤的程度,在受缺血影响的脑区观察到MAP2的表达量明显减少[10]。用Memantine(20 mg/kg,ip)处理的MCAO大鼠的脑梗死体积从Saline组(生理盐水处理)的(49.9±4.3)%(n=5)显著降低至(35.5±2.5)%(n=6)(P<0.05)。梗死体积的减少与MCAO后24 h的神经学改善密切相关。与以前的报道一致[11~14],这些数据表明Memantine对体内缺血性卒中的治疗有一定的功效(见图3)。
2.3 美金刚抑制脑缺血大鼠皮质梗死区Rod的形成 丝切蛋白(Cofilin)是中枢神经系统肌动蛋白解聚因子家族重要成员之一,负责调控肌动蛋白丝的动力学和重组[15]。在之前的研究中,我们已经观察到在MCAO大鼠的梗死皮质中有Cofilin与Actin共同形成的Rod棒状结构,其逐渐诱导微管相关蛋白-2(MAP2)降解和细胞凋亡。我们使用Cofilin的特异性抗体对脑组织切片进行免疫荧光染色,其实验结果表明,电针治疗可以部分抑制皮质缺血区中Rod结构的形成(Area 2:Saline:122.5±44.5/mm2,MEM:11.7±4.6/mm2,P<0.01;Area 3:Saline:275.6±86.7/mm2,MEM:47.2±12.7/mm2,P<0.01;Area 4:Saline:325±68.5/mm2,MEM:108.1±8.7/mm2,P<0.05;Area 5:Saline:432.1±49.3/mm2,MEM:205.1±51/mm2,P<0.05;Area 6:Saline:445.1± 43.7/mm2,MEM:258.5±51/mm2,P<0.05),但对核心区(Area 7和8)并没有影响(见图4)。
2.4 美金刚促进脑缺血大鼠皮质梗死区p-Limk的表达 Cofilin Rod的形成主要是由于去磷酸化的Cofilin含量增加引起的,Cofilin的去磷酸化是其活化形式,而磷酸化的Cofilin则是其失活形式。Cofilin主要受到Limk介导的磷酸化调节而失活[16,17]。为了进一步明确Cofilin参与Memantine诱导的神经保护作用,本研究接下来检测p-Limk/Limk在脑缺血皮质中的表达情况。Western blot数据显示:与假手术组相比,在MCAO大鼠缺血皮质中Limk的表达无显著性差异,p-Limk的表达则下调[Sham:(100±13.5)%,n=6;Saline:(24.6±3.2)%,n= 6;P<0.01]。然而,Memantine干预显著促进MCAO大鼠缺血皮质中p-Limk的表达[MEM:(92±22.3)%,n=6;Saline:(24.6±3.2)%,n=6;P<0.05],从而抑制Cofilin Rod的生成。由此证明Memantine在调节缺血性卒中后的Cofilin去磷酸化方面起重要作用(见图5)。
2.5 美金刚抑制脑缺血大鼠皮质梗死区p-p38的表达 P38丝裂原激活蛋白激酶(p38 mitogen activated protein kinase,p38 MAPK)作为众多信号转导通路的中转站,其激活在细胞凋亡等过程中扮演着重要的角色。本研究通过Western blot检测p-p38/p38在脑缺血皮质中的表达情况。统计分析结果显示:与假手术组相比,在MCAO大鼠缺血皮质中p38的表达无显著性差异,p-p38的表达则显著升高[Sham:(100±9.52)%,n=6;Saline:(297.17±8.25)%,n=6;P<0.001]。然而,Memantine干预显著降低MCAO大鼠缺血皮质中p-p38的表达[MEM:(163.39±11.91)%,n=6;Saline:(297.17±8.25)%,n=6;P<0.001]。由此提示Memantine干预可通过调控缺血性卒中后p38的磷酸化,从而减轻MCAO大鼠脑损伤(见图6)。
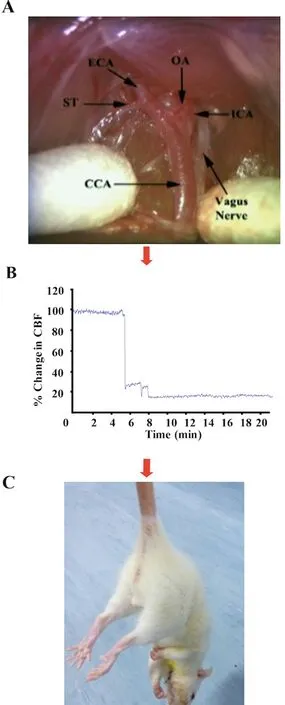
图1 大鼠MCAO模型示意图

注:Saline:生理盐水组;MEM:美金刚组。生理盐水组与美金刚组对比#P<0.05
图2 美金刚干预MCAO大鼠24 h后神经功能缺损评分

注:A.为MCAO大鼠干预24 h后的脑组织,其中黑色虚线表示的是梗死边缘;B.为不同层面脑组织的微管相关蛋白(MAP2)免疫荧光染色;C.为脑梗死体积的百分率统计。生理盐水组与美金刚组对比#P<0.05
图3 美金刚干预MCAO大鼠24 h后脑梗死体积变化情况

注:A.皮质梗死区Rod分析过程中不同区域(8个)划分示意图;B.不同区域丝切蛋白(Cofilin)免疫荧光染色,其中Rod结构如a和b中白色箭头指示;C.不同区域Rod数量的统计。生理盐水组与美金刚组对比#P<0.05,##P<0.01
图4 美金刚干预MCAO大鼠24 h后皮质梗死区Rod的形成情况

注:Western blot法检测相关蛋白的表达。生理盐水组与假手术组对比**P<0.01;美金刚组与生理盐水组对比#P<0.05
图5 美金刚干预MCAO大鼠24 h后脑梗死皮质中p-Limk/Limk的蛋白表达情况

注:Western blot法检测相关蛋白的表达。生理盐水组与假手术组对比***P<0.001;美金刚组与生理盐水组对比###P<0.001
图6 美金刚干预MCAO大鼠24 h后脑梗死皮质中p-p38/p38的蛋白表达情况
3 讨 论
NMDA受体主要由NR1(必要组成),NR2和/或NR3亚基组成。其四聚体形式可分为胞外N末端,胞内的C末端,离子通道形成的跨膜段和胞外激动剂结合段4个部分。NMDA受体的内源性激动剂有Glu和天冬氨酸,结合在NR2的胞外激动剂结合段,此外,还依赖于共同激动剂甘氨酸(Glycine)或者丝氨酸(D-serine),结合在NR1亚基。NMDA受体的生理功能与其在细胞膜上的分布和定位有着密切的关系。NR2A亚基主要分布在突触内的NMDA受体中,而NR2B主要存在于突触外受体中。有证据表明,突触外NR2B的过度激活可能有助于神经毒性的,而突触内NR2A可能是具有神经保护性的作用。由NMDA受体过度活化引起的神经毒性是缺血性卒中后神经元细胞凋亡的主要原因之一。因此,NMDA受体已被建议作为潜在的治疗靶点[6,18,19]。虽然已经发现多种NMDA受体拮抗剂在脑卒中动物模型中具有神经保护作用[20~22],但之前的临床试验所获得的成功却是有限的。主要原因有:脑卒中狭窄的治疗时间窗口,临床上不可耐受的副作用,不严谨的临床试验设计,甚至是缺乏疗效[23~25]。
NMDA受体是配体和电压门控共同调节的双门控离子通道,对中枢神经系统中生理性和病理性活动都是必需的。之前的NMDA受体阻滞剂可能在阻断Glu兴奋性毒性作用的同时,也阻断了其正常生理功能的发挥[20,26,27],以致于临床应用的失败[28]。为了在临床上能够被接受,抗兴奋性毒性药物必须阻断NMDA受体的过度激活,同时保持正常的突触活性以避免副作用。最近的基础和临床研究数据表明,Memantine是用于治疗脑卒中,减轻脑组织损伤的一种有效可行的药物[29~33]。Memantine是具有低亲和力/快速解离速率的非竞争性NMDA受体拮抗剂,具有优先阻断高于正常生理水平的病理水平的Glu的潜力。此外,Memantine仅在离子通道开放时选择性地结合到与NMDA受体Mg2+阻滞位点相重叠的位点,并且一旦离子通道关闭,它就迅速从受体中解离[34~36]。由于这些性质,Memantine可以阻断过度升高的NMDA受体活性,而不积累在离子通道中以影响NMDA受体正常的生理功能,这可以解释在使用Memantine治疗的患者中副作用是有限的[20,33,37]。在本研究中,我们采用Zea Longa线栓法建立MCAO局灶性脑缺血模型,发现MCAO大鼠缺血后立即给予Memantine可以明显减轻神经功能缺陷症状和脑梗死体积。此结果与其他实验室的工作是一致的,包括缺血前给药及缺血后2 h内施以Memantine药物干预[11~13,31]。
Cofilin是肌动蛋白结合蛋白,受LIMK介导的磷酸化而失活,Cofilin的去磷酸化是其活化的形式[38,39]。越来越多的证据表明,不同神经毒性刺激,可通过增加Cofilin的去磷酸化(激活),抑制Cofilin的磷酸化(失活),诱导活化的Cofilin和Actin形成Rod结构[40~44]。有报道表明[10,42],MAP2结构的完整性会被Cofilin Rod的产生所破坏。为进一步揭示Memantine的治疗作用机制,本研究通过Cofilin荧光染色结果显示(见图4),Memantine可明显抑制MCAO大鼠脑缺血皮质区Cofilin Rod的生成,尤其是在缺血半暗带。同时,Western blot数据显示(见图5),Memantine可通过促进p-Limk的表达,抑制Cofilin的去磷酸化,从而减少Rod结构的生成。脑缺血损伤会导致p38 MAPK的激活,触发了下游凋亡途径,引起Bcl-xL、Bax和AIF等凋亡因子的过度表达,从而引起缺血神经元细胞的凋亡。而Jie等研究指出[45],抑制p38 MAPK的作用能够有效地保护神经细胞免受缺血再灌注损伤[46]。另外,研究报道了谷氨酸介导的神经脑组织的p38 MAPK激活,p38 MAPK信号级联的选择性抑制为脑缺血再灌注损伤提供了一定的神经保护作用[47]。本研究中,Memantine是一种非竞争性NMDA受体拮抗剂,抑制谷氨酸能系统过度激活,从而降低p38 MAPK信号通路的活化。
综上所述,NMDA拮抗剂Memantine能够通过调控脑缺血皮质区p-Limk的表达,抑制Cofilin Rod的形成,降低p-p38的表达,从而改善MCAO大鼠的神经功能缺损症状和脑梗死体积。这些结果为Memantine具有减少Rod生成和保护缺血后脑损伤的作用提供了一定的分子基础,表明Memantine可能是治疗缺血性卒中的潜在药物[48],但我们仍需要更多的研究来证明这一观点。

