急性孤立性双侧小脑中脚梗死1例报告并文献复习
杨紫茜,张 雷,傅 蓉,杨 薇
小脑中脚(MCP)由对侧脑桥核发出的白质纤维组成,是皮质小脑通路的一部分。MCP由多条血管供血,该区域梗死并不常见,而孤立性双侧MCP梗死则更为罕见。本文报道1例孤立性双侧小脑中脚梗死病例的诊治经过,结合文献资料简要探讨孤立性双侧小脑中脚梗死的病因、发病机制、诊断及治疗。
1 病例资料
患者,男性,54岁,因“头晕5 d,走路不稳11 h”于2019-03-21入院。患者入院前5 d无明显诱因出现头晕,天旋地转感,于平卧后可缓解,但仍有头昏沉感,坐位及站立时加重。伴恶心,呕吐胃内容物数次,无头痛、耳鸣、听力下降、视物双影。入院前11 h患者出现站立及行走不稳。急诊行头部核磁(见图1)以双侧小脑中脚梗死收入院。入院后出现言语不清,对语言的理解力正常。病程中偶伴饮水呛咳、左侧偏身麻木(既往存在)。既往:高血压病史15 y,血压最高达180/110 mmHg,平素规律口服“硝苯地平缓释片20 mg/d,替米沙坦片 80 mg/d”,自诉血压控制可;脑梗死病史12 y,遗留双下肢活动不灵、左侧偏身麻木,尚可独立行走。吸烟、饮酒史多年。入院查体:血压135/100 mg,意识清楚,构音障碍。双眼各方向活动正常,双眼向左右注视可见细小水平眼震。悬雍垂居中,双侧咽反射消失。双下肢肌张力增高,肌力3级,双上肢肌张力、肌力正常。双侧指鼻试验欠稳准,双侧快速轮替试验笨拙,双侧跟膝胫试验、姿势步态及昂白征查体不能配合。左侧偏身痛觉减退,四肢腱反射活跃,双侧病理征阳性,脑膜刺激征阴性。辅助检查:低密度脂蛋白胆固醇2.47 mmol/L;尿常规、生化检查,未见明显异常。心电图未见异常。头部核磁示双侧小脑中脚对称性类圆形长T1、长T2、DWI高信号、ADC低信号(见图1)。头部MRA示基底动脉局部重度狭窄(见图2)。颈、胸、腰椎检查未见髓内异常信号。诊断:小脑中脚梗死、高血压病3级(极高危)、基底动脉狭窄(重度)。入院后给予双抗、调整高血压药物至单用替米沙坦片40 mg/d口服,收缩压控制在150~160 mmHg,抗动脉粥样硬化、改善循环、神经保护等治疗。药物治疗6 d后,患者自觉头晕症状较前加重,行头部CT示双侧小脑中脚对称性低密度影,复查头部核磁弥散示双侧小脑中脚对称性类圆形高信号,面积较前扩大(见图2),将阿司匹林加量至200 mg/d口服。药物治疗14 d后,行脑DSA检查及血管内治疗:前循环及右侧椎动脉未见明显血管狭窄,左侧椎动脉造影示左侧椎动脉(VA)V4段、椎基底动脉交汇处重度串联狭窄,左侧小脑前下动脉(AICA)与同侧小脑后下动脉(PICA)吻合,侧支循环开放;支架置入后两处狭窄显影充分,无残余狭窄,左侧AICA近端轻度狭窄,且左侧AICA的PICA侧支充盈程度明显降低,右侧AICA显影充分(见图3),患者头晕明显缓解。随访3 m,患者头晕症状消失,言语不清较前明显好转,可拄拐行走。
2 讨 论
MCP位于AICA及小脑上动脉(SCA)支配分水岭区,大部分由AICA供血,还受与AICA末端吻合的SCA供血[1,2]。AICA多由基底动脉下半部分发出,近端支配脑桥下外侧区(ILP),包括三叉、展面及前庭蜗神经的神经根及神经核,在跨过前庭蜗神经后分为两支,分别支配小脑中脚、小脑前下部及绒球,其终末支分别与SCA、小脑后下动脉(PICA)边缘支吻合,同时,AICA也是内听动脉(IAA)的来源,支配耳蜗及前庭迷路[3]。AICA梗死的临床表现包括眩晕、眼震、构音障碍、病灶侧面部感觉减退、周围性面神经麻痹、听力受损、共济失调、霍纳综合征及对侧肢体和躯干浅感觉减退[4]。
MCP是AICA支配的核心区域,易受缺血损伤,被认为是AICA梗死的放射学标志[3]。Roquer等[3]根据AICA供血区梗死的MRI特点将其分为4个类型:(1)完全性AICA供血区梗死,包括MCP、ILP,累及或未累及小脑;(2)孤立的MCP梗死;(3)孤立的ILP梗死;(4)双侧AICA供血区梗死。这种形态学上的异质性可能是由AICA的解剖结构和解剖变异造成的。Chen[4]将这些变异归纳为以下几种:(1)正常AICA解剖:即同上述所说,包括近端及内外侧支;(2)完全的远端发育不全,代之以代偿性肥大的SCA及PICA分支;(3)外侧支退化,由PICA支配其供血区;(4)重复AICA(duplicated AICA)孤立性MCP梗死并不常见,仅占急性脑梗死的0.12%,而孤立性双侧MCP梗死则更为罕见[2]。
双侧MCP梗死的病因、发病机制目前尚未完全明确。结合目前的文献报道,双侧MCP梗死多存在椎-基底动脉严重狭窄或闭塞[2,5],Kataoka[1]则报道了1例优势侧椎动脉C1至枕骨大孔段闭塞导致孤立性双侧MCP梗死病例。目前普遍认为的双侧MCP梗死病因,按TOAST分型为大动脉粥样硬化,即椎-基底动脉粥样硬化;对于发病机制,认为主要是在椎-基底动脉狭窄基础上低灌注导致AICA与SCA分水岭区灌注不足,除此之外还有基底动脉粥样硬化斑块伴或不伴血栓形成阻塞双侧AICA起始处、动脉到动脉的易损斑块栓塞双侧AICA[1,2,5],而John[2]认为后者发生的可能性较小。本例患者血管造影结果显示,左侧VA(V4段)、椎基底动脉交汇处重度串联狭窄,狭窄处支架置入、血管再通后双侧AICA通畅且显影充分,未见AICA解剖变异,除外动脉粥样硬化斑块或血栓阻塞双侧AICA可能,考虑患者发病机制为在椎-基底动脉重度狭窄基础上低灌注所致双侧AICA和SCA供应的分水岭区灌注不足。虽然患者发病前无明显低灌注诱因,但结合患者平素口服两种降压药物,不能除外患者发病前存在血压过度下降可能。患者入院后嘱其将降压药物减量,同时给予双抗、抗动脉硬化及其他脑梗死相关治疗,但患者病情仍然进展,复查头部核磁弥散示双侧MCP梗死面积较前增大,考虑到药物治疗疗效欠佳及基底动脉狭窄可进展为急性闭塞,致死率高,给予行DSA检查及血管内介入治疗后病情缓解。目前双侧MCP梗死的治疗主要以抗血小板聚集、抗凝及对症治疗为主[5],而常规血管内介入治疗缺乏足够的证据。一项多中心随机对照临床实验SAMMPRIS实验表明,在颅内动脉狭窄患者中,与积极的药物治疗相比,经皮血管内形成术和支架术(PTAS)没有表现出长期获益,相反具有更高的围手术期卒中及死亡率[6]。而Maier等[7]通过对症状性基底动脉狭窄亚组患者的回顾性分析表明,PTAS患者复发性卒中及再狭窄的风险显着降低,该结果仍有待前瞻性临床研究证实。Dong等[5]统计了1991年-2016年间16例双侧MCP梗死病例,仅1例在行抗血小板及抗凝治疗后病情仍然恶化情况下行血管内支架置入治疗[8],随访6 m后,该患者部分症状及体征缓解。同时,其报道的4例双侧MCP梗死病例(累及或未累及其他AICA供血区),其中2例患者接受血管内介入治疗后症状明显改善,且总体预后较未接受支架治疗预后好。刘恋等[9]对颅内椎-基底动脉慢性闭塞(VBAO)的介入开通治疗研究认为,VBAO开通后,因低灌注导致临床症状的患者会从血管开通中获益,而单纯因脑梗死导致临床症状的患者则开通效果欠佳。本病例血管内支架术后患者症状明显改善,为双侧MCP梗死及症状性基底动脉狭窄的血管内介入治疗提供了一个良好临床资料,也从侧面再次证明其低灌注的发病机制。此外,多种疾病均可表现出磁共振成像上双侧MCP异常信号,除脑血管病外,尚有脑桥梗死或出血后的华勒氏变性、脱髓鞘和炎性疾病、神经系统变性病、感染中毒代谢性疾病等[10],需通过与病史、临床表现及血管影像结合作出正确的诊断及治疗。
综上,本文对双侧MCP梗死的病因、发病机制、诊断及治疗作了简要探讨,椎-基底动脉狭窄基础上的低灌注为其主要发病机制,故治疗过程中不能盲目降压。本病例显示药物联合基于病因的血管内介入治疗能有效改善患者临床症状,但双侧MCP梗死的血管内介入治疗的疗效及长期预后仍有待更多的临床资料来证明。

图1 a:T1WI示双侧小脑中脚类圆形低信号;b~d:T2WI、FLAIR、DWI示双侧小脑中脚类圆形高信号;e:ADC示双侧小脑中脚类圆形低信号

图2 a:头部CT示双侧小脑中脚类圆形低密度影;b:DWI示双侧小脑中脚类圆形高信号,面积较前扩大;c:ADC示双侧小脑中脚类圆形低信号;d 头部MRA示基底动脉局部重度狭窄(黑色箭头),右侧AICA显影(白色箭头),左侧AICA未显影
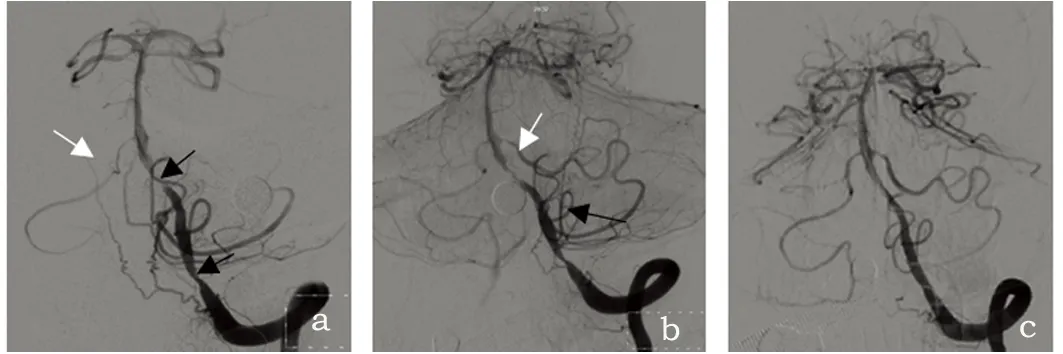
图3 左侧椎动脉造影:a:左侧VA(V4段)、椎基底动脉交汇处重度串联狭窄(黑色箭头),右侧AICA显影浅淡(白色箭头),左侧AICA未显影;b:左侧AICA(白色箭头)与同侧PICA(黑色箭头)吻合,侧支循环开放;c:架置入后:两处狭窄显影充分,无残余狭窄,左侧AICA近端轻度狭窄,且左侧AICA的PICA侧支充盈程度明显降低,右侧AICA显影充分

