长链非编码RNA核仁小分子RNA宿主基因1对胃癌细胞增殖和侵袭的影响
武秋林 张建
(河南卫生干部学院,河南 郑州 450008)
胃癌发病率居于第4位〔1〕,在由癌症引起的死亡中排名第2,且随着年龄的增长其发病率呈上升趋势,在65岁以上人群中发病率高达28.5%〔2〕。由于缺乏有效的早期诊断工具,多数胃癌患者一经发现即已处于晚期状态,同时伴随转移发生,预后不容乐观〔3〕。长链非编码(lnc)RNA是一类长度超过200个核苷酸,但无编码蛋白功能的RNA〔4〕。lncRNA常被认为是基因转录时的“噪音”,随着研究的深入,越来越多的研究证实异常表达的lncRNA和肿瘤的发生、迁移及预后密切相关〔5~7〕。lncRNA参与多种生物功能活动,如细胞分化、自噬、凋亡等。最新的研究发现lncRNA在一些恶性肿瘤中异常表达,甚至可作为原癌基因或抑癌基因而发挥作用〔8〕。核仁小分子RNA宿主基因(SNHG)1是一种新型的lncRNA,主要定位于细胞质。研究显示,SNHG1在肿瘤发生发展中发挥重要的作用,在肺癌、肝癌、前列腺癌、结直肠癌等多种肿瘤中高表达并发挥着潜在的致癌基因角色〔9~11〕。SNHG1在胃癌中的表达情况及对胃癌细胞生物学行为的影响目前仍缺少相关报道。本研究探讨SNHG1在胃癌细胞中的表达情况及对胃癌细胞增殖、侵袭能力的影响。
1 材料和方法
1.1细胞系 人胃癌细胞株SGC7901和BGC823及人正常胃上皮细胞NGEC购自中国科学院上海生命科学院细胞资源中心。复苏SGC7901和NGEC细胞,采用含10%胎牛血清(FBS)及100 U/ml青霉素和0.1 mg/ml 链霉素的RPMI1640培养基培养;复苏BGC823细胞,采用10% FBS及100 U/ml 青霉素和0.1 mg/ml链霉素的DMEM培养基培养。细胞置于含5%二氧化碳、37℃细胞培养箱中扩增培养,生长至培养瓶底面覆盖率80%~90%(即细胞处于对数生长期)时,使用0.25%胰酶-乙二胺四乙酸(EDTA)消化液消化传代,用于后续实验。
1.2主要试剂 RPMI1640、DMEM和无血清培养基(opti-MEM)购于美国Gibco公司,FBS购于美国GIMINI公司;胰酶、青-链霉素双抗购于碧云天生物技术有限公司;对照序列的小干扰RNA(si-NC)和SNAG1的小干扰RNA(si-SNHG1)等所引物均由上海生工生物工程有限公司设计并合成;Trizol试剂购于美国Invitrogen公司;RNA逆转录试剂盒和荧光定量试剂盒购于美国Applied Biosystems公司;噻唑蓝(MTT)购于Sigma公司;Transwell小室购于BD公司;基质金属蛋白酶(MMP)-2、MMP-9和ki67购于美国Affinity公司。蛋白提取试剂盒、电化学发光(ECL)试剂盒及二喹啉甲酸(BCA)蛋白定量试剂盒购于Thermo公司;β-actin鼠多克隆抗体购于Santa Cruz公司。
1.3胃癌细胞中SNHG1的敲除 si-SNHG1序列:CUUAAAGUGUUAGCAGACATT;si-NC序列:GCG-ACGAUCUGCCUAAGAUTT。待细胞生长至融合度约90%时,消化细胞并计数,将细胞分别接种至6孔板,2×105个/孔。每孔加入2 ml含10% FBS的RPMI1640培养基过夜。转染参照Lipofectamine 2000说明书进行,将lipofectamine 2000和si-RNA分别加入250 μl的opti-MEM中,室温静置5 min后,将两者混在一起并轻轻混匀,室温静置20 min形成siRNA/lipofectamine 2000混合物。弃6孔板中的旧培养基,每孔加入1.5 ml的opti-MEM。吸取500 μl siRNA/lipofectamine 2000混合物逐滴加入孔中,置于细胞培养箱中孵育4~6 h更换为RPMI1640完全培养基。继续培养48~72 h后进行转染后续实验。
1.4细胞中RNA的提取 将SGC7901、BGC823和NGEC细胞分别接种于6孔板中,待细胞处于对数生长期时弃去培养基,用预冷的无菌磷酸盐缓冲液(PBS)清洗2遍。弃净PBS,每孔加入1 ml TRIZOL试剂,反复吹吸数次使细胞脱落并裂解。将液体收集至无RNA酶的1.5 ml离心管中,室温放置5 min。加入200 μl氯仿,剧烈晃动15 s,室温放置3 min。4℃、12 377 r/min离心15 min,将上层水相中的RNA小心吸取转移至另一干净试管。加入0.5 ml异丙醇,室温静置10 min。4℃、12 377 r/min离心10 min后,弃上清,加入1 ml 75%乙醇洗涤沉淀1次,4℃、7 500 r/min离心5 min,弃上清,室温静置干燥沉淀,加入50 ml无RNA酶水,55℃水浴10 min使RNA充分溶解。取2 ml液体用紫外分光光度计测定RNA光密度值(OD),当A260/A280比值处于1.8~2.0时,表明RNA纯度合适,可进行后续实验。
1.5逆转录及实时荧光定量-聚合酶链反应(qRT-PCR) 以上提取的RNA按高容量cDNA逆转录试剂盒(Biosystems,Foster City,CA,USA)说明书,逆转录成cDNA。随后,以cDNA为模板,用SYBR绿荧光染料法(Biosystems,Foster City,CA,USA)检测SNHG1表达水平,SNHG1引物序列为5′-AGGCTGAAGTTACAGGTC-3′(正义)和5′-TTGGCTCCCAGTGTCTTA-3′(反义)。β-actin为内参,引物序列为5′-ACCAACTGGGACGAT-3′(正义)和5′-TACGACCAGAGGCATACAGGGACAA-3′(反义)。选择Ct值处于18~30之间的数据,以2-ΔΔCt计算相对表达量。
1.6MTT法检测细胞增殖能力 收获对数生长期的转染细胞,制备成合适浓度的细胞悬液,分别接种2 500个/孔于96孔板中,设置6个复孔。接种后24 h、48 h、72 h每孔分别加入20 μl 5 mg/ml的MTT,混匀后继续孵育4 h。弃掉培养基,加入二甲基亚砜150 μl/孔,震荡10 min,酶标仪490 nm下检测每孔OD值。
1.7Transwell检测细胞侵袭能力 收获转染48 h的细胞,用opti-MEM制成浓度为2×105个/200 μl的细胞悬液。水化Transwell小室后,在小室下部加入500 μl 10%的FBS培养基,上部加入200 μl细胞悬液,细胞培养箱中培养24 h取出,去除未穿过基质胶的细胞。室温下4%多聚甲醛中固定约30 min,随后置于0.1%结晶紫溶液中染色30 min。PBS清洗2次,室温晾干。显微镜下计数细胞,每个小室5个视野,取平均值。
1.8Western印迹法检测增殖和侵袭标志蛋白 收获转染si-SNHG1和si-NC 72 h的细胞,加入适量RIPA/PMSF裂解液,置于冰上裂解30 min。4℃,12 000 r/min离心15 min,取上清。蛋白上清经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离转移至聚偏氟乙烯(PVDF)膜,10%脱脂奶粉室温下封闭1 h,加入1∶1 000鼠抗人β-actin、ki67、MMP-2、MMP-9。4℃孵育过夜,TBST洗膜10 min,共3次。加入1∶2 000稀释的二抗,37℃孵育约1 h,TBST洗膜3次;ECL发光检测,曝光成像。
1.9统计学方法 采用SPSS16.0软件进行t检验、单因素方差分析。
2 结 果
2.1SNHG1在胃癌细胞中表达 SNHG1在NGEC细胞中的表达水平(1.00±0.19)显著低于在SGC7901、BGC823细胞中的表达水平(4.16±0.44、6.22±0.65,P<0.05)。
2.2转染si-SNHG1能够下调胃癌细胞SGC7901和BGC823中SNHG1的表达水平 si-SNHG1转染SGC7901、BGC823细胞后,SNHG1的表达量SGC7901细胞(0.37±0.09)和BGC823细胞(0.44±0.09)显著低于空白组(SGC7901细胞为1.00±0.18,BGC823细胞为1.00±0.17)及转染si-NC的细胞(SGC7901细胞为0.96±0.19,BGC823细胞为1.01±0.16,P<0.05)。
2.3下调SNHG1对胃癌细胞增殖的影响 与si-NC组相比,siSNHG1组SGC7901和BGC823细胞在48 h、72 h的增殖能力均显著下降(P<0.05)。见表1。
2.4下调SNHG1对胃癌细胞侵袭的影响 si-SNHG1组SGC7901、BGC823细胞侵袭能力显著低于si-NC组(P<0.05),见表1,图1。
2.5下调SNHG1对胃癌细胞增殖和侵袭标志蛋白的影响 与si-NC组相比,si-SNHG1组SGC7901、BGC823细胞的增殖标记物ki67和侵袭相关蛋白MMP-2、MMP-9表达量均显著下降。见图2。
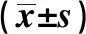
表1 敲除SNHG1对胃癌细胞增殖和侵袭能力的影响
与si-NC组比较:1)P<0.05

图1 敲除SNHG1抑制SGC7901和BGC823细胞侵袭(结晶紫,×100)
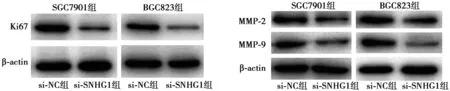
图2 敲除SNHG1抑制SGC7901和BGC823细胞中Ki67、MMP-2和MMP-9蛋白表达
3 讨 论
在哺乳类动物基因组中,无蛋白编码功能的基因(ncRNAs)约占90%。在这些ncRNAs中约18%的lncRNAs与人类肿瘤疾病有关,而具有蛋白编码功能的基因仅占9%〔12〕,表明lncRNAs在人类肿瘤疾病发生和发展中扮演重要角色。研究显示,lncRNAs表达失调可对多种肿瘤疾病的进程产生影响,如肿瘤细胞增殖、浸润及转移等过程〔13〕。最新研究显示,lncRNAs SNHG1表达水平与多个类型肿瘤发生有关〔9,11~13〕。lncRNAs SNHG1在肿瘤中表达上调往往预示着病人预后较差。本研究表明SNHG1在胃癌细胞中高表达且促进了胃癌细胞的增殖和侵袭。
研究表明〔7,10〕,lncRNA参与了基本的生物过程,主要通过与蛋白质、DNA或RNA等相互作用发挥重要的调控功能,如基因组转录、转录后修饰、干扰、核内运输等。研究发现lncRNA的正常表达在个体发育如胚胎干细胞干性、细胞周期等过程中发挥十分重要的作用,而异常表达则会导致细胞发生恶性转化,影响着肿瘤的发生和发展〔14〕。Li等〔14〕研究发现lncRNA H19在胃癌中高表达,并且影响着胃癌细胞的增殖和迁徙,其机制可能与H19竞争性结合其他RNA进而发挥促癌功能。Cui等〔10〕研究发现,SNHG1通过影响下游基因表达和信号通路进而影响肺癌的进展。Sun等〔12〕研究发现,结肠癌中SNHG1表达水平的提高预示着不良预后情况,并且SNHG1促进结肠癌的发生发展。
MMP与肿瘤血管形成、侵袭及转移密切相关〔15〕。MMP2与MMP9主要通过消化基底膜中Ⅳ型胶原纤维从而介导血管侵袭和转移。MMP2可作为胃癌早期诊断标志物,MMP9表达可用于预测黏膜内胃癌淋巴结转移。增殖相关标志物Ki67定位于细胞核、半衰期短,其表达高低反映了细胞增殖的程度,是判定肿瘤恶性程度及侵袭力的重要标志之一〔16〕。研究证实,ki67在胃癌中的表达率较高,具有重要的临床意义〔17〕。本研究显示,下调SNHG1表达,ki67、MMP2和MMP9表达水平均下降。由此可推断,SNHG1可能通过影响ki67、MMP2和MM9的表达在胃癌的侵袭转移中发挥重要作用。
综上,SNHG1在胃癌细胞中高表达,且与肿瘤细胞的增殖、侵袭能力密切相关。降低SNHG1表达的同时也可降低ki67、MMP2和MMP9的表达,使肿瘤细胞的增殖、侵袭转移能力降低。

