下调lncRNA TTN-AS1表达对白血病Raji细胞增殖、侵袭的影响
黄 莺
(中国科学技术大学 附属第一医院(安徽省立医院) 药剂科,安徽 合肥 230001)
白血病(leukemia)是一种异质性的造血系统恶性肿瘤,受累细胞(白血病细胞)出现增殖失控、分化障碍、凋亡受阻,大量蓄积于骨髓和其他造血组织,从而抑制骨髓正常造血功能并浸润淋巴结、肝、脾等组织器官[1].白血病的全球发病率在2.76/10万人左右,约占癌症总发病数的5%.成人以急性非淋巴细胞白血病(ANLL)为主,儿童以急性淋巴细胞白血病(ALL)为主[2].近年来,尽管生物技术手段和临床治疗水平均得到了极大发展,但是白血病的治疗和预后仍不如人意,5年生存率只有约19.6%[3].随着基因组学的发展,研究者们发现长片段非编码RNA(long ncRNAs,简称lncRNAs)在多种肿瘤的发生发展中发挥着极为重要的作用,其与多种生物学过程密切相关,具有成为肿瘤诊断和预后分子标志物的潜力[4].位于人类5号染色体上的烟酰胺核苷酸反义转氢酶RNA1(NNT-AS1),是一种新发现的LncRNA[5].大量体内外研究发现,NNT-AS1在胃癌、肝细胞癌、骨肉瘤、结直肠癌等肿瘤组织中呈异常高表达,且能通过调控MAPK/ERK、miR-363/CDK6等信号通路调节肿瘤细胞的上皮-间质转化(epithelial mesenchymal transition,简称EMT),促进肿瘤细胞的增殖、侵袭与转移等[6-7].但NNT-AS1在白血病中的作用尚未见研究报道.因此,笔者选用白血病细胞株Raji细胞,考察LncRNA NNT-AS1对白血病Raji细胞增殖、侵袭的影响及其作用机制.
1 材料与方法
1.1 细胞株
人白血病细胞株Raji细胞购自中科院上海细胞研究所.
1.2 试剂与仪器
胎牛血清(批号:10099151)、RPMI1640培养基(批号:SH30814.01B)购自美国Gibco公司;CCK-8(批号:20170015)购自南京建成生物科技有限公司;罗丹明-123(Rhodamine-123,Rh-123,批号:G1124)、qRT-PCR试剂盒(批号:A1852)均购自普洛麦格(北京)生物技术有限公司;抗β-actin(批号:AM1021B)、MMP-2(批号:630236)、MMP-9(批号:641509)、VEGF(批号:557007)单抗均购自美国CST公司;Kpn I(批号:D1068A)、EcoR I(批号:D1048A)、BamH I(批号:D1010A)均购自日本Takara公司;质粒小提试剂盒(批号:AP-MN-P-250),购自美国AXYGEN公司.实验仪器:酶标仪(Multiskan MK3)、PCR仪(Piko Real PCR)购自美国Thermo公司.
1.3 Raji稳定干扰细胞系的建立
(1)构建慢病毒干扰载体 pLenR-GPH-hNNT-AS1-sh:通过干扰靶点序列、退火、酶切、重组质粒和慢病毒包装、浓缩等5个步骤,建立 hNNT-AS1-sh 慢病毒载体;(2)将构建好的hNNT-AS1-sh 慢病毒(8 μL)和对照慢病毒(6 μL)转染Raji细胞(细胞种于24孔板,浓度4×104/mL,感染指数(multiplicity of infection,简称MOI)为10)中;(3)待病毒感染8 h后,弃去上清,更换培养液;(4)待病毒感染96 h后,在倒置荧光显微镜下观察细胞转染效果;利用2 μg·μL-1嘌呤霉素进行筛选,待转染率达80%以上时,将稳定干扰NNT-AS1表达的Raji 细胞系和对照细胞系继续传代培养3~4代后进行试验.
1.4 CCK-8法测定增殖
取处于对数生长期的Raji/NNT-AS1 shRNA、Raji/GPH及Raji细胞,消化计数后调整细胞密度为5×104/mL加入96孔板中,每孔100 μL,37 ℃、5% CO2条件下培养过夜.分别在培养24,48,72,96 h后,每孔加入10 μL的CCK-8溶液,振荡,避光孵育30 min,在酶标仪450 nm波长处读取吸光值.
1.5 迁移实验
取处于对数生长期的Raji/NNT-AS1 shRNA、Raji/GPH及Raji细胞,1 000 r·min-1×5 min离心,弃上清,用RPMI-1640培养基(不含血清)洗细胞1遍(目的是去除血清).RPMI-1640培养基重新悬浮细胞,计数板计数调整细胞浓度为2×105/mL.先在24孔板中加入500 μL培养液(含10%胎牛血清),再将Transwell小室放入24孔板中,于上室用枪加入细胞悬液200 μL,5%CO2、37 ℃条件下孵育24 h.将Transwell小室取出,吸取各孔内的细胞,1 000 r·min-1×5 min离心,标记好后,每孔细胞分别加入100 μL培养液(含10%胎牛血清),重悬后接种于96孔板中,再加入CCK-8 10 μL/孔,37 ℃孵育1 h,上机检测各孔吸光值.
1.6 侵袭实验
Transwell小室灭菌后,放入24孔板中,将液体Matrigel基质胶(1∶5稀释)于冰盒上加入Transwell小室中,每室50 μL,轻摇使胶均匀铺平,37 ℃孵育过夜,使胶凝固. 加入细胞步骤参考1.5迁移实验;孵育24 h后,取出小室,弃去上室液体,待小室风干后,将小室浸入提前配制好的4%多聚甲醛中30 min,再放入Giemsa染液(1∶9稀释)中37 ℃染色 10~15 min,PBS冲洗几遍,在显微镜下观察拍照,计算细胞数目.
1.7 Western blot法检测细胞中MMP-2、MMP-9和VEGF蛋白的表达
采用 BCA 蛋白定量法测定MMP-2、MMP-9和VEGF蛋白: 按BCA试剂盒说明书,设置标准孔,样本孔.加入BCA 工作液后37 ℃下孵育30 min,上机检测.依据测得的蛋白浓度,在样本中加入适量的上样缓冲液,吹打均匀后,放入沸水中10 min使蛋白变性,置于—20 ℃冰箱保存备用.制备聚丙烯凝胶,每孔加样品10 μL,电泳分离1.5 h,分离完毕后切胶,转膜2 h(冰水中).脱脂奶粉封闭 2 h.取出封闭的膜,TPBS洗3次,然后用PBS洗1次;一抗(MMP-2、MMP-9和VEGF,1∶500)常温孵育12 h,TPBS 洗3次,二抗 (1∶50 000)5%,TPBS洗3次,PBS 洗1次;以上洗膜时间均为每次10 min.上机显影,配置适量显影液(配好的显影液需避光),用枪均匀地加在条带上;利用凝胶成像系统扫描,Image-Pro Plus软件分析.
1.8 RT-PCR检测NNT-AS1基因的mRNA水平
取处于对数生长期的Raji/NNT-AS1 shRNA、Raji/GPH及Raji细胞,向试验孔中加入10 μmol·L-1TPL,继续于37 ℃、5% CO2条件下培养24 h,消化收集细胞;用Trizol法提取各组总RNA,用RT-PCR试剂盒进行逆转录得到cDNA.NNT-AS1上游引物序列:5′-TGAAGTTTTCAGGGACACAT-3′,下游引物序列:5′-TTTAGACCTGTTTCTTTGTT-3′;94 ℃变性3 min后,按下述条件扩增40个循环:95 ℃ 5 s,65 ℃ 35 s,72 ℃ 60 s,循环后72 ℃延伸5 min.
1.9 统计学方法
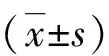
2 结 果
2.1 重组质粒酶切鉴定
利用限制性内切酶EcoRI(位于4 620 bp)和KpnI(位于4 290 bp)将重组质粒及空载体进行酶切鉴定,然后进行琼脂糖凝胶电泳(空载体酶切序列为331 bp,shRNA载体酶切序列为396 bp),结果如图1所示.

A:M2000;B:GPH-NC;C:GPH;D:GPH-NNT-AS1-SH1.图1 重组质粒酶切鉴定
2.2 成功构建NNT-AS1稳定低表达的Raji细胞系
将构建成功的载体质粒转染相应的Raji细胞后,进行扩大培养,镜下观察并拍照,结果如图2所示.

(a1)、(a2)为Raji组,(b1)、(b2)为Raji/GPH组,(c1)、(c2)为Raji/NNT-AS1 shRNA组;(a1)、(b1)、(c1)为3组细胞的白光照片;(a2)、(b2)、(c2)分别为(a1)、(b1)、(c1)对应的同一视野的荧光照片.图2 转染组与非转染组细胞的荧光观察(×200倍)
图2的结果显示,未转染的Raji组细胞中无任何荧光信号,而Raji/GPH 组和Raji/NNT-AS1 shRNA组细胞中均可见强绿色荧光,且含荧光细胞数达80%,表明转染成功.
2.3 qRT-PCR 检测NNT-AS1 mRNA 水平
qRT-PCR检测NNT-AS1 mRNA水平,结果如图3所示.
A为Raji组;B为Raji/GPH组;C为Raji/NNT-AS1 shRNA组;**表示与Raji组相比p<0.01;##表示与Raji/GPH组相比p<0.01.图3 NNT-AS1 mRNA琼脂糖凝胶电泳图(a);qRT-PCR 检测各组细胞中 的NNT-AS1 mRNA 表达(b)
RNA电泳结果显示(图3(a)),18S和28S条带均清楚可见,且无拖尾现象,表明该次提取的NNT-AS1 mRNA的结构完整.qRT-PCR统计结果表明(图3(b)),与Raji/GPH 组和Raji组相比,Raji/NNT-AS1 shRNA组细胞中NNT-AS1 mRNA明显下降(p<0.001).
2.4 CCK-8实验检测细胞增殖
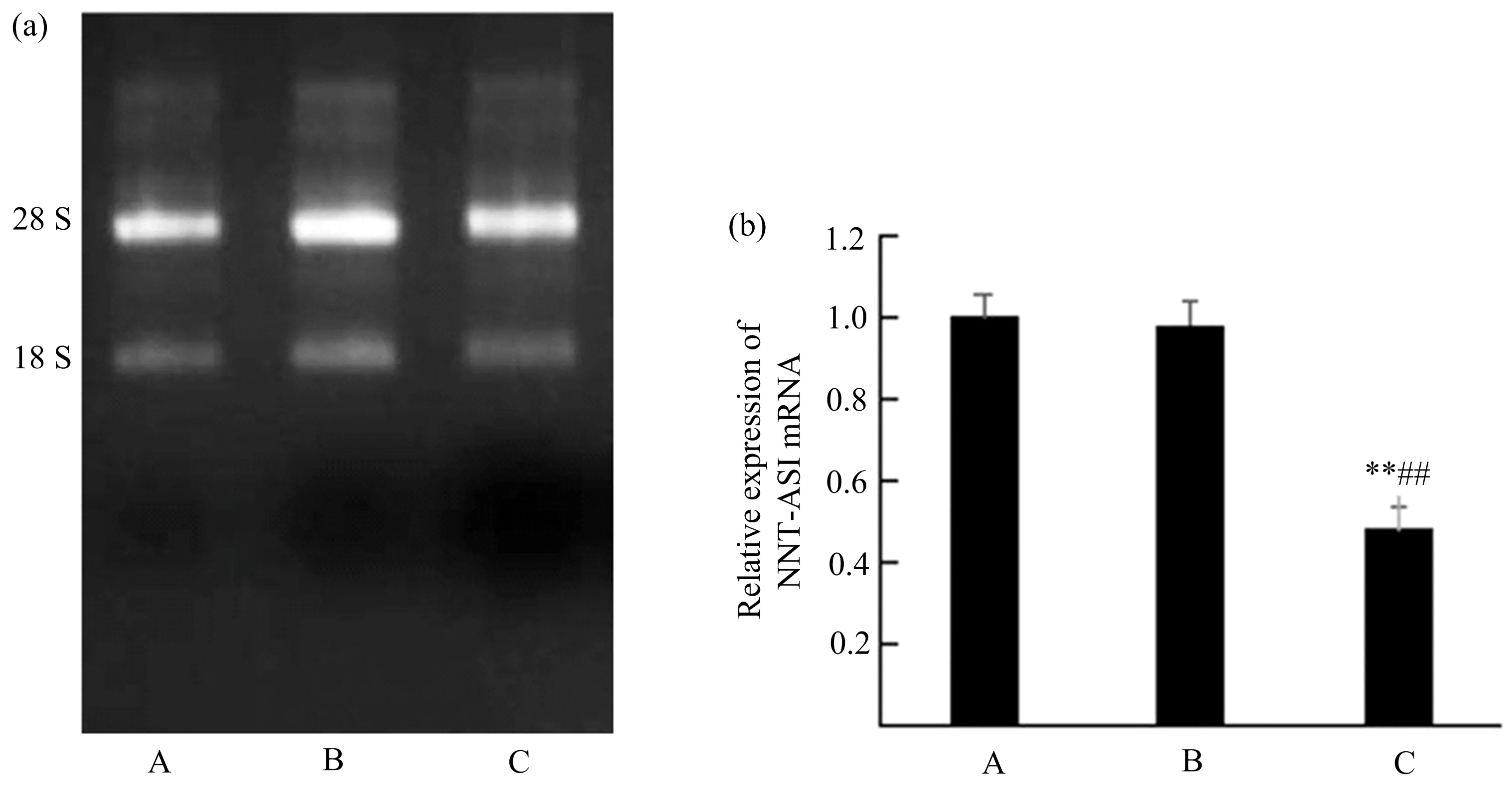
CCK-8实验检测Raji/NNT-AS1 shRNA、Raji/GPH和Raji 3组细胞的增殖,结果如图4所示.
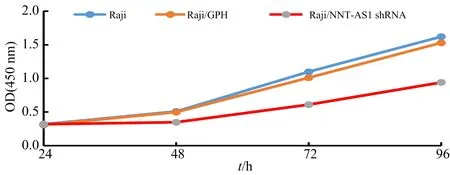
图4 CCK-8实验检测细胞增殖
图4显示,Raji/NNT-AS1 shRNA、Raji/GPH和Raji 3组细胞在第1天时增殖情况无统计学差异;而第2~5 天,Raji/NNT-AS1 shRNA 组细胞增殖速率明显低于Raji/GPH组(p<0.01)和Raji组(p<0.01),表明下调 NNT-AS1的表达可抑制Raji细胞的增殖.
2.5 迁移实验
Raji/NNT-AS1 shRNA、Raji/GPH和Raji 3组细胞的迁移结果如图5所示.

与Raji组相比,**p<0.01;与Raji/GPH组相比,##p<0.01.图5 各组细胞迁移能力比较
图5显示,与Raji/GPH组及Raji组相比,Raji/NNT-AS1 shRNA组迁移细胞数明显下降,具有统计学差异(均p<0.01).提示下调NNT-AS1的表达,可抑制Raji细胞的迁移.
2.6 侵袭实验
Raji/NNT-AS1 shRNA、Raji/GPH和Raji 3组细胞的侵袭实验经过Giemsa 染色和计数,结果如图6~7所示.

(a)为Raji组;(b)为Raji/GPH组;(c)为Raji/NNT-AS1 shRNA组.图6 侵袭实验检测各组细胞侵袭能力(×200倍)
**表示与Raji组相比,p<0.01;##表示与Raji/GPH组相比,p<0.01.图7 各组侵袭细胞数统计分析
Giemsa染色和计数结果显示(图6~7),与Raji/GPH组及Raji 组相比,Raji/NNT-AS1 shRNA 组细胞穿透基质胶数目明显减少,具有统计学差异(p<0.01).提示下调NNT-AS1的表达,可抑制Raji细胞的侵袭.
2.7 Western blot法检测细胞中MMP-2、MMP-9和VEGF蛋白的表达
Western blot法检测细胞中MMP-2、MMP-9和VEGF蛋白的表达和统计结果如图8所示.

(a)为各蛋白Western blot蛋白条带结果;(b)为各目标蛋白MMP-2、MMP-9和VEGF与β-actin的荧光强度相对值(以β-actin荧光强度为1),**表示与Raji组相比,p<0.01;##表示与Raji/GPH组相比, p<0.01.图8 Western Blot 检测各组细胞中MMP-2、MMP-9和VEGF蛋白表达
图8的Western blot结果显示,Raji/GPH组及Raji 组相比,Raji/NNT-AS1 shRNA 组细胞中MMP-2、MMP-9和VEGF蛋白表达明显减少.
3 讨 论
LncRNA是功能性RNA的一种,其不具备编码蛋白质功能,长度一般超过200 nt,在细胞质和细胞核均有分布,主要用于调控基因的表达[8].近年来,随着对LncRNA研究的不断深入,大量的证据显示LncRNA与机体的多种生物过程有关,尤其是在肿瘤的发生发展中,LncRNA有潜力成为肿瘤标记物[9-10].在已发现的LncRNA中,有许多已被证实与白血病相关:国外研究发现,与AML低危组相比,高危组患者组织中LncRNA IRAIN表达量明显降低,而LncRNA IGF1R表达明显升高[11-12];同时有研究发现,AML与肿瘤抑制基因LncRNA-MEG3发生甲基化关系密切,可能是AML患者潜在的治疗靶点[13].国内研究也发现LncRNA KCNQ1OT1在急性髓系白血病(AML)患者外周血样本呈现高表达,可能成为AML患者预后潜在的标志物[14].李正等[15]通过QT-PCR发现lncRNA-LLEST 在AML初期呈低表达,当化疗药物诱导后LLEST表达出现明显升高,且LLEST表达越高,AML患者预后越佳,提示LLEST具有抑制肿瘤细胞增殖的作用.
笔者所考察的LncRNA NNT-AS1是近年来新发现的LncRNA,其位于人5号染色体上.大量实验结果发现,在结直肠癌患者的病理组织中LncRNA NNT-AS1呈现高表达状态,探究其机制发现,LncRNA NNT-AS1主要是通过激活肿瘤细胞MAPK/ERK信号通路和促进其上皮-间质转化(EMT),使肿瘤细胞的增殖、侵袭与转移能力增强[16].同时也有研究表明,肝细胞癌(HCC)患者组织中LncRNA NNTAS1也呈现高表达状态,其主要是通过调控miR-363 /CDK6信号通路参与HCC发生发展[17].另外,LncRNA NNT-AS1与骨肉瘤的发生也密切相关,与对照组相比,LncRNA NNT-AS1高表达组患者的生存率和生存时间明显减少[18].笔者课题组前期研究发现,LncRNA NNT-AS1在白血病细胞中的表达较正常淋巴细胞明显升高,与上述报道的其他恶性肿瘤结果一致,考虑其也可能在白血病的发生发展中发挥重要作用.为进一步考察其对白血病细胞的影响,笔者通过基因沉默技术以降低LncRNA NNT-AS1在Raji细胞中的表达,再利用Q-PCR、CCK-8、Transwell、Westren blot等实验手段检测下调LncRNA NNT-AS1表达后,Raji细胞的增殖、侵袭和转移能力的变化,并初步探究其可能的机制.研究结果发现,与Raji/GPH组及Raji组相比,Raji/NNT-AS1 shRNA组细胞增殖、侵袭和转移能力均显著下降,同时细胞中MMP-2、MMP-9和VEGF蛋白表达水平也明显降低.
综上所述,下调LncRNA TTN-AS1表达可降低白血病Raji细胞增殖、侵袭能力,其机制可能与其下调Raji细胞的MMP-2、MMP-9、VEGF的蛋白表达有关,提示LncRNA TTN-AS1可能是治疗白血病新的基因靶点,但仍需进一步实验验证.

