红米中花色苷的提取工艺及其体外降糖活性研究
郭晓宇, 胡宇恒, 古丽斯坦·阿不来提, 热娜·吉恩斯, 唐晓敏, 姚 军
(新疆医科大学药学院, 乌鲁木齐 830011)
红米(Oryzapunctata)为禾本科植物红糯稻(Oryzasativavar.glutinosa)的种仁,因其种皮呈红色而得名[1],国内外学者研究发现红米含有丰富的花色苷,其中主要含有矢车菊素-3-葡萄糖苷(Cy-3-G)、芍药素-3-葡萄糖苷以及二甲花翠素等,具有抗氧化、降血脂、抗动脉粥样硬化等药理作用[2-4]。民间有利用红米食疗调节血糖的用法,而对其降糖作用机制的研究尚少。糖尿病是一种以高血糖为特征的内分泌代谢疾病[5],患者初期通过食疗便即可控制病情,重症患者需要配合药物治疗[6]。α-葡萄糖苷酶和α-淀粉酶在广泛在人类肠道内存在,这两种酶直接参与人体内糖原与淀粉的代谢。α-葡萄糖苷酶抑制剂通过抑制肠道内的α-葡萄糖苷酶,来延缓糖类的吸收从而达到降低血糖的效果。α-淀粉酶抑制剂则是通过抑制α-淀粉酶,来减少人体对与淀粉的吸收,来达到降血糖的效果[7-9]。因此,α-葡萄糖苷酶和α-淀粉酶的抑制率可以作为评价红米中花色苷的体外降糖活性的指标[10-13]。响应面法已广泛用于药材中有效成分的提取,能较好的考察提取过程不同提取因素的交互作用,筛选较优的提取工艺[14-15]。本实验通过响应面法优化红米中花色苷的提取工艺,采用PNPG法和碘比色法测定红米花色苷对α-葡萄糖苷酶和α-淀粉酶的抑制率,现报道如下。
1 材料与方法
1.1 仪器C38型粉碎机(美的集团有限公司),ME204E型电子天平秤、FE28型酸度计(梅特勒-托利多仪器有限公司),Spectrumlab-22PC型可见分光光度计(上海棱光有限公司),SB-1000型旋转蒸发仪(EYELA东京理化器械株式会社)。
1.2 试剂α-葡萄糖苷酶(国药集团化学试剂有限公司,批号G8823),α-淀粉酶(国药集团化学试剂有限公司,批号G8290),对硝基苯-β-D-吡喃半乳糖苷(美国Solarbio公司,批号N8200),阿卡波糖片(德国拜耳公司,批号BJ43010),无水乙醇(天津市富宇精细化工有限公司,批号20170326),冰醋酸(天津博迪化工股份有限公司,批号20161008),盐酸(天津市富宇精细化工有限公司,批号20180606)。
1.3 药材红米2018年11月购买于乌鲁木齐市北园春农贸市场,产地为吉林省通化市,经新疆医科大学药学院帕丽达·阿不力孜教授鉴定为禾本科红糯稻(Oryzasativavar.glutinosa)的种仁。
1.4 红米花色苷的制备及含量测定方法红米用蒸馏水洗净,进行粉碎,过60目筛,得到红米粉末,称取红米粉末10 g,采用回流提取法,筛选不同温度、提取时间、乙醇浓度、提取pH、料液比、提取次数获得红米花色苷提取液,3 000 r/min离心5 min,取上清液,调节pH为1.0和4.5,测定520 nm和700 nm 处吸光度,按公式:总花色苷含量(mg/g)=[(pH1.0A520-pH1.0A700)-(pH4.5A520-pH4.5A700)]×M×a/ε×m[式中M为摩尔质量449.2 g/mol;a为稀释因子;ε为摩尔消光系数26 900 L/(mol·cm);m为样品质量,g]计算总花色苷含量。
1.5 单因素实验
1.5.1 提取温度的考察 称取红米粉末4份,每份10 g,加入75%乙醇50 mL,调节pH为1,分别在30、40、50、60℃的条件下,回流提取2.5 h后,按“1.4”项下方法测定红米中花色苷含量。
1.5.2 提取时间的考察 称取红米粉末5份,每份10 g,加入75%乙醇50 mL,在40℃,pH=1的条件下,进行回流提取,分别提取1、2、2.5、3、4 h,按“1.4”项下方法测定红米中花色苷含量。
1.5.3 乙醇体积分数的考察 称取红米粉末5份,每份10 g,在40℃,pH=1的条件下,分别加入55%、65%、75%、85%、95%乙醇50 mL,回流提取2.5 h,按“1.4”项下方法测定红米中花色苷含量。
1.5.4 提取pH值的考察 称取红米粉末5份,每份10 g,加入75%乙醇50 mL,分别在40℃与pH为0.25、0.5、0.75、1、2的条件下,回流提取2.5 h,按“1.4”项下方法测定红米中花色苷含量。
1.5.5 提取料液比的考察 称取红米粉末5份,每份10 g,在40℃与pH=1的条件下,分别加入75%乙醇30、50、70、100、200 mL,回流提取2.5 h,按“1.4”项下方法测定红米中花色苷含量。
1.5.6 提取次数的考察 称取红米粉末4份,每份10 g,在40℃与pH=1的条件下,加入75%乙醇50 mL,回流分别提取1、2、3、4次,每次2.5 h,合并提取液,按“1.4”项下方法测定红米中花色苷含量。
1.6 响应面试验设计根据单因素实验筛选出对红米花色苷提取率影响较大的3个因素分别为pH、提取温度和提取时间,设计三因素三水平响应面实验,通过实验结果使用Design Expert 10软件分析来确定花色苷的最佳提取工艺,见表1。

表1 响应面实验设计表
1.7 α-葡萄糖苷酶抑制率测定分别取0.1 mmol/L PNPG 2 mL,加入0.2 mol/L pH6.8磷酸缓冲液2 mL和浓度分别为50、100、150、200 μg/mL红米花色苷提取液1 mL,37 ℃水浴5 min,加入1 mL浓度为0.05 U/mL的α-葡萄糖苷酶液,37℃水浴20 min,加入4 mL 浓度为0.2 mol/L的 Na2CO3溶液,终止反应,测定400 nm处吸光度。用磷酸缓冲液代替酶液和提取液作空白对照,用磷酸缓冲液代替提取液作背景对照,以阿卡波糖溶液代替红米花色苷提取液作阳性对照,按公式α-葡萄糖苷酶抑制率(%)=A空白-(A样品-A背景)/A空白×100%计算抑制率。
1.8 α-淀粉酶抑制率的测定取1.5%的可溶性淀粉1 mL,加入0.2 mol/L pH=6.2的磷酸缓冲液5 mL,37℃水浴5 min,加入3 mL 0.05 U/mL的α-淀粉酶液和浓度分别为50、100、150、200 μg/mL红米花色苷提取液1 mL,37℃水浴30 min,取0.5 mL混合液,加入0.05 mol/L 碘液6 mL终止反应,测定580 nm处吸光度。用缓冲液代替酶液和提取液作为空白对照,用缓冲液代替提取液作为背景对照,以阿卡波糖溶液代替红米花色苷提取液作为阳性对照,按公式α-淀粉酶抑制率(%)=A样品-A背景/A空白-A背景×100%。
2 结果
2.1 单因素实验结果
2.1.1 提取温度对花色苷含量的影响 当乙醇体积分数为80%,料液比为1∶5,提取次数为1次,Ph为1,提取时间为2.5 h,提取温度为50℃时,花色苷含量达到最大值,为2.35 mg/g,见图1。

图1 温度对花色苷提取含量的影响
2.1.2 乙醇体积分数对花色苷含量的影响 当温度为40℃,料液比为1∶5,提取次数为1次,提取pH为1,提取时间为2.5 h,乙醇体积分数为75%时,花色苷含量达到最大值,为2.2 mg/g,见图2。
2.1.3 pH值对花色苷含量的影响 当温度为40℃,乙醇体积分数为75%,料液比为1∶5,提取次数为1次,提取时间为2.5 h,pH为0.5时,花色苷的含量达到最大值,为2.4 mg/g,见图3。
2.1.4 料液比对花色苷含量的影响 当温度为40℃,乙醇体积分数为75%,提取次数为1次,提取时间为2.5 h, pH为1,料液比为1∶7时,花色苷的含量达到最大值,为2.44 mg/g,见图4。
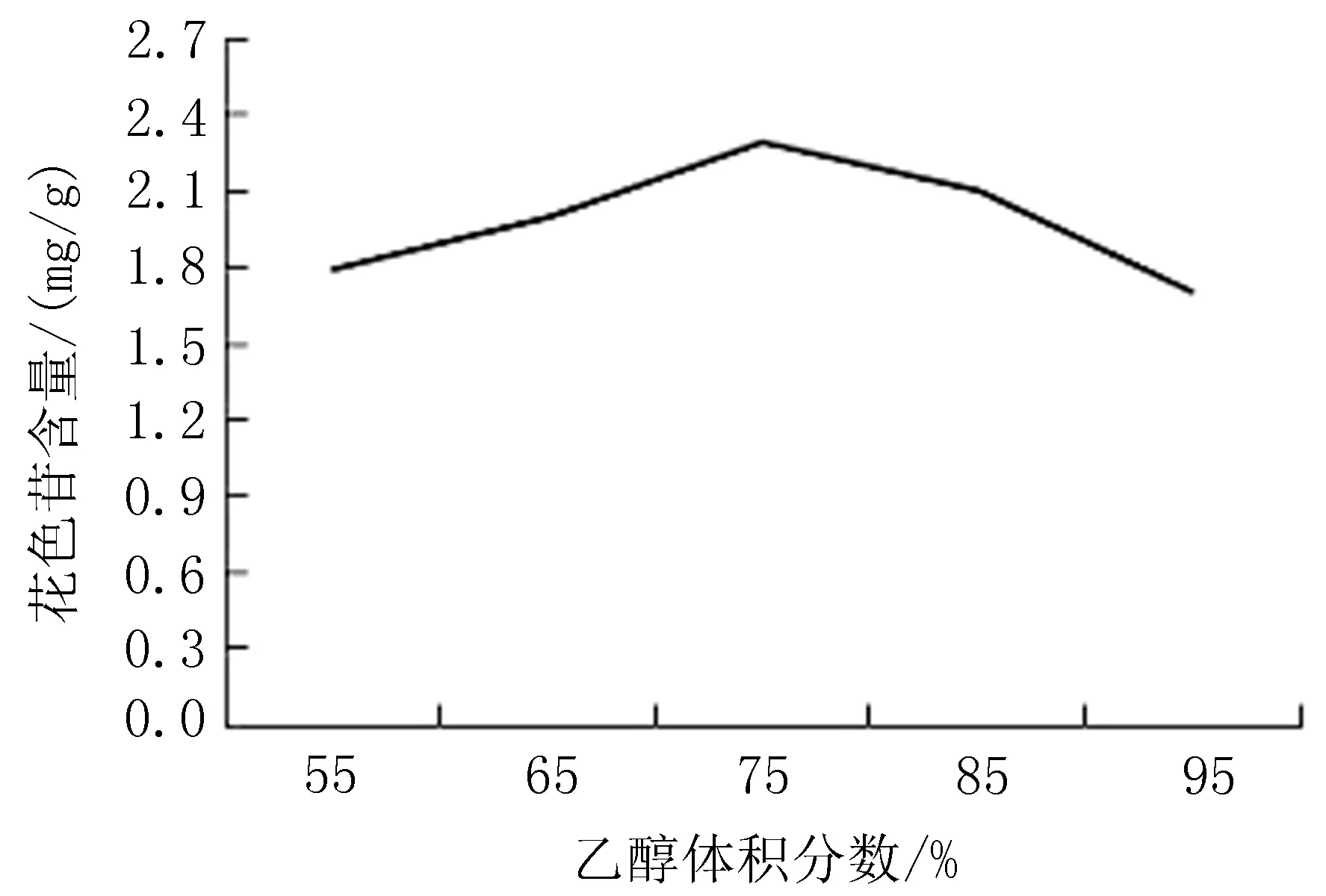
图2 乙醇体积分数对花色苷含量的影响
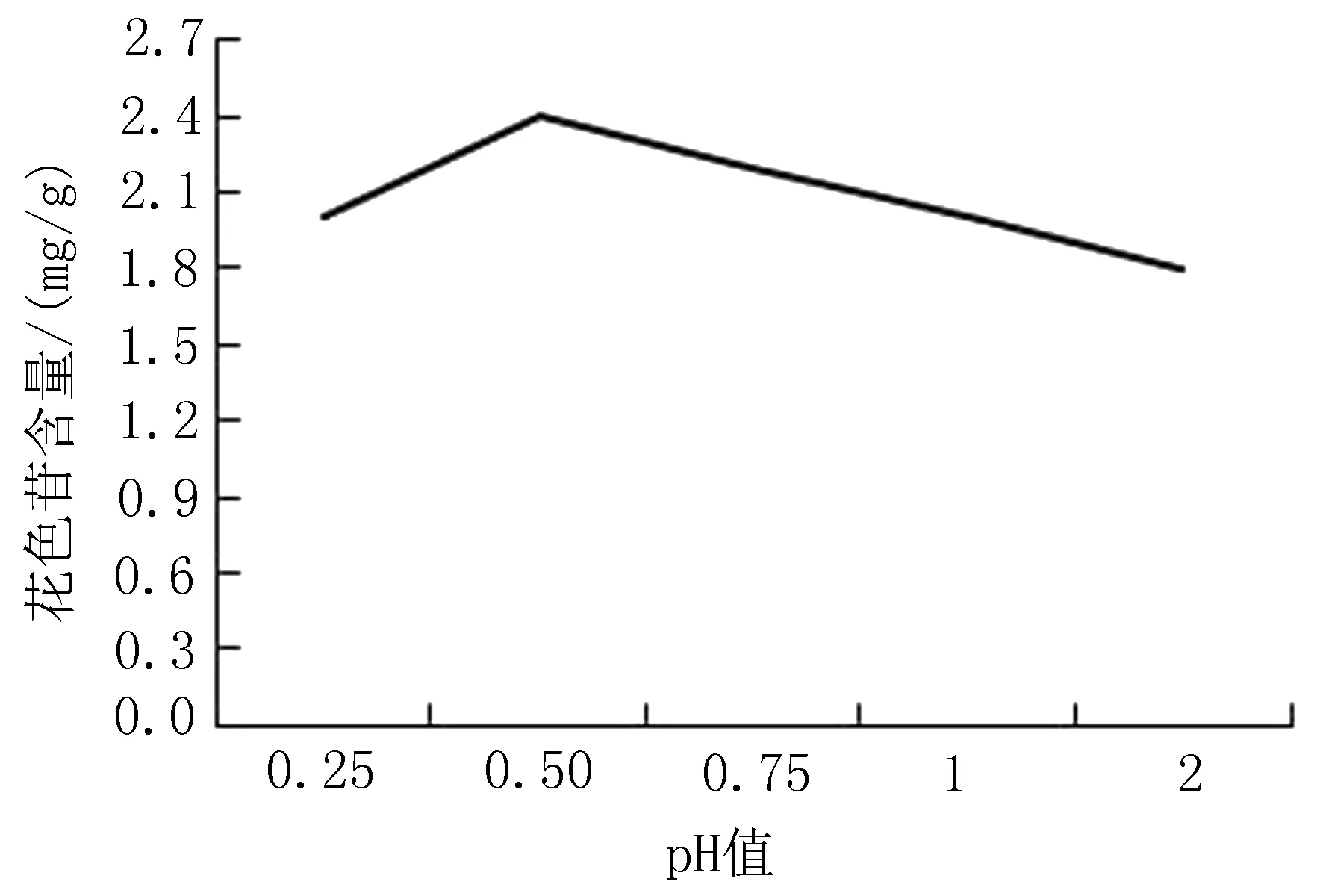
图3 pH值对花色苷含量的影响

图4 料液比对花色苷含量的影响
2.1.5 提取次数对花色苷含量的影响 当温度为40℃,乙醇体积分数为75%,料液比为1∶5,提取时间为2.5 h,提取pH为1,提取次数为2次时,花色苷的含量达到最大值,为2.36 mg/g,见图5。
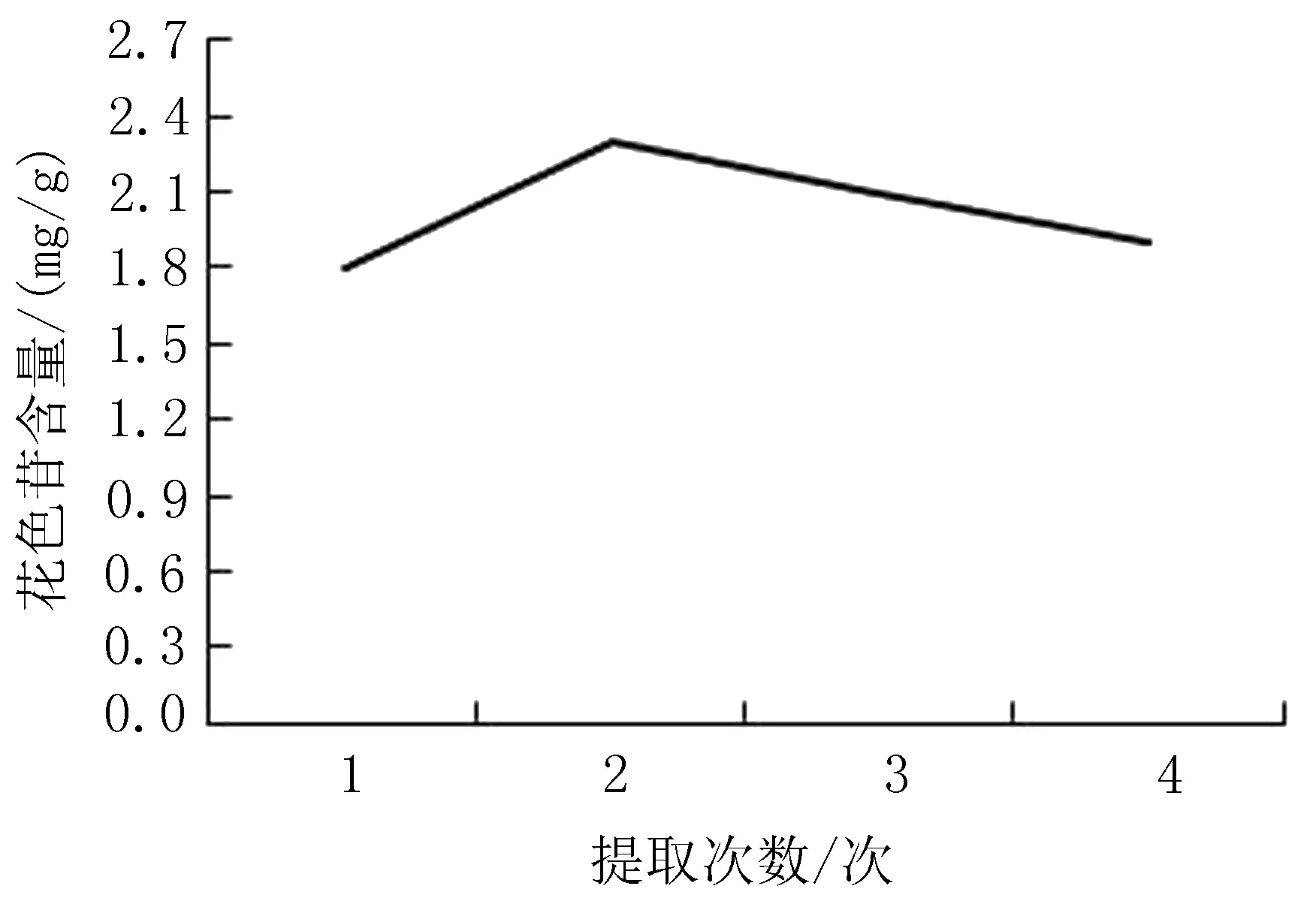
图5 提取次数对花色苷含量的影响
2.1.6 提取时间对花色苷含量的影响 当温度为40℃,乙醇体积分数为75%,料液比为1∶5,提取次数为1次,提取pH为1,提取时间为2.5 h时,花色苷的含量达到最大值,为2.4mg/g,见图6。
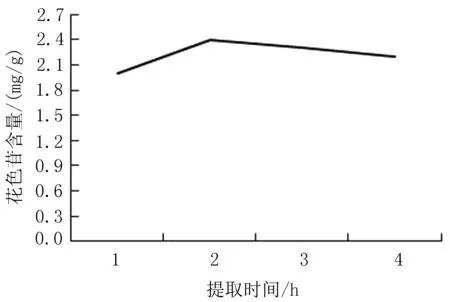
图6 提取时间对于花色苷含量的影响
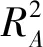
2.3 红米花色苷对于α-葡萄糖苷酶和α-淀粉酶的抑制作用红米花色苷对α-葡萄糖苷酶有抑制效果,存在剂量依赖关系,见图10。
表2 响应面时间设计表

表3 响应面二次模型方差分析表
注:*P<0.05为显著。

图7 A(温度)、B(pH)交互作用影响的响应面图
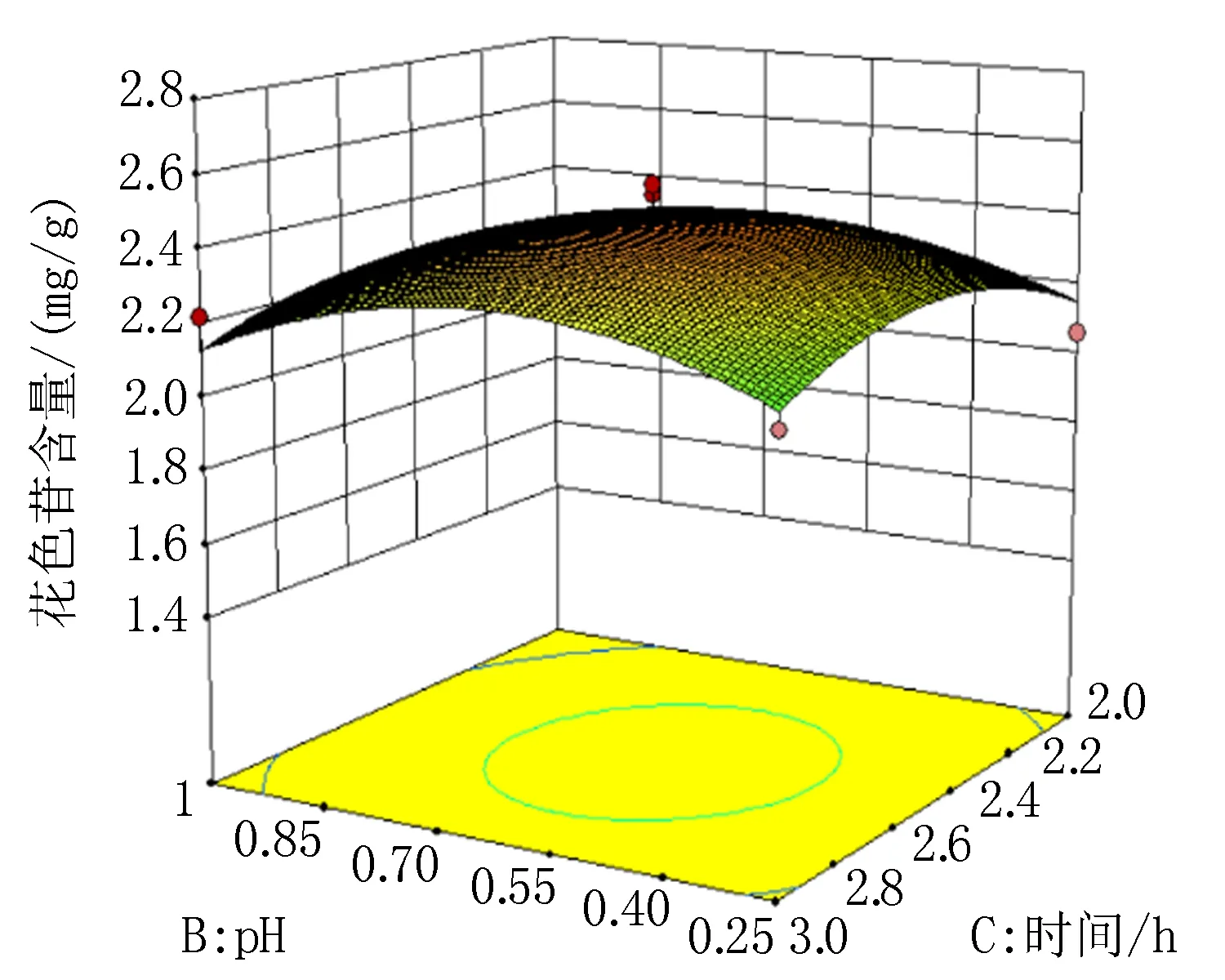
图8 B(pH)、C(时间)交互作用影响的响应面图

图9 A(温度)、C(时间)交互作用影响的响应面图


图10 红米花色苷对α-葡萄糖苷酶(a)和α淀粉酶(b)的抑制作用
3 讨论
目前国内对红米生物活性的研究尚处于起步阶段,研究方向主要集中在清除自由基、抗氧化、抗动脉粥样硬化方面,红米中有效抗氧化成分为花色苷,花色苷对DPPH等自由基具有较强的清除作用,且与花色苷浓度有一定的量效关系。由于红米作为糖尿病的辅助降糖代餐,本研究确定了乙醇溶剂提取法下花色苷的最佳提取工艺,采用体外降糖实验证明花色苷的体外降糖效果,其对于α-葡萄糖苷酶和α-淀粉酶均有显著的抑制作用,为红米资源的开发和利用提供了理论方向和实验依据,但对于红米中花色苷具体的化学结构和药理活性基团等问题还需进一步的研究。

