终末期肝病临床营养指南
中华医学会肝病学分会 中华医学会消化病学分会
一、前言
终末期肝病(End-stage liver disease,ESLD)泛指各种肝脏损害所导致的肝病晚期阶段[1]。本文中终末期肝病指成人患者由于各种原因导致的肝硬化、肝衰竭和肝癌,其中肝衰竭部分主要涉及急性、亚急性、慢加急性肝衰竭[2,3],而慢性肝衰竭按既往分类归为肝硬化。肝脏是人体重要的代谢与合成器官,肝脏损伤和功能下降会导致碳水化合物、脂肪、蛋白质三大营养物质及维生素和微量元素等多种物质代谢异常。终末期肝病患者普遍存在营养不良,失代偿期肝硬化及肝衰竭患者营养不良发生率可高达50%~90%以上[4]。营养不良与感染、腹水、肝性脑病等多种并发症的发生密切相关,是影响终末期肝病患者包括肝移植术后存活率的独立预测因子[5]。因此,营养不良应作为和腹水、肝性脑病等同样重要的并发症进行诊治。
近年来,一些国际肝病和营养相关学会陆续发布了肝病营养指南。欧洲肠外肠内营养学会(European Society for Clinical Nutrition and Metabolism,ESPEN)曾于 1997年发布《肝病和肝移植营养指南》[6],2006年发布《肝病肠内营养指南》[7],2009年出台《肝病肠外营养指南》[8],2019年发布《肝病临床营养指南》,对急性肝衰竭、酒精性肝炎、非酒精性脂肪性肝病(NAFLD)、肝硬化、肝移植/手术及营养相关肝损伤患者的营养评估和干预提出了推荐意见。2018年欧洲肝病学 会 (European Association for the Study of the Liver,EASL)发布了《慢性肝病营养临床实践指南》[9],对慢性肝病主要是肝硬化患者的营养不良风险筛查、营养评定和干预提出了推荐意见。
我国部分专家曾发表过关于慢性肝病营养支持的专家共识[10],但迄今为止,尚无针对终末期肝病患者的临床营养指南。为了规范终末期肝病患者营养筛查、评定、干预和随访管理,中华医学会肝病学分会、中华医学会消化病学分会共同组织国内有关专家编写了本指南。本指南旨在帮助临床医生在终末期肝病患者临床营养不良和营养风险筛查、营养状态评定、干预和随访管理作出合理决策,但不是强制性标准,也不可能涵盖或解决终末期肝病营养相关的所有问题。临床医师在面对某一患者时,应在充分了解相关疾病和个体的最佳临床证据,认真考虑患者具体病情及诊疗意愿的基础上,根据自己的专业知识、临床经验和可利用的医疗资源,制订合理的诊疗和管理方案。鉴于终末期肝病及营养研究进展迅速,本指南将根据学科进展和临床需要不断更新和完善。
本指南根据推荐意见分级评估、制定和评价(GRADE)系统,将循证医学证据等级分为A、B和C三个级别,推荐强度分为1和2两个级别(表1)。
本指南用到的术语及其定义:
营养不良(Malnutrition):指因能量、蛋白质或其他营养素缺乏或过量,对机体功能乃至临床结局造成不良影响的现象。包括营养不足和营养过剩两种情况。
营养风险(Nutritional risk):是指有关营养因素对患者临床结局(如感染相关并发症、理想和实际住院日、质量调整寿命年、生存期等)造成不利影响的风险。
营养不良风险(Risk of malnutrition):是指发生/出现营养不良的风险。
营养筛查(Nutritional screen):应用量表化的工具初步判断患者营养状态,发现潜在的、隐性的、早期的营养不良风险或营养风险的过程。
营养评定:也称营养评估,指对有营养不良风险或营养风险的患者,通过相应方法判断患者营养不良类型和程度的过程。
肠内营养(Enteral nutrition,EN):是指经胃肠道给予代谢需要的营养素的营养支持方式。肠内营养制剂根据配方构成不同,可分为三类,全营养配方(可作为单一营养来源满足目标人群的营养需求)、特定全营养配方(可作为单一营养来源满足目标人群在特定疾病或医学状况下的营养需求)和非全营养配方 (可满足目标人群的部分营养需求)。 根据给予途径不同分为经口营养补充(Oral nutritional supplement,ONS)和管饲营养补充。
肠外营养(Parenteral nutrition,PN):又称“静脉营养”,是经静脉为无法经胃肠道摄取或摄取营养物不能满足需要的患者提供营养素的方法。所有营养素完全经肠外获得的营养支持方式称为全肠外营养(Total parenteral nutrtion,TPN)。
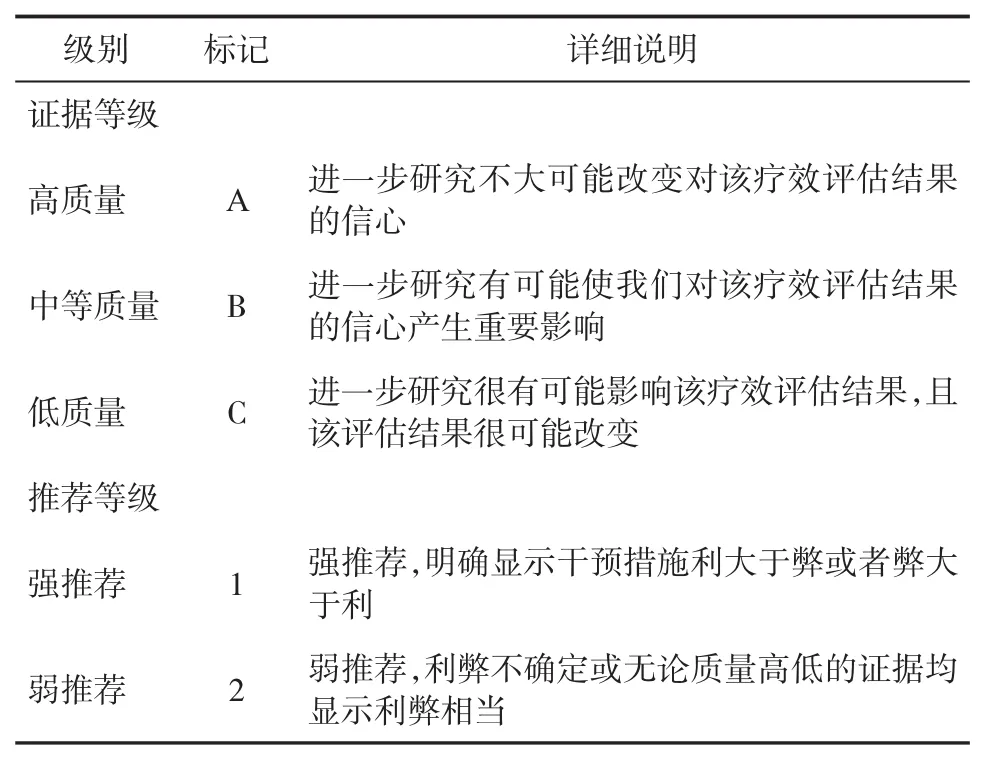
表1 推荐意见的证据等级和推荐等级
二、终末期肝病患者营养筛查和评定
(一)终末期肝病患者营养筛查
营养筛查包括了营养风险筛查和营养不良风险筛查。
终末期肝病患者营养不良常见,并且随着肝脏疾病病情的加重,营养不良发生率和严重程度增加。体重指数(Body mass index,BMI)<18.5kg/m2的终末期肝病患者可诊断营养不良,Child-Pugh C级的肝硬化患者、肝衰竭患者为高营养不良风险人群,这部分患者直接进行详细营养评定以确定营养不良类型和程度;其他终末期肝病患者应进行营养筛查,经筛查有营养风险或营养不良风险的患者需进行详细营养评定,以确定营养不良类型和程度[9,11]。
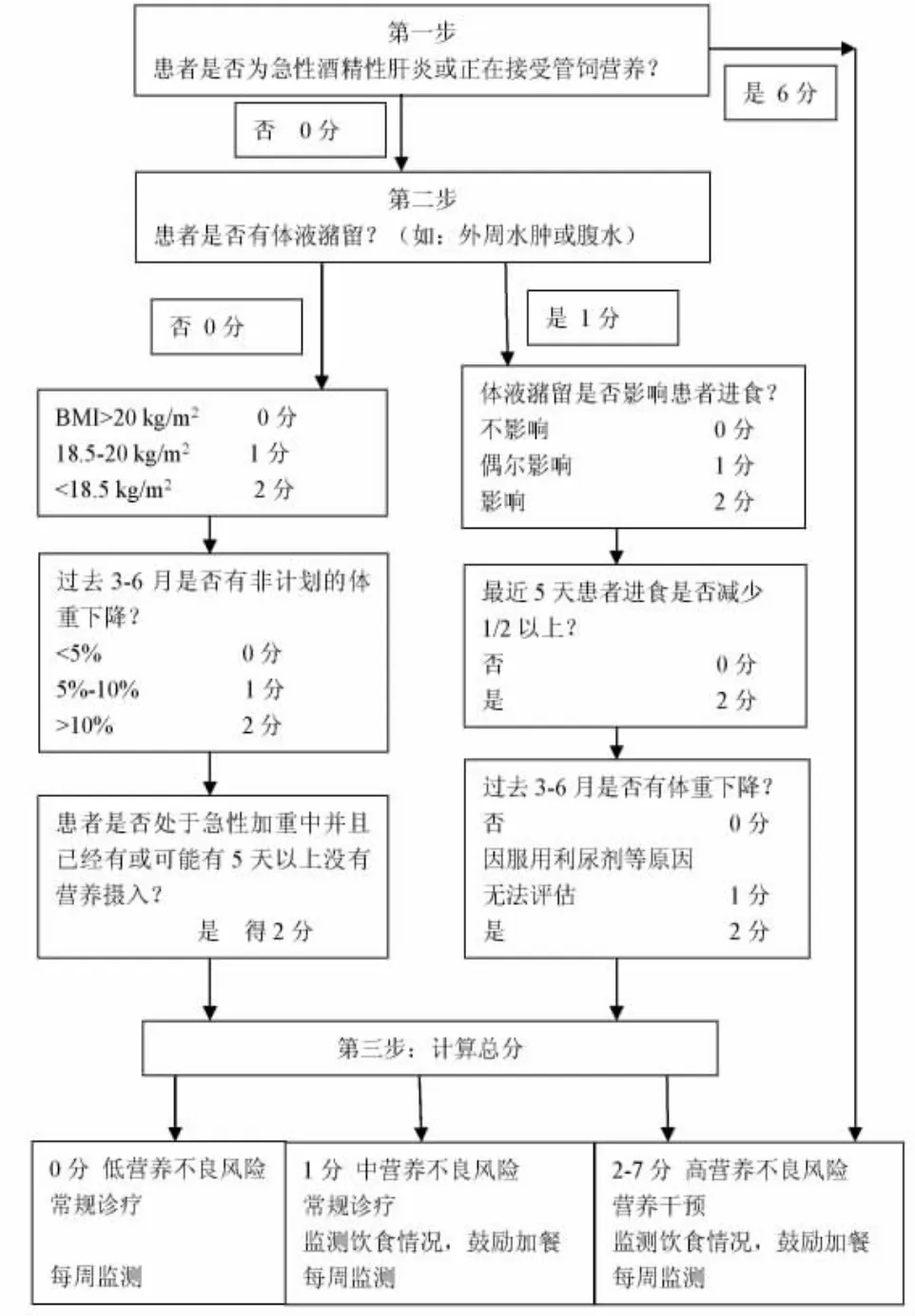
近年多个营养不良风险筛查工具在临床上进行了应用。英国皇家自由医院营养优先工具(The Royal Free Hospital-Nutritional Prioritizing Tool,RFH-NPT)设计简单、易操作[9]。第一步:急性酒精性肝炎或正在经过管饲的患者直接评6分,定位高营养不良风险;第二步:其余无体液潴留的患者根据BMI数值评0-6分,有体液潴留患者根据体液潴留对饮食的影响及体重变化情况评1-7分;第三步:将前两步分数相加,判定营养不良风险。0分为低风险,1分中等风险,2-7分高风险。研究显示,该评分和肝硬化并发症、疾病严重程度及预后密切相关[12]。肝病营养不良筛查工具(The Liver Disease Undernutrition Screening Tool,LDUST)由6个针对患者的主观问题构成,包括进食情况、非自主体重减轻、脂肪和肌肉减少、水肿及活动能力下降。患者根据自身情况分别对6个问题选择A、B或C,汇总得到5个或以上A认为目前无明确营养不良风险,若得到2个或以上B或C,则认为有营养不良风险应进行营养评定。该工具优点在于设计简单,便于门诊及病房筛查,医生护士或患者及家属均可操作,对肝硬化营养不良有较好的预测价值[13]。但因为缺乏客观指标,阴性预测价值较低,建议判断结果无风险的患者在一定时期内进行复测[9]。
2002年丹麦学者Jens Kondrup教授牵头的ESPEN专家组提出了营养风险的概念,并制订了营养风险筛查工具(Nutritional risk screenin,NRS2002),该评分包括营养状态评分、疾病严重程度评分及年龄评分3部分,总分≥3分认为有营养风险,建议进行营养支持以改善临床结局。近年来,在肝硬化、肝癌等肝病患者中得到了较为广泛的应用[14,15],是终末期肝病患者营养筛查可供选择的工具之一。
(二)终末期肝病患者营养评定
一旦患者经筛查存在营养不良风险或营养风险,即应对患者进行详细营养评定,以确定营养不良的类型和程度,从而为制定有针对性的营养支持方案提供依据,并且应在营养支持过程中动态评定,以评价营养支持疗效并判断预后。
营养不良的评定主要包含以下内容:人体成分评定、能量代谢检测、综合评分工具及膳食摄入评定等[16]。
1.人体成分评定指标
(1)BMI是人体成分及营养状态的基本参数,是判断营养状态的最基本指标之一。我国BMI评定标准是:BMI≥28.0肥胖;24.0≤BMI<28.0 超重;18.5≤BMI<24.0 正常;BMI<18.5体重过低(营养不良);终末期肝病患者经常存在水肿、胸腹水等体液潴留,使得BMI在应用中受到了一定限制。对于存在体液潴留的终末期肝病患者可以计算干体重BMI(干体重/身高平方,kg/m2)。干体重(Dry weight,DW)可以通过以下几种方法进行评估或计算:①出现体液潴留前的体重;②穿刺引流之后的体重;③校正体重:根据临床判断的腹水严重程度减去一定量体重进行校正(轻度5%,中度10%,重度15%,如果存在外周水肿再减5%)[17]。
(2)上臂围(Arm circumference,AC)、三头肌皮褶厚度(Triceps skinfold,TSF)和上臂肌围(Arm muscle circumference,AMC)。上臂围指上臂中点处周长,可通过软尺直接测量;三头肌皮褶厚度应用皮脂测量仪直接测量。上臂肌围由上臂围和三头肌皮褶厚度计算得出:上臂肌围(cm)=上臂围(cm)-3.14×三头肌皮褶厚度(cm)。TSF正常参考值男性为8.3mm,女性为15.3mm。AMC正常参考值男性为24.8cm,女性为21.0cm。实测值/正常值>90%为正常;80%-90%为轻度营养不良;60%-80%之间为中度营养不良;<60%为重度营养不良。上述指标不受胸水、腹水和下肢水肿的影响,测量方法简单、易操作、经济便捷,是人体成分评估的基本方法之一,也是国内外指南推荐的慢性肝病营养评估方法之一[7-9]。有研究显示TSF、AMC联合ALB和活动能力是影响慢性肝病病人发生感染、胸腹水、器官功能衰竭和进入ICU的危险因素[18]。其主要的局限性在于测量者之间和多次测量的系统误差,因此,应用时建议对测量者统一培训并制订规范化操作流程[11]。
(3)实验室检测指标:白蛋白、前白蛋白、视黄醇结合蛋白等水平可以反映肝脏的合成能力,同时也是营养状态的敏感指标。虽然在终末期肝病患者输注氨基酸、白蛋白等制剂后会对相应指标产生影响,但是结合其他指标或观察动态变化,仍然对营养状态有较好的提示作用。
(4)肌量和肌肉功能评定
近年,越来越多的研究证明肌肉减少症(Sarcopenia),简称肌少症,是营养不良的重要表现,甚至有时作为营养不良的同义词[19]。肌少症包含肌量减少和肌肉功能减退两方面内涵。目前常用的检测骨骼肌肌量的方法是通过CT或核磁共振扫描,选择第三腰椎(L3)水平肌肉面积总和与身高平方的比值计算 L3骨骼肌指数(Skeletal muscle index,SMI,cm2/m2)。肌量受年龄、性别、种族等多种因素影响,SMI用于诊断肝硬化患者肌量减少的界值尚未统一。目前应用较多的是来自一项基于肝移植等待患者的数据,建议男性<50 cm2/m2,女性<39 cm2/m2为营养不良(肌量减少)[20]。此外,还可以通过CT或磁共振测量腰肌厚度、大腿肌肉面积或厚度、超声测量大腿肌肉厚度等方法,来评价肌量[5,21-23]。一项meta分析纳入了20个研究、4037例肝硬化患者,结果显示肌肉减少是肝硬化患者预后不良的独立危险因素,且相比西方国家人群,亚洲人群肌肉减少相关的病死率更高[19]。
握力测定是评价肌肉功能的常用方法。仅需握力计即可完成,简单、经济、实用,在终末期肝病患者营养评定中得到了广泛应用,显示了对肝硬化主要并发症和病死率的良好预测价值[24,25]。我国2016年中华医学会骨质疏松和骨矿盐疾病分会发布的《肌少症共识》建议:静息状态下,优势手握力男性>25kg,女性>18kg为正常,可排除肌少症[26]。临床应用中需充分考虑性别、职业、年龄等多种因素对握力测定值的影响,在评定营养状态时,注意动态观察可提高其诊断价值。
机体功能包括肌肉功能减退导致的衰弱状态被认为是营养紊乱或营养不良的一种临床表现形式。常用的衰弱的诊断方法有Fried衰弱表型(The Fried frailty phonotype),该方法包括了非自主体重下降、自觉劳累、握力减退、步速降低和生活能力下降5个方面内容,有3个或3个以上情况被认为存在衰弱状态。有研究将衰弱指数(Frailty index,FI)与MELD-Na评分结合,对等待肝移植期间病死率预测优于单独应用MELD-Na评分[27]。
(5)生物电阻抗分析法(Bioelectrical impedance analysis,BIA)
BIA是用于测量人体成分的常用方法,其原理是:生物组织在不同电流频率下具有不同的阻抗特性,通过测量人体不同部位的生物电阻抗可以推断人体的成分构成。该方法具有易操作、无辐射、客观、可重复性好等优点。目前市场上有多个厂家多种型号的人体成分分析仪可供临床选择。一般可以测量体细胞数量(Body cell mass,BCM)、体内总水份(Total body water,TBW)、细胞外水份(Extracellular water,ECW)、体脂肪(Total body fat,TBF)等指标。其中BCM是机体代谢活跃的参数,主要反映肌体肌肉成分,TBF主要反映能量贮存。这些指标相对客观精确,是终末期肝病患者,尤其是没有体液潴留患者评定人体成分的较好指标[28]。相位角是采用原始数据电阻和容抗通过固定公式直接得出的一项评估营养状况的指标,所以受机体液体分布影响小。相位角越大,完整细胞膜越多,细胞功能越强。多项研究显示,相位角降低是肝硬化患者高病死率的独立危险因素[29]。
(6)双能X线吸收法(DEXA)也是人体成分检测的经典方法之一,可以检测骨密度、脂肪组织和去脂肪组织等人体成分,从而判断营养状态。该方法准确性高,可重复性好,但是由于射线暴露、仪器设备精细昂贵等因素,目前更多应用在骨密度测量和骨质疏松的诊断[30],较少用于临床营养评估。
2.能量代谢检测
人体总能量消耗(Total energy expenditure,TEE)包括基础能量消耗(Basic energy expenditure,BEE)、食物特殊动力作用消耗和体力活动能量消耗。疾病状态下的能量消耗还包括应激对代谢的影响。因此,患者能量需要=BEE×活动系数×应激系数。
基础代谢(BEE)是在餐后12~15 h(一般在清晨睡醒时),全身肌肉放松,情绪和心理平静,周围环境舒适安静,温度在22℃左右的特定条件下测定的能量消耗。静息能量消耗(Resting energy expenditure,REE)是指在温度适宜和安静休息状态下的能量消耗,约占总能量消耗的60%~75%。REE测得的能量消耗比BEE稍大,但是实际工作中,两者之值相差小于10%,而REE相对容易测定,因此,这两个概念常相互替代[31]。
能量代谢情况可以通过间接测热法(代谢车)进行测量。不能进行代谢车检测时,可以应用HB(Harris-Benedict)等公式计算BEE,再根据活动情况和应激情况计算总能量需求。
HB 计算公式:女性:BEE(Kcal/d)=655.0955+9.463W+1.8496H-4.6756A;男性:BEE(Kcal/d)=66.4730+13.751W+5.0033H-6.7550A。其中,W=体重(Kg);H=身高(cm);A=年龄(岁)。一些研究比较了多个公式预测值与代谢车检测的BEE的相关性,结果发现HB公式的准确性相对较高[32]。由于体重是预测公式中重要参数之一,肝硬化等终末期肝病患者存在体液潴留时,可应用干体重计算REE值[33]。
代谢检测还可以检测呼吸商(Respiratory quotient,RQ),各种营养物质在体内氧化时,在同一时间内二氧化碳产生量与耗氧量的比值(CO2/O2)称为呼吸商。RQ反映了三大营养物质代谢供能情况。糖RQ为1,蛋白质RQ为0.80,脂肪RQ为0.7,摄取混合食物时,呼吸商常在0.85左右。研究显示,肝硬化患者RQ较正常人低[34],低RQ可能是患者机体供能底物从碳水化合物转化为脂肪酸氧化和氨基酸糖异生的结果。由于糖异生是耗能过程,故肝硬化患者低RQ常伴有较高的REE,由此可能导致肌肉和脂肪组织的减少。
3.综合评分工具
主观全面评定(Subjective global assessment,SGA)是在临床营养评定中被广泛应用的评分工具。通过收集体重丢失情况、饮食摄入变化情况、身体功能状态、消化道症状等病史信息,以及体格检查测量TSF、肌肉消耗情况、踝部水肿及腹水等共8方面内容,得到患者营养状态(无营养不良、轻-中度营养不良及重度营养不良)的诊断[35]。该方法简单易操作、重复性良好,是临床最常用的综合全面评分工具之一。研究结果显示,SGA的可靠性和特异性较好,对终末期肝病并发症和不良结局的预测有很好的价值[36,37]。但存在主观指标多、可能低估肝硬化患者营养不良等不足[38,39]。英国皇家自由医院于2006年对SGA进行了改良,提出了Royal Free Hospital-Global Assessment(RFH-GA)[40],增加了体重指数、上臂肌围和进食情况,使评价结果更加客观。验证研究结果显示,经RFH-GA诊断的严重营养不良,与肝移植术后感染发生、机械通气时间、ICU时间及总住院时间均有相关性,故RFH-GA可用于终末期肝病预后判断及肝移植分配参考条件[5]。
4.膳食摄入评定
膳食摄入评定即通过对进餐次数,摄入食物的种类和数量等调查,根据《食物成分表》计算出摄入能量和其他营养素情况。膳食评定可以直接评定患者摄入营养素是否满足生理及疾病需求,是评定营养摄入状态、制定营养干预方案及评估营养干预疗效的直接参数。
临床营养膳食调查最常用的方法是24 h膳食回顾法。24 h一般是指从最后一餐开始向前推24 h。食物量通常用家用量具、食物模型或食物图谱进行估计。具体询问获得信息的方式可以通过面对面询问、使用开放式表格或事先编码好的调查表、通过电话、录音机或计算机程序等进行。这种方法操作简单,更容易在临床中推广应用[41]。3天饮食日记法是更为准确的膳食调查方法,需要患者经过培训,准确记录3天中进食的详细情况。我国一项研究[42]对住院肝硬化患者采用3天或4天饮食称重记录法进行膳食调查,结果显示,肝硬化患者尤其是失代偿期肝硬化患者能量及三大营养素摄入量普遍不足。
临床医师在膳食摄入评定时,可根据收集的膳食摄入数量和种类,查询《中国食物成分表》或相关软件计算能量及营养素摄入。有条件的单位建议组建由临床医师、营养师、主管护士甚至临床药师参与的营养支持小组(Nutrition support team,NST)[11]评定患者营养状态并制定个体化营养支持方案。
推荐意见1:肝衰竭患者、Child-Pugh C级或BMI<18.5kg/m2的肝硬化患者,可直接评定营养不良类型及程度。对其他终末期肝病患者需进行营养筛查,有营养不良风险或营养风险的患者进一步评定营养不良类型及程度(B1)。
推荐意见2:应用体重指数、三头肌皮褶厚度、上臂肌围、血清白蛋白水平、能量代谢检测、SGA评分和膳食摄入评定等方法进行营养评定(C1)。应用BMI对终末期肝病患者进行营养评定时,应考虑是否存在液体潴留,必要时可应用“干体重”进行估算(B2)。
推荐意见3:应用握力等方法评定骨骼肌功能。有条件的单位可应用CT或磁共振扫描,计算骨骼肌指数SMI(cm2/m2)来评定肌量。条件允许时可应用生物电阻抗分析法(BIA)进行人体组成评定(B1)。
推荐意见4:有条件的单位应组建由临床医师、营养师、主管护士及临床药师参与的营养支持小组进行营养评定(B1)。
三、终末期肝病患者营养支持治疗及随访管理
(一)肝硬化患者营养支持治疗及随访管理
1.营养支持治疗目的及目标
营养支持治疗指经肠内或肠外途径为患者提供适宜的营养素的方法。其目的是使人体获得营养素保证新陈代谢正常进行,抵抗疾病侵袭进而改善患者的临床结局,包括降低感染性并发症发生率,减少住院时间等,使患者受益[43]。
对评定营养不良的肝硬化患者应给予营养支持治疗。肝硬化患者营养不良主要是蛋白质能量营养不良,营养支持治疗的首要目标是达到能量和蛋白质的目标摄入量[44]。
2.能量和蛋白质摄入
研究显示,肝硬化患者24 h总能量消耗约是静息能量消耗的1.3~1.4倍[45]。营养不良的肝硬化患者每日建议摄入30~35 kcal/kg.d或1.3倍REE,以满足代谢需求[9]。
蛋白质摄入不足是肝硬化营养不良的重要因素。充足的蛋白质摄入避免了负氮平衡,对肝硬化患者预后有益[46]。建议肝硬化患者摄入蛋白质1.2~1.5g/kg·d以维持氮平衡,降低肌肉减少发生率[9,47]。
临床上普遍存在为预防肝性脑病发生或加重而限制蛋白质摄入的现象。最近研究显示,低蛋白质饮食及由此导致或加重的肌少症是肝硬化患者,包括经颈静脉肝内门体静脉分流术(Transjugular intrahepatic portosystemic shunts,TIPS)术后患者发生肝性脑病的独立危险因素[48]。关于蛋白质来源,植物蛋白耐受性优于动物蛋白[49],同时可以摄入丰富的膳食纤维,可通过调节肠道微生态和通便,来预防或减轻肝性脑病。近期印度一项前瞻性随机对照研究,将120例诊断为轻微肝性脑病的肝硬化患者,随机分为营养治疗组(能量30~35 kcal/kg·d,植物蛋白 1.0~1.5 g/kg·d)和对照组(正常进食),治疗6个月,结果显示,营养治疗组患者轻微肝性脑病恢复比例及生活质量评分明显高于对照组,发生显性肝性脑病的比例明显低于对照组[50]。因此,轻度肝性脑病患者无需减少甚至禁止蛋白摄入,对于严重肝性脑病患者,可根据肝功能及肝性脑病等情况综合判断,酌情减少或短暂限制蛋白摄入,并尽早根据患者耐受情况逐渐增加蛋白质摄入至目标量。建议肝性脑病患者将每日蛋白质摄入总量分散到多次进餐(4~6次小餐)以改善耐受性[51]。
近年,超重或肥胖的肝硬化患者逐渐增多,尤其是在NAFLD相关肝硬化更为常见。研究显示肥胖增加肝硬化不良预后的发生率,通过生活方式干预减重(≥5%~10%体重)可以改善肥胖肝硬化患者预后[52]。建议肥胖的肝硬化患者(干体重 BMI >30 kg/m2)能量摄入可减少至 25 kcal/kg·d,同时应注意在减重过程中防止肌肉丢失,建议代偿期肥胖肝硬化患者可增加蛋白质摄入>1.5 g/kg·d[53],失代偿期患者可根据血氨和肝性脑病等情况酌情调整蛋白质摄入量。
3.支链氨基酸制剂的应用
肝硬化患者的氨基酸失衡主要表现在支链氨基酸(Branched chain amino acid,BCAA)水平降低,芳香族氨基酸(Aromatic amino acids,AAA)水平升高,BCAA/AAA 比值下降。这种氨基酸失衡可能导致肝性脑病或其他神经系统并发症,与终末期肝病不良预后相关[47]。研究结果显示,对经口摄入蛋白不能耐受的患者给予BCAA制剂(0.25 g/kg·d)[53],或不能耐受动物蛋白的患者给予植物蛋白及BCAA制剂可以改善肝性脑病症状。一项meta分析对BCAA治疗肝性脑病疗效进行了分析,结果显示,BCAA治疗可以改善肝性脑病症状,但是对肝硬化肝性脑病患者病死率无显著影响[54]。
4.关于维生素和微量元素
终末期肝病患者,由于肝功能损伤导致食物摄入减少、吸收不良、储备减少等原因,常存在维生素不足。B组维生素缺乏在终末期肝病患者尤其是在酒精性肝病患者中常见。酒精性肝病患者维生素B1缺乏可出现Wernicke’s脑病,为预防Wernicke’s脑病,在酒精性肝病患者应用静脉葡萄糖进行营养支持前应给予补充维生素B1[8]。脂溶性维生素缺乏常见于胆汁淤积性肝病、酒精性肝病等。据报道约有88%的肝硬化患者存在维生素D缺乏,血清25(OH)D水平和MELD评分、Child-Pugh评分负相关,有条件的单位终末期肝病患者可检测维生素D水平[55]。2018年EASL肝病临床营养指南建议,维生素D缺乏患者血清25(OH)D低于20 ng/ml时,可以口服补充维生素D,使血清25(OH)D达到30 ng/ml[9]。硒(Se)是一种重要微量元素,研究发现肝硬化时血清硒水平降低[56],补充硒制剂可以通过降低免疫炎症反应等机制改善肝病病情[57]。研究显示,伴有营养不良的肝硬化患者常存在锌(Zn)缺乏[58],锌缺乏可能在肝性脑病发病中发挥作用。但是补充锌制剂后是否能够改善神经系统症状尚有争议[59,60]。由于很多维生素和微量元素的检测在临床尚未普及,目前终末期肝病维生素和微量元素水平的确切情况、补充维生素和微量元素后对疾病预后的改善情况均缺乏高质量报告。但是推荐进食不足的肝硬化患者,尤其是可能或确定营养不良的患者,在有经验的营养师或医师的指导下,应用复合维生素制剂,同时注意补充多种微量元素。
5.营养支持治疗途径选择
营养支持治疗途径选择的原则是:在胃肠功能允许情况下,患者获取能量和营养素的首要途径是经口饮食,经口饮食摄入的能量和营养素不能满足需求时,可给予口服营养补充剂(Oral nutritional supplements,ONS),不宜经口进食或经口进食及口服营养补充仍不能满足需求时,可在充分评估消化道出血等风险情况下,经鼻胃管或鼻空肠管给予管饲肠内营养。经口摄入和肠内营养仍不能满足营养需求时,应给予肠外营养。
营养支持小组(NST)制定肝硬化患者个体化营养支持治疗方案,并通过患者宣教等方式,对营养支持治疗方案进行督导实施,可以提高存活率,改善生活质量[61]。
由于肝糖原储备能力下降,肝硬化患者饥饿10 h引起的代谢异常相当于健康人饥饿2~3天的代谢状态,所以当肝硬化患者长时间饥饿肝糖原储备不足时,肌糖原动员和脂肪酸氧化增加进而导致肌肉减少。因此,避免长时间空腹可以减少肝硬化患者肌肉消耗。已有多项研究显示,夜间加餐可以改善氮平衡,提高生活质量。meta分析结果显示,夜间加餐可以提高RQ值,增加碳水化合物供能比例,提高白蛋白和胆碱酯酶水平[62]。夜间加餐可选择以碳水化合物为主或富含BCAA的制剂,对预防骨骼肌减少、改善高氨血症等有积极作用[63]。除夜间加餐外,日间加餐-少食多餐,将每日摄入能量和蛋白质等营养素分至4~6次小餐,以避免长时间饥饿状态,可以促进蛋白质和能量吸收,有助于防止肌肉减少[51,64]。
住院期间不可避免会有一些检查或治疗需要较长时间空腹,在预计空腹需要10 h以上时,可给予静脉输入葡萄糖以维持代谢需求[8]。预计3天不能进食者,应给予全肠外营养支持。
轻度肝性脑病患者可耐受正常进食者建议首选经口进食摄入热量和其他营养素。严重肝性脑病不宜或不能经口进食者,建议经鼻胃管或鼻空肠管给予管饲肠内营养进行营养支持治疗。食管胃底静脉曲张不是经鼻胃管或空肠管管饲的禁忌症,但亦应充分评估患者的凝血情况、消化道出血等风险。
当肠内营养仍不能满足营养需求时,应给予肠外营养。全肠外营养时应同时补充宏量和微量营养素。葡萄糖供能占非蛋白能量不低于50%~60%,由于长链脂肪乳长期输注可导致肝脏损伤和胆汁淤积,建议终末期肝病患者肠外营养应用结构脂肪乳(含有人体必需脂肪酸,且对肝功能影响小)或中/长链脂肪乳[65](≤1 g/kg·d)[66]。密切监测肝肾功能、血糖、电解质等指标。
6.肝硬化患者营养随访管理
住院肝硬化患者经筛查有营养不良风险或营养风险者应进行营养评定,以确定营养不良类型及程度;诊断营养不良的患者应给予营养支持治疗;营养干预期间应定期监测营养状态以评估营养干预疗效。对于营养筛查无风险患者,住院期间建议定期复测。出院后门诊随访期间,建议肝硬化患者尤其是失代偿期患者注意监测营养状态,筛查营养不良风险或营养风险。
加强对肝硬化患者及家属应营养宣教:对大多数肝病患者,除酒精外,没有食物是绝对禁忌的,食物多样化、摄入充足的能量和蛋白质等多种营养素是非常重要的[9]。食物的外观、口味、质地、温度,进食时情绪等均影响经口进食摄入量[67],鼓励患者家属根据患者个体饮食习惯调整,以促进饮食摄入和营养素的吸收;建议分餐至4~6餐,含夜间加餐,可酌情多摄入新鲜蔬菜和水果,减少食盐摄入。注意监测血糖、电解质等指标。有食管胃静脉曲张患者及肝性脑病患者进食注意事项应具体咨询医师。
推荐意见5:营养不良的肝硬化患者需进行营养支持治疗。营养支持治疗的基本目标是摄入足够的能量和蛋白质。建议肝硬化患者每日能量摄入量30~35 kcal/kg·d或1.3倍REE。每日蛋白质摄入1.2~1.5 g/kg·d(B1)。
推荐意见6:避免为预防肝性脑病而禁止或限制蛋白质摄入;轻微肝性脑病患者可不减少蛋白质摄入量;严重肝性脑病患者可酌情减少或短暂限制蛋白质摄入,根据患者耐受情况,逐渐增加蛋白质摄入至目标量。肝性脑病患者或蛋白质不耐受患者可应用BCAA制剂改善肝性脑病症状(B2)。
推荐意见7:进食不足的肝硬化患者可在有经验的营养师或医师的指导下补充维生素和微量元素(C1)。
推荐意见8:肝硬化患者应避免长时间饥饿状态,分餐至4-6次小餐(三餐+3次加餐,含夜间加餐),可以促进蛋白质和能量吸收,有助于防止肌肉减少(A1)。
推荐意见9:经口进食不能满足能量及营养素摄入需求时,应给予经口营养补充剂,仍不能满足需求时,建议评估患者营养状态、消化吸收功能、疾病情况(包括消化道出血等风险)及耐受情况等因素,酌情给予管饲肠内营养或肠外营养(C1)。
推荐意见10:对肝硬化患者尤其是失代偿期患者定期监测营养状态,筛查营养不良风险或营养风险。有风险患者应进行详细营养评定以确定营养不良类型及程度。诊断营养不良的患者应给予营养支持治疗(C1)。
推荐意见11:应加强对肝硬化患者及家属的营养宣教,强调食物多样化、摄入充足的能量和蛋白质等多种营养素的重要性,鼓励患者家属根据患者个体饮食习惯调整,以促进患者营养素的摄入和吸收(C1)。
(二)肝衰竭患者营养支持治疗及随访管理
1.营养支持治疗目标
对评定有营养不良的肝衰竭患者应给予营养支持。肝衰竭患者营养支持的基本目标是摄入足够的能量和蛋白质。肝衰竭患者病情复杂危重,变化快,不同病因、不同病情阶段患者能量及营养代谢差异很大[68],因此,建议有条件的单位尽可能应用间接能量测定法(代谢车)对代谢进行监测[9],无法进行代谢车测定的患者可应用HB公示计算基础能量消耗,推算总能量需求。能量摄入目标是1.3倍REE,或30~35 kcal/kg·d,每日蛋白质摄入 1.2~1.5 g/kg·d[7],应根据患者耐受情况,逐步增加能量和蛋白质摄入至目标值。
2.营养支持治疗途径及方式
进展期肝衰竭患者由于肝功能严重异常、极度乏力、消化道症状明显、胃肠道功能不全、肝性脑病、腹水等多种原因,经口摄入能量和营养素通常难以达到理想目标。有条件的单位应用代谢车进行REE检测,结合代谢情况、疾病严重程度、膳食摄入情况、饮食习惯等,由营养支持小组进行综合评定,制定个体化营养支持方案并督导实施,可以提高患者能量及蛋白摄入量,使更多患者达到营养摄入目标。首先接受饮食指导,包括分餐及夜间加餐[69]、补充维生素和微量元素等,监测患者能量及蛋白摄入,酌情调整营养支持方案,必要时给予肠内营养补充或肠外营养[33]。
肝衰竭患者营养支持治疗首选途径是经口进食,必要时可以给予经口或经鼻胃管/空肠管管饲肠内营养[70],在肠内营养不能满足需求时,应给予肠外营养[16]。虽然肠外营养可能增加感染等并发症风险,但是也有研究显示,肠外营养并未增加ICU患者病死率[71,72],且可以更好达到营养摄入目标[73]。建议肝衰竭患者肠外营养应用结构脂肪乳或中/长链脂肪乳[65]≤1 g/kg·d[66],并且注意监测肝功能等。
肝衰竭患者普遍经口摄入营养素不足,可常规给予口服或静脉补充多种维生素和微量元素。
急性肝衰竭或慢加急性肝衰竭进展期,由于肝细胞大量坏死,病情进展迅猛,常合并多脏器功能衰竭。治疗最重要的是稳定新陈代谢和生命体征,促进肝脏再生,预防或治疗脑水肿。急性肝衰竭时碳水化合物、脂肪和蛋白质代谢严重紊乱,蛋白质分解增多导致低蛋白血症和高氨血症,糖代谢受损常导致血糖异常和高乳酸血症。经评定有营养不良的急性肝衰竭患者应给予营养支持治疗,在发病早期没有明显营养不良表现的患者,应根据疾病情况及膳食摄入情况评估,预计在短期内可能出现营养不良的患者也应给予营养支持治疗。营养支持治疗时应根据患者耐受情况,低剂量开始,逐步增加能量和蛋白质摄入,密切监测血糖、血氨、乳酸、凝血等指标。
3.营养随访管理
低血糖在肝衰竭患者中常见并且与预后相关[74],因此,肝衰竭患者应密切监测血糖水平,积极防治低血糖或高血糖[7,8]。肝衰竭患者住院期间,建议定期评定患者营养状态,评价营养支持效果,必要时根据患者个体营养摄入情况、疾病情况等酌情调整营养支持方案。应注意在病情出现变化时,需再次评定患者营养状态,以确定营养因素在病情变化中的作用,必要时调整营养干预方案。出院后肝功能恢复患者随访管理可参照肝硬化患者随访管理方案。
推荐意见12:肝衰竭患者可直接进行详细营养评定,以确定营养不良类型及程度。由营养支持小组对肝衰竭患者进行综合营养评定、制订个体化营养支持治疗方案并督导方案实施(A2)。
推荐意见13:有条件的单位,建议应用间接能量测定(代谢车)测定患者REE,根据患者疾病情况、营养状态、消化吸收功能等综合因素逐步达到每日1.3倍REE或30~35 kcal/kg.d的能量摄入,根据肝性脑病等情况,酌情给予逐步达到1.2~1.5 g/kg.d的蛋白摄入目标(B1)。
推荐意见14:经口摄入不足的肝衰竭患者,建议给予口服或静脉补充多种维生素和微量元素(C1)。
推荐意见15:肝衰竭患者应密切监测血糖水平,积极防治低血糖或高血糖(B1)。
推荐意见16:建议动态评定患者营养状态,在病情出现变化时,需再次评定患者营养状态,以确定营养因素在病情变化中的作用,必要时调整营养支持治疗方案(C1)。
(三)肝癌患者营养支持治疗及随访管理
1.目的和目标
肝癌患者营养支持治疗的目的是通过恰当有效的营养干预,改善患者营养状态和肝功能,增强对手术或其他治疗的耐受能力,减少治疗过程中并发症,提高生活质量,延长存活时间。营养支持的首要和基本目标仍然是摄入目标量的能量和蛋白质等营养素。稳定期肝癌患者建议能量摄入30-35 kcal/kg·d 或 1.3 倍 REE,蛋白质摄入 1.2~1.5 g/kg·d以满足代谢需求。进展期肝癌患者酌情调整。
2.肝癌患者接受治疗期间营养支持要点
肿瘤进展及肿瘤相关治疗常导致肝功能进一步恶化,进而出现或加重营养不良,营养不良进一步影响肝癌患者预后形成恶性循环[75,76]。不同肝癌患者接受营养支持治疗有各自的特点。
(1)关于接受肝癌切除术治疗患者的营养支持
术前存在营养不良或肌少症将增加肝癌切除手术患者病死率[77],建议术前评估营养状态,遵循快速康复外科方案,包括术前调整进食时间、术后尽早进食进水等措施。术后早期经口摄入营养素不足时,可酌情给予经鼻胃管/空肠管管饲肠内营养支持,不宜肠内营养或肠内营养不能满足需求时可通过肠外营养补充,避免单纯输入葡萄糖[9]。
一个纳入5项前瞻性RCT研究的meta分析,比较了肝部分切除术后早期肠内营养与肠外营养支持的效果,结果显示,术后早期给予肠内营养是安全的,且与肠外营养支持相比,并发症发生率较低[78]。关于营养支持治疗内容,meta分析显示,BCAA有助于肝癌治疗后肝功能改善(主要是白蛋白水平)、腹水和水肿减少、生活质量提高,但是对降低病死率和肿瘤复发等作用并不确切[79]。
(2)关于接受肝动脉导管动脉化疗栓塞术(Transcatheter arterial chemoembolization,TACE)或局部消融治疗的肝癌患者的营养支持
营养支持治疗目的是改善患者营养状态和肝功能,提高对可能的多次治疗的耐受性,提高生活质量,延长生存时间。研究显示,夜间加餐或富含BCAA营养制剂长期应用,可以促进射频消融治疗或TACE治疗后患者肝功能恢复[80][81]。
(3)关于接受有明显胃肠道反应的化疗药物、靶向药物治疗的肝癌患者的营养支持
多项研究显示,伴有营养不良的肝癌患者接受索拉菲尼等靶向药物治疗后,病死率高于营养状态良好患者[82,83],因此,建议对准备或正在应用靶向药物治疗的肝癌患者密切监测营养状态,有营养不良的患者给予营养支持治疗。
(4)关于肝癌维持治疗患者的营养支持
肝癌终末期患者临终前,常处于极度低代谢状态,正常能量和液体等物质的输入有可能进一步加重代谢负担,患者在生活质量和疾病转归获益均非常有限,因此,营养支持的目标是在充分考虑患者疾病状态、治疗意愿及家属理解情况下,选择患者在生理和心理上最为舒适的进食或干预方式[84,85]。
3.肝癌患者营养随访管理
住院接受各种治疗的肝癌患者,住院期间建议在治疗前进行营养筛查,对有营养不良风险或营养风险的患者进行详细营养评定,以判断营养不良类型及程度,有营养不良的患者应给予营养支持治疗。进行营养干预患者监测营养状态以评估营养干预疗效。肝癌治疗后应动态观察营养状态。
出院后门诊随访期间,建议定期评估营养状态,筛查营养风险。结合营养不良类型和程度、肝癌进展情况、肝功能、下一步治疗计划等综合因素制定包括营养支持在内的治疗方案。
推荐意见17:有营养风险或营养不良的肝癌患者需进行营养支持治疗(B1)。稳定期肝癌患者每日能量和蛋白质摄入量同肝硬化患者(详见推荐意见5);进展期肝癌患者酌情调整(B1)。
推荐意见18:进食不足的肝癌患者,可在有经验的营养师或医师指导下补充微量元素和维生素(C1)。
推荐意见19:肝癌终末期患者临终前,营养支持治疗应在充分考虑患者疾病状态、治疗意愿及家属理解情况下,选择患者在生理和心理上最为舒适的进食或干预方式(C1)。
推荐意见20:肝癌患者接受外科手术、TACE、局部消融治疗、放/化疗或靶向药物治疗前、治疗期间及治疗后应监测营养状态(C1)。
(四)特殊患者的营养支持及管理
1.肝硬化腹水限盐患者的营养支持
肝硬化腹水的治疗包括限制钠盐摄入,应注意限盐可能导致食物口味改变等引起患者饮食摄入减少,导致能量及多种营养素摄入减少[86]。因此,建议限盐过程中定期监测患者营养状态,若膳食摄入减少或出现营养不良,应酌情给予口服营养补充剂或肠内营养制剂,必要时给予肠外营养补充。
2.肝硬化消化道出血患者的营养支持
食管胃底静脉曲张破裂导致的消化道出血是肝硬化患者常见危重并发症。由于经口进食会增加消化液分泌、促进胃蠕动、增加脾脏及门脉血流等,从而加重消化道出血,活动性消化道出血期间常需要禁食禁水,但最后一次出血后24~48 h后应根据大便颜色等情况,逐渐恢复经口饮食:流食-半流食-软食。禁食期间建议给予肠外营养,注意热量和多种营养素补充,密切监测血糖、电解质、肝肾功能、血常规、便潜血等。在逐渐恢复饮食过程中,能量及营养素摄入不能满足需求时,可根据个体情况给予肠内营养制剂或肠外营养补充。
对于肝硬化伴有食管胃底静脉曲张接受内镜下硬化治疗的患者,治疗后早期开始强化营养治疗,有可能促进内镜治疗后局部损伤的愈合和血管闭塞,预防并发症发生及提高总体疗效[87,88]。
3.酒精性肝硬化患者营养支持
酒精性肝硬化营养问题在临床上较其他病因更为常见且突出,其主要原因是不健康的生活方式、对治疗依从性差等[53,89]。酒精性肝硬化患者具体营养支持目标及方法,可根据病情参考肝硬化或肝衰竭患者推荐意见。特别注意加强对这部分患者及家属的宣教工作。遵从医嘱,严格戒酒,进行饮食和作息等生活方式调整,是改善患者营养状态和疾病预后、提高生活质量的基础。
4.终末期肝病接受肝移植患者的营养支持
肝移植术前营养不良患者,术后病死率及并发症发生率均增高,摄入能量和蛋白质不足可增加移植等待期间病死率[90]。建议对等待肝移植的终末期肝病患者进行营养筛查和评定,有营养不良的患者应给予营养支持治疗。营养支持的目标可根据患者具体情况,酌情摄入能量30~35 kcal/kg·d,蛋白质摄入1.2~1.5 g/kg·d[9]。
肝移植术后早期(12~24 h内)酌情从低剂量开始给予经口饮食/管饲给予肠内营养,可以减少感染等并发症发生。或肠外营养支持,密切监测血糖、血氨、肝肾功能等。研究显示肝移植术后患者营养状态完全恢复需要很长一段时间(至少1年以上)[53,91],且肝移植后长期存活者肥胖或代谢综合征常见[92]。肝移植术后患者应定期监测营养风险,评估营养状态,无论体重是否降低均应注意评估有无肌肉减少症,必要时酌情给予营养支持和生活方式干预[9]。
四、待解决的问题及未来研究方向
关于终末期肝病营养诊断和治疗,在临床实践过程中仍存在诸多问题,需要不断探索和解决。
1.营养筛查和评定尚无统一公认的“金标准”;营养风险、营养不良风险等概念容易混淆;目前常用的筛查工具及评定方法大多为国外学者基于国外患者数据设计制定,亟需开发基于我国终末期肝病患者数据的营养筛查工具和评定方法。
2.我国地域辽阔,民族众多,经济卫生发展水平不一,不同地区、不同民族饮食习惯和饮食结构差异大,营养相关人口学资料不全。因此,需要肝病临床专家、CDC专家、营养学专家等共同努力,不断积累和完善相关资料。
3.终末期肝病患者病情重、并发症多、病死率高、个体差异大,营养支持过程中混杂干扰因素众多,对开展临床研究带来困难。所以,更需要多中心、前瞻性、设计良好的高质量临床研究,同时加强营养基础科学研究工作。
4.我国临床营养学科总体起步较晚、水平偏低、人员配备不足;营养研究队伍起点不高、规模很小、受重视程度不够。营养制剂尤其是适合肝病的制剂匮乏,临床选择明显受限。以上问题都将随着我国经济与健康水平的发展,全社会对营养及营养学科的重视,不同学科对肝病营养问题认识的提升而逐步得到解决。
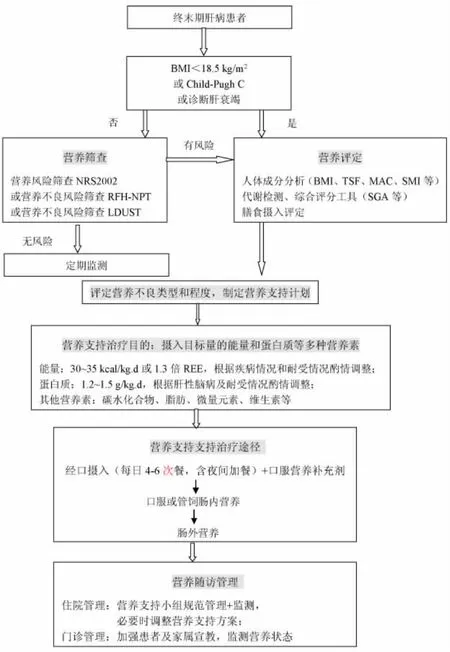
终末期肝病患者营养筛查、评定、支持治疗及随访管理流程图
编委名单(按姓氏笔画排序):
于淑清 马 雄 王凤梅 王 磊 尤 红 田德安
白文元 任 红 华 鑫 庄 辉 刘玉兰 李 军
李 杰 杨云生 杨东亮 张大志 张 国 张欣欣
张跃新 陆 伟 陆伦根 陈 智 陈 煜 范建高
尚 佳 周新民 郑素军 孟庆华 南月敏 段钟平
侯金林 袁平戈 贾继东 徐小元 唐 红 韩 英
韩 涛 谢渭芬 窦晓光 魏 来
编写秘书:孔 明

