微小RNA-133b对心肌纤维化的影响
张松林,范粉灵,魏 峰,王 军,张玉顺
西安交通大学第一附属医院结构性心脏病科,西安710061
心肌纤维化(myocardial fibrosis,MF)是由反复或持续性心肌缺血引起的结果,主要表现为纤维结缔组织增多、弹性变差、实质细胞减少,最终导致心肌结构破坏、功能衰竭[1]。微小RNA(microRNA,miRs)是一类大小约为18~25个核苷酸的RNA,其作用机制为通过促进靶基因mRNA的降解或者抑制靶基因的翻译来抑制靶分子的表达。研究表明,miRs与心肌梗死后MF心室重构相关[2-4]。Zhang等[5]研究发现,miR-29参与了MF过程,过表达miR-29后,MF过程被抑制,而敲低miR-29后,MF相关蛋白表达上升,说明miR-29可抑制MF进程。Thum等[6]研究显示,miR-21可通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路调控心肌细胞间质纤维化。此外,多种miRs,如:miR-133a[7]、miR-503[8]、miR-101[9]和miR-29[5,10]被证实能够影响心肌成纤维细胞(cardiac fibroblasts,CFs)的生理功能进而发挥抗纤维化作用。miR-133b是与miR-133a同家族的miR,有研究表明miR-133a可抑制心肌纤维化,但是对于miR-133b与心肌纤维化的调控关系尚不明确,以往对miR-133b的研究主要集中于肿瘤,在MF过程中的研究鲜有报道。本研究探索了miR-133b对MF的影响,以期为探寻新型治疗和干预MF的靶分子提供理论依据。
材料和方法
材料CFs由中国科学院上海细胞库提供。RPMll640培养基和胎牛血清购自美国Gibco公司,miR-133b mimic及miR-133b inhibitor均购自广州锐博公司,X-treme GENE siRNA转染试剂购自瑞士罗氏公司,CCK8检测试剂盒由日本同仁化学研究所提供,结缔组织生长因子(connective tissue growth factor,CTGF)、collagenⅠ、collagen Ⅲ、α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)及β-actin抗体购自美国Cell signaling公司。
人CFs细胞培养采用含100 ml/L胎牛血清的RPMI 1640培养基,于37℃、5%CO2的细胞培养箱中培养。
细胞转染将细胞以2×105个/孔接种于6孔板中,24 h后细胞融合度达30%~40%。配制转染试剂混合液:A(每孔):转染试剂5 μl+无血清无双抗RPMI 1640 100 μl。B(每孔):miR-133b mimic(miR-133b inhibitor)或control mimic(control inhibitor)7.5 μl(20 μmol/L)+无血清无双抗RPMI 1640 100 μl。室温静置5 min后混合A、B两种试剂,室温静置20 min为C液。弃去细胞原培养液,加入C液200 μl及含10%血清的RPMI 1640培养基1.3 ml,轻晃混匀后置于37℃、50 ml/L CO2培养箱中培养,转染48 h后提取mRNA,转染72 h后提取蛋白,进行后续实验。
CCK8法检测细胞增殖取对数生长期细胞,消化后离心,细胞收集后用含100 ml/L胎牛血清的RPMI1640重悬,反复吹打,制成单细胞溶液,以每孔1000个细胞接种于96孔板中,每组设置3个复孔,置于37℃、50 ml/L CO2培养箱中培养21、45、69、93、117 h后,加入10 μl CCK8于每孔细胞中,继续培养3 h后测定吸光度值。
Western blot检测提取总蛋白,BCA法测定总蛋白浓度,制好胶后,每个泳道以30μg蛋白上样,60V恒压电泳至样品跑齐成1条直线,90V恒压电泳至样品中的溴酚蓝到达浓缩胶和分离胶的分界线处,将电压调至120V继续电泳达到胶底部,转膜完成后将NC膜取出,根据目的蛋白和内参蛋白的相对分子质量大小将NC膜裁剪成条状,标记后浸泡于封闭液中,室温下脱色摇床上封闭1 h;将NC膜置于抗体孵育盒中,加入适量相应一抗,4℃过夜;TBST洗膜5次,每次8 min;用封闭稀释液稀释二抗;将NC膜置于抗体孵育盒中,加入适量相应二抗,室温孵育1 h,TBST洗膜8 min×5次。加入发光试剂ECL曝光。
qRT-PCR提取RNA,采用美国Thermo公司的反转录试剂盒行进RNA反转录。将引物干粉稀释成10 μmol/L的工作浓度,以反转录所得cDNA为模板,按下述体系配制实时定量PCR反应液:SYBY Green 10 μl,上游引物0.4 μl,下游引物0.4 μl,cDNA模板2.0 μl,ddH2O 7.2 μl;反应条件:95℃ 30s;95℃ 5s,60℃ 30s,72℃ 30s,共40个循环。每次实验均设未加模板的阴性对照组,每个样品设置3个复孔,重复实验3次,采用2-ΔΔCt方法计算相对表达量(relative quantity,RQ),比较每组之间的基因表达差异。
双荧光素酶报告实验构建含有CTGF mRNA的3’UTR(WT)及其3’UTR突变体(MUT)的双荧光报告基因系统。方法是针对CTGF 3’UTR预测结合miR-133b区域,设计PCR引物,将PCR产物连在骨架质粒pMIR REPORT Luciferase中,导入感受态细胞后摇菌,进行克隆筛选后送北京华大公司基因测序,结果经比对正确后再摇菌小提得到目的质粒。在CFs中共转染miR-133b mimic、WT及pRL-TK(内参质粒),转miR-133b mimic control、WT及pRL-TK(内参质粒)作为对照,24 h后采用检测试剂盒检测。对确认有效的CTGF 3’UTR区域,利用重叠PCR原理设计引物制造结合区域点突变,余过程如上。
统计学处理采用SPSS 22.0统计软件,符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本双侧t检验;组间构成比比较采用χ2检验;P<0.05为差异有统计学意义。
结 果
瞬时转染miR-133b mimic及miR-133b inhibitor后miR-133b的表达变化在CFs转染miR-133b mimic或inhibitor 48 h后提取RNA,实时定量PCR检测结果显示,转染miR-133b mimic后miR-133b的表达水平明显高于阴性对照组(1比1.46×105;t=26.219,P=0.000),转染miR-133b inhibitor后miR-133b的表达水平明显低于阴性对照组(1比0.42;t=6.738,P=0.003)。
miR-133b抑制CFs增殖转染CFs 21、45、69、93和117 h后,与阴性对照组相比,miR-133b mimic组CFs增殖能力明显降低,而miR-133b inhibitor组CFs增殖水平明显上升(P均<0.05)(图1)。
miR-133b对CFs中CTGF、collagenⅠ、collagen Ⅲ和α-SMA的表达水平影响与阴性对照组相比,过表达miR-133b后,CTGF(t=9.213,P=0.001;t=8.195,P=0.001)、α-SMA(t=6.511,P=0.003;t=4.434,P=0.011)、collagenⅠ(t=3.172,P=0.034;t=4.053,P=0.015)及collagen Ⅲ(t=6.404,P=0.003;t=5.319,P=0.006)的mRNA和蛋白表达水平均明显下调;敲低miR-133b后,CTGF(t=9.439,P=0.001;t=14.100,P=0.000)、α-SMA(t=4.519,P=0.011;t=4.377,P=0.012)、collagenⅠ(t=5.966,P=0.004;t=5.514,P=0.005)及collagen Ⅲ(t=4.622,P=0.010;t=4.996,P=0.008)的mRNA和蛋白表达水平均明显上升(图2)。
CTGF为miR-133b的靶基因将miR-133b mimic或mimic control与WT 3’UTR表达载体或MUT 3’UTR表达载体以及海肾荧光素酶表达载体共转染CFs,检测并比较不同实验组荧光素酶的相对活性,结果显示,共转染miR-133b mimic和WT 3’UTR表达载体细胞的相对荧光素酶活性明显低于共转染mimic control和WT 3’UTR表达载体的细胞(t=5.654,P=0.005),共转染miR-133b mimic和MUT 3’UTR表达载体细胞的相对荧光素酶活性与共转染mimic control和MUT 3’UTR表达载体的细胞差异无统计学意义(t=0.380,P=0.724)(图3)。

CFs:心肌成纤维细胞
CFs:cardiac fibroblasts
A.过表达miR-133b抑制CFs增殖;B.敲低miR-133b促进CFs增殖
A.miR-133b overexpression inhibited proliferation of CFs;B knockdown of miR-133b promoted proliferation of CFs
图1miR-133b对CFs增殖的影响
Fig1Effect of miR-133b on the proliferation of CFs
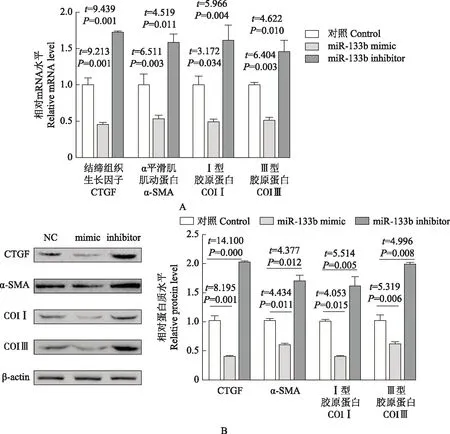
CTGF:结缔组织生长因子;α-SMA:α平滑肌肌动蛋白
CTGF:connective tissue growth factor;α-SMA:α-smooth muscle actin
A.mRNA水平;B.蛋白水平
A.mRNA level;B.protein level
图2miR-133b对纤维化相关指标的影响
Fig2Effect of miR-133b on fibrosis-related indicators
讨 论
MF是心肌组织重构的表现之一,是由反复或持续性心肌缺血导致的。因此,许多心血管疾病,如心肌梗死、心力衰竭等的基础病变之一即为MF。深入了解心肌纤维化的发生机制,明确其进程中的关键分子可能为抑制MF,逆转心脏重构的精准治疗提供新的靶点。CFs是纤维化时细胞外基质重要的来源细胞,当CFs被激活增殖,细胞外基质合成分泌增加,进一步促进了纤维化。因此,抑制CFs活化增殖是抑制MF的关键点[11]。本研究结果显示,过表达miR-133b可以抑制CFs增殖,提示miR-133b可能参与了MF的过程。
CTGF又名CNN2,是基质细胞蛋白家族成员,由349个氨基酸组成,相对分子质量为34 000~38 000,是一种富含半胱氨酸的分泌肽。在正常心肌组织中,CTGF主要存在于内皮细胞;在多种诱因所致的心肌纤维化中,CTGF在成纤维细胞中表达上调[5]。在心肌组织受损后出现,许多平滑肌细胞标记物在心肌成纤维细胞中表达升高,如α-SMA,其聚集于应力纤维可以通过细胞表面特殊的黏附因子改变细胞外基质的结构[3]。Ⅰ、Ⅲ型胶原是构成心肌胶原网络的主要成分,胶原纤维的数量、分布及排列发生改变均可导致纤维化的发生,是心肌纤维化的物质基础[3]。本研究结果显示,过表达miR-133b可以抑制CFs中的CTGF、collagenⅠ、collagen Ⅲ和α-SMA水平,而抑制miR-133b可以增加CFs中的CTGF、collagenⅠ、collagen Ⅲ和α-SMA水平,提示miR-133b可抑制心肌纤维化过程。
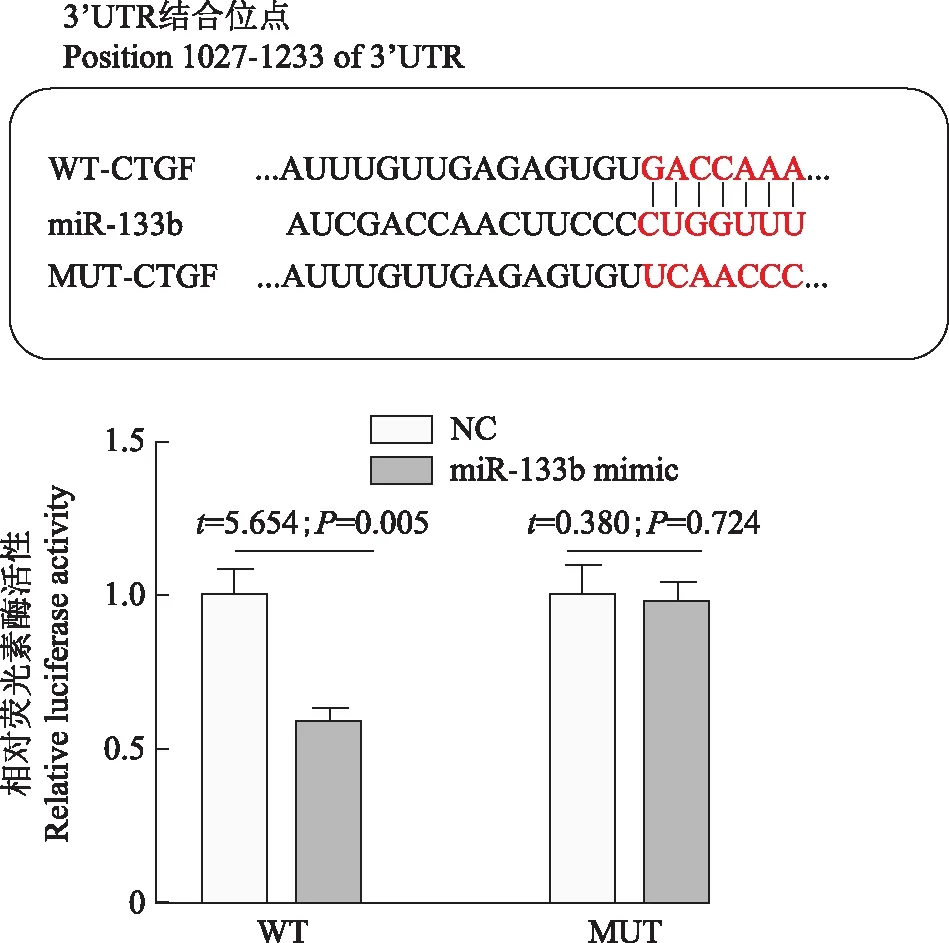
WT:野生型CTGF3’UTR表达载体;MUT:突变型CTGF 3’UTR表达载体
WT:wild-type CTGF 3’UTR expression vector;MUT:mutant CTGF 3’UTR expression vector
图3miR-133b靶向抑制CTGF
Fig3miR-133b targeted CTGF
研究显示,CTGF作为转化生长因子β下游分子在MF中起重要作用,发生MF时,CTGF的表达水平明显上调。本研究采用生物学软件分析CTGF的3’UTR区存在miR-133b结合的“种子区域”,结果发现CTGF为miR-133b的靶基因,双荧光素酶报告实验也证实了miR-133b可靶向抑制CTGF的表达。
综上,本研究结果显示,过表达miR-133b可抑制CFs增殖,并下调纤维化指标CTGF、α-SMA、collagenⅠ、collagen Ⅲ的mRNA及蛋白表达水平,反之亦然,且CTGF为miR-133b的靶基因。提示miR-133b可能是通过靶向抑制CTGF来影响CFs的活化增殖,从而改善心肌纤维化。

