多药耐药基因-1高表达可加剧类风湿关节炎患者对氨甲蝶呤的耐药
王 佳,毛 妮,谢 希,李 姝,陈进伟
中南大学湘雅二医院风湿免疫科,长沙 410011
类风湿关节炎(rheumatoid arthritis,RA)是一种以慢性侵蚀性关节炎为主要特征的高致残性自身免疫性疾病,目前治疗药物主要包括非甾体抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDs)和缓解病情抗风湿药(disease-modifying antirheumatic drugs,DMARDs),后者又可分为传统合成DMARDs、生物DMARDs和靶向合成DMARDs。临床医生发现,虽然经过正规早期联合多种DMARDs药物治疗,仍有部分RA患者疗效不佳;或者随着治疗时间的延长,药物疗效逐渐减弱,患者对治疗药物无反应或低反应。这些现象的发生被认为与多药耐药的形成有关。多药耐药是细胞在接触一种药物后,不但对该药物耐受,而且对其他多种结构和作用机制不相关的药物耐受的现象[1-2]。这种现象普遍存在于肿瘤性和炎症性疾病中,最近愈来愈多的证据显示多药耐药是RA及系统性红斑狼疮等自身免疫性疾病治疗失败的主要原因。
多药耐药的一个重要机制是跨膜转运蛋白介导的药物排出增加,导致细胞内药物浓度降低。而由多药耐药基因-1(multidrug resistance gene-1,MDR1)所编码的P-糖蛋白(P-glycoprotein,P-gp)是其中最重要的一个转运蛋白,能够阻止药物流入,促进药物排出,使得细胞对药物的反应性降低,产生耐药。本课题组以往研究发现,难治性RA患者成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)中P-gp表达水平显著增高,且P-gp的表达水平与RA患者的氨甲蝶呤(methotrexate,MTX)治疗持续时间呈正相关[3]。本研究将通过生物转基因方法,在体外利用腺病毒将MDR1基因转染到RA患者FLS中,构建高表达MDR1的FLS,在此基础上进一步验证MDR1基因表达水平与RA耐药的关系,以及P-gp外排MTX的功能。
材料和方法
样本来源2011年8月至2012年7月在中南大学湘雅二医院住院并行关节置换术的RA患者5例,其中,男2例,女3例,年龄分别为44、54、58、60、66岁,病程分别为60、72、84、144、180个月,收集5例RA患者的关节滑膜组织。本研究经中南大学湘雅二医院伦理委员会审核批准,所有患者均签署知情同意书。本研究RA的诊断参照1987年美国风湿病学会的RA分类标准[4]。
材料Ad-EGFP-MDR1重组腺病毒粗提液[5]由重庆医科大学附属儿童医院儿科研究所惠赠,Ad-EGFP空病毒载体由上海吉凯基因提供;鼠抗人CD68单抗、鼠抗人Vmientin单抗、兔抗人P-gp抗体购自美国GeneTex公司,小鼠抗人β-actin抗体、辣根过氧化物酶标记抗小鼠二抗、辣根过氧化物酶标记抗兔二抗购自美国Santa Cruz Biotechnology公司;MTX、罗丹明123购自美国Sigma-Aldrich公司,RevertAidTMH Minus First Strand cDNA Synthesis Kit、Deoxyribonuclease Ⅰ(DNase Ⅰ)、RiboLockTMRibonuclease Inhibitor、RevertAidTMH Minus Reverse Transcriptase、PageRuler Prestained Protein Ladder购自加拿大Fermentas公司,SYBR GreenPCR Master Mix和SYBR GreenPCR Master Mix购自美国ABI公司,Adeno-XTMVirus Purification Kit购自美国Clontech公司,Trizol Reagent购自美国Invitrogen公司。
RA FLS的原代培养及鉴定无菌条件下分离RA滑膜组织,并剪碎至1 mm3大小后,用2~3倍体积比的Ⅰ型胶原酶消化液及少量0.25%胰蛋白酶/EDTA溶液避光消化4 h,经200目细胞过滤网过滤后300×g离心5 min,弃上清,加入适量PBS吹打混匀后300×g离心5 min,弃上清,加入15%的完全培养基混匀,置于37℃、5% CO2培养箱中培养,待细胞贴壁生长覆盖至培养瓶底面80%~90%后传代。取细胞培养物将其制成细胞悬液并计数,并接种至12孔培养板孔内,密度为2×104个/ml,继续培养48 h,使之长成单层细胞后,采用HE染色法观察其形态呈梭形或柱状,细胞核呈卵圆形位于细胞中央,核仁明显;免疫组织化学方法观察波形蛋白(Vimentin)染色阳性,CD68染色阴性,即为RA FLS。继续传代直至第3代用于后续实验。
重组腺病毒感染RA FLS将生长至对数生长期的RA FLS分别制成细胞悬液,取相同体积吹打混匀后,将其接种于6孔板中,密度为(3~5)×103个/ml,置于37℃、5% CO2培养箱中培养24 h,使其融合率达到30%~50%。用已纯化的滴度为109PFU/ml的重组腺病毒Ad-EGFP-MDR1以感染复数(multiplicity of infection,MOI)=100感染细胞。同时设置对照组,用阴性病毒同样以MOI=100感染细胞。72 h后收集两组细胞。
Real-time PCR检测MDR1基因的表达待重组腺病毒及阴性病毒感染的两组RA FLS生长至完全融合后,取出6孔板置于冰上,清洗后每孔加入1 ml Trizol裂解,细胞脱壁后加入0.2倍体积的氯仿,震荡15 s后于4℃ 12 000×g离心15 min,将水样层移至Ep管中,并加入0.5倍体积的异丙醇,混匀低温静置15 min,于4℃ 12 000×g离心10 min,弃上层悬液,加入1 ml 75%乙醇洗涤,4℃ 7500×g离心5 min后弃上清,适度干燥RNA沉淀后,加入适量无RNase的水,使RNA完全溶解,于4℃ 900×g离心20 s。检测RNA纯度和浓度,鉴定其质量。将RNA反转录合成cDNA,Real-time PCR法检测MDR1 mRNA表达变化。PCR反应程序:95℃,10 min;95℃,15 s;60℃,1 min;共扩增40个循环。实验中设置阴性平行对照组,共重复3次。采用Delta-delta Ct法来分析目的基因的相对表达量[6]。PCR引物:(1)MDR1:正向:CCGTGGCAA-ACTGGTACTTT;反向:GACGCCAACATAGACCACCT;长度188 bp。(2)β-actin:正向:GTGGACATCCGCAAAGAC;反向:AAAGGGTGTAACGCAACTA;长度106 bp。
Western-blot法检测P-gp的表达待重组腺病毒及阴性病毒感染的两组RA FLS生长至完全融合后,取出6孔板置于冰上,清洗后每孔加入200 μl的裂解液,冰上裂解20 min,将裂解后产物于4℃ 12 000×g离心10 min,将上清液分装至Ep管,20 μl/管,每管加入5 μl 5×loading buffer,于99.9℃ 变性10 min得到总蛋白。用BCA法测定样本蛋白浓度。取20 μl总蛋白进行SDS-PAGE电泳,分离目标蛋白。P-gp 300 mA恒流120 min,β-actin 300 mA恒流90 min,将蛋白转印至PVDF膜。采用5% BSA室温封闭60 min。将一抗用含5% BSA的TBST溶液按照1∶2000稀释,于4℃孵育过夜。之后用TBST在室温下脱色摇床上洗3次,每次10 min。将二抗用TBST按照1∶2000稀释,室温下孵育60 min后,用TBST在室温下脱色摇床上洗3次,每次10 min。采用ECL化学发光成像系统进行显像和图像采集。利用软件进行吸光度分析,根据所得目的蛋白与内参β-actin的吸光度比值进行分析。
罗丹明123实验收集各组细胞1×106,重悬于含10 μg/ml罗丹明的DMEM培养液中,在37℃、5%CO2培养箱中培养15 min后,300×g离心5 min,弃上清,洗涤备用。取部分细胞中加入1 ml含10% FBS的DMEM培养液中继续培养,60 min后荧光显微镜下观察;另一部分细胞重悬于1ml预冷的PBS中,立即上流式细胞仪检测细胞内Rh123荧光强度(λ=488 nm、λ=525 nm),测定10 000个细胞内Rh123荧光强度,分析时设门以除去细胞脆片和细胞团块对测定的干扰[7-8]。
MTT法检测MDR1高表达RA FLS对MTX的耐药性将两组细胞分别接种在96孔板,100 μl/孔(约1×104),置37℃、5% CO2细胞培养箱培养24 h。按照最佳感染浓度加入适量病毒感染48 h后,分别用等量的0.5、1、5、10、50 μmol/L MTX干预细胞,使终体积维持在200 μl/孔,每个浓度设5~8个孔,并设置阴性病毒对照组、阴性对照组(不用药物干预)及空白对照组(只加细胞培养液),在37℃、5% CO2空气及100%湿度的细胞培养箱中孵育24 h。之后每孔加20 μl 1× MTT,在37℃孵育4 h,吸出上清液,每孔加150 μl DMSO,室温下用平板摇床摇10 min。比色,计算各组药物浓度下细胞抑制率,利用SPSS求出每组细胞对各药物的IC50值及耐药指数(resistance index,RI),RI=耐药细胞IC50/对照组细胞IC50。本实验重复3遍,结果取均值。
统计学处理采用SPSS 19.0统计软件,符合正态分布的计量资料以均数±标准差表示,采用单因素方差分析,两样本均数的比较用独立样本t检验,P<0.05为差异有统计学意义。
结 果
Ad-EGFP-MDR1重组腺病毒感染RA FLSAd-EGFP-MDR1重组腺病毒以MOI=100 pfu/cell,72 h感染细胞时效率最高,可见约有90%细胞表达绿色荧光,而此时阴性病毒对照组RA FLS未见荧光表达。MDR1过表达组RA FLS与阴性病毒对照组RA FLS相比,Ad-EGFP-MDR1重组腺病毒感染后细胞胞浆颗粒增多、细胞体积变大、生长速度变慢(图1)。Ad-EGFP-MDR1重组腺病毒感染后的RA FLS即为MDR1过表达RA FLS。
MDR1过表达RA FLS的MDR1的表达情况Real-time PCR检测结果显示,MDR1过表达组RA FLS中MDR1 mRNA表达水平为1.4325±0.3924,明显高于阴性病毒对照组的0.0650±0.0070(t=6.035,P=0.004)。
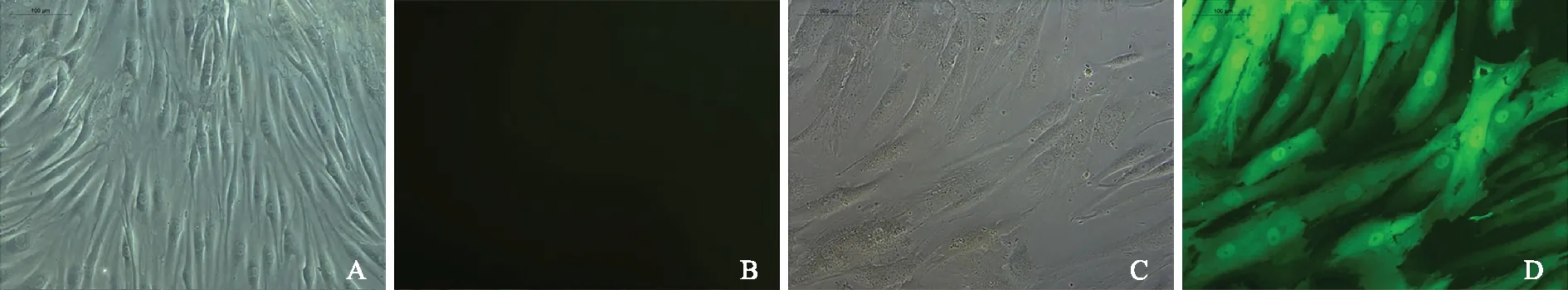
RA:类风湿关节炎;FLS:成纤维样滑膜细胞;MDR1:多药耐药基因-1
RA:rheumatoid arthritis;FLS:fibroblast-like synoviocytes;MDR1:multidrug resistance gene-1
A.光镜下阴性病毒组RA FLS;B.荧光显微镜下阴性病毒组RA FLS;C.光镜下MDR1过表达组RA FLS;D.荧光显微镜MDR1过表达组RA FLS
A.negative virus control group RA FLS under light microscope;B.negative virus control group RA FLS under fluorescence microscope;C.MDR1 over-expressed group RA FLS under light microscope;D.MDR1 over-expressed group RA FLS under fluorescence microscope
图1MDR1过表达RA FLS(×200)
Fig1MDR1 over-expressed RA FLS(×200)
MDR1过表达RA FLS P-gp蛋白的表达情况Western blot检测结果显示,MDR1过表达组RA FLS中P-gp蛋白表达明显高于阴性病毒对照组(1.8667±0.2857比0.9367±0.0551;t=5.536,P=0.005)(图2)。
MDR1过表达RA FLS中P-gp功能的检测荧光显微镜下可见MDR1过表达组RA FLS中罗丹明123染料的表达较阴性病毒对照组减少(图3),MDR1过表达组RA FLS中相对荧光强度明显弱于阴性病毒对照组(979.43±196.81比1680.06±147.04;t=-4.940,P=0.008)。
MDR1过表达RA FLS对MTX的耐药性随着MTX的浓度逐渐升高,MDR1过表达组(F=6.181,P=0.089)和阴性病毒对照组(F=9.868,P=0.052)的RA FLS存活率均逐渐下降,但差异均无统计学意义。
在相同MTX浓度下,MDR1过表达组的RA FLS存活率均明显高于阴性病毒对照组(P均<0.05)(表1)。阴性病毒对照组细胞MTX的IC50为15.72 μmol/L,而MDR1/RA滑膜细胞对MTX的IC50为587.35 μmol/L,MDR1过表达RA FLS对MTX的耐药指数为37.36。
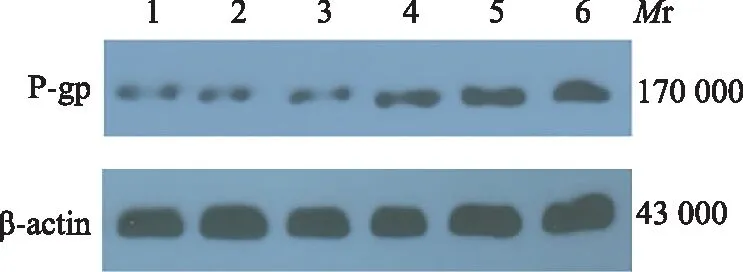
1、2、3:阴性病毒对照组;4、5、6:MDR1过表达组;Mr:相对分子质量
1,2,3:negative virus control group;4,5,6:MDR1 over-expressed group;Mr:relative molecular mass
图2MDR1过表达RA FLS的P-糖蛋白的表达情况
Fig2Expression of P-glycoprotein in MDR1 over-expressed RA FLS
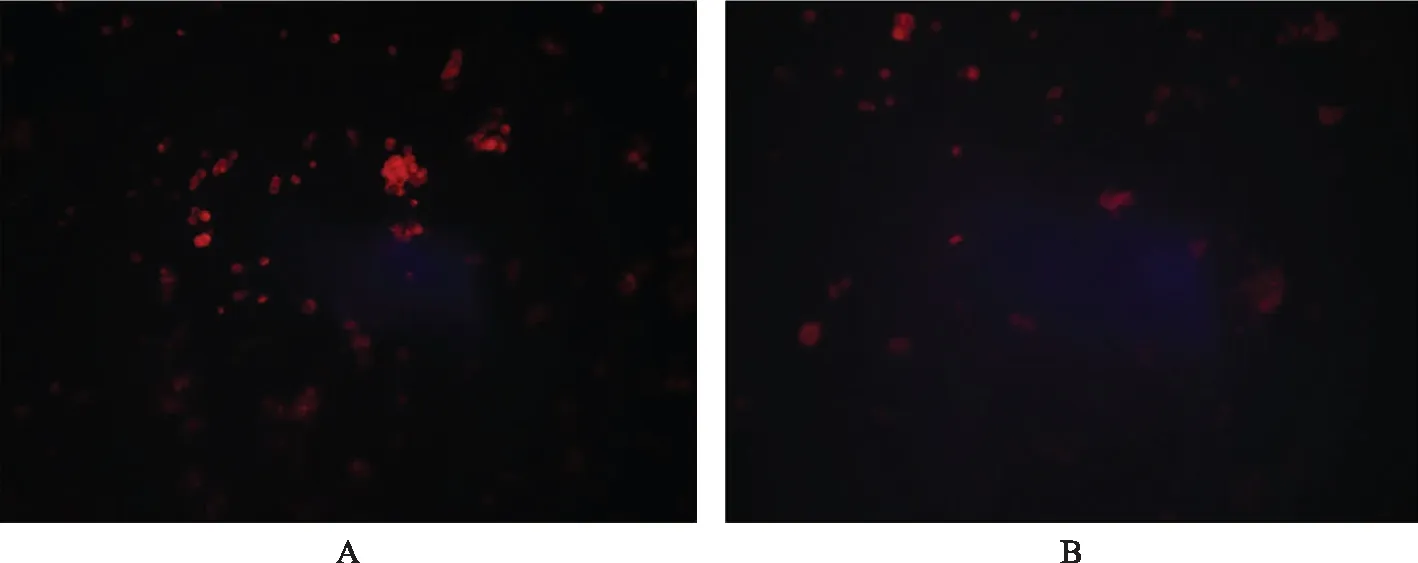
A.阴性病毒对照组;B.MDR1过表达组
A.negative virus control group;B.MDR1 over-expressed group
图3MDR1过表达RA FLS中罗丹明123染料的表达情况(×100)
Fig3Expression of rhodamine 123 in MDR1 over-expressed RA FLS(×100)
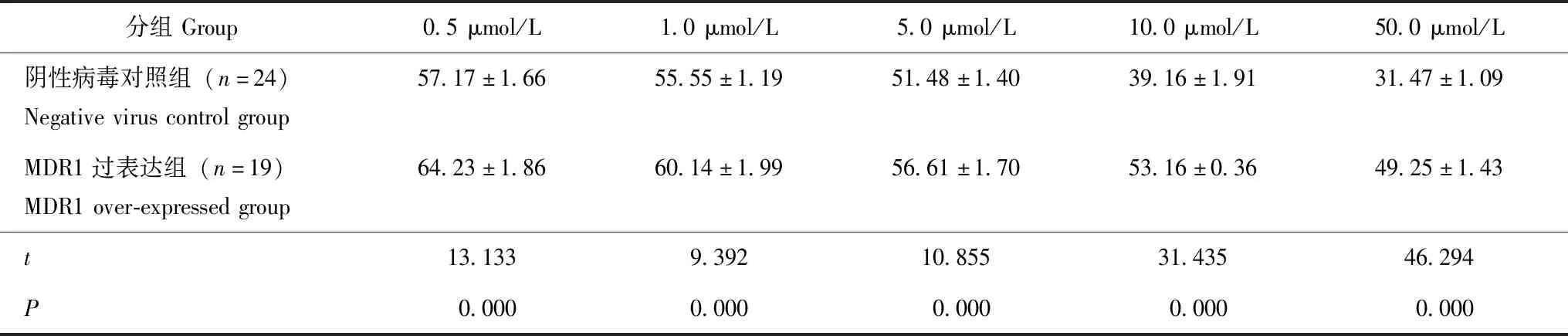
表1 不同浓度MTX下MDR1过表达组和阴性病毒对照组的细胞存活率比较Table 1 Comparison of cell viability of MDR1 over-expressed group and negative virus control group at different concentrations of MTX
MTX:氨甲蝶呤;MDR1:多药耐药基因-1
MTX:methotrexate;MDR1:multidrug resistance gene-1
讨 论
多药耐药是普遍存在于肿瘤性疾病、炎症性疾病以及部分自身免疫性疾病中的现象,其中以肿瘤性疾病的研究最为深入。在肿瘤多药耐药的研究中,不少研究者利用建立肿瘤多药耐药的细胞模型作为研究基础。起初建立肿瘤多药耐药细胞模型的普遍方法主要是体外利用抗肿瘤药物小剂量反复刺激诱导法,这种方法的优点在于模拟了临床上肿瘤化疗中耐药现象产生的病理过程,但是因为药物诱导的时间较长,期间影响因素较多,而且涉及的耐药机制较为繁杂,不利于单个机制的研究。相对来说,目前所采用的耐药基因转染的方法建立细胞模型则具有方法简单、多药耐药机制明确且稳定性好等特点[9]。此外研究表明,在RA的致病过程中,FLS相对于免疫细胞起着更加重要作用。在缺少RA患者血液以及T、B细胞和自然杀伤细胞影响的状态下,RA FLS依然可以形成血管翳样结构,侵蚀破坏正常的关节软骨。而且FLS也有着和肿瘤细胞类似的侵蚀性的生长特性[10]。基于上述原因,本研究在体外利用重组腺病毒Ad-EGFP-MDR1感染RA患者FLS,转染MDR1基因,使其在FLS中高表达,为进一步研究RA中MDR1所介导的多药耐药机制提供研究基础。
目前MDR1/P-gp与RA多药耐药的研究较少且进展缓慢,多数研究都只是基于临床研究发现了两者的相关性。例如,1996年Maillefert等[11]检测了RA患者外周血淋巴细胞中P-gp的表达,结果发现耐药的RA患者外周血淋巴细胞P-gp的表达高于治疗有效组,而激素治疗患者P-gp的水平明显比DMARDs治疗的患者高,并且外周血淋巴细胞中P-gp水平较高的患者如果早期就给予激素治疗会增加DMARDs耐药的风险。另有研究显示,在使用3种甚至更多的二线药物治疗的RA患者FLS中MDR1也呈高表达[12]。随后,本课题组以往研究也发现相对于骨关节炎患者,RA患者FLS中P-gp的表达水平明显增高,且与MTX的治疗时间成正线性相关[3]。本研究基于前期的研究结果,不仅验证了MDR1基因的高表达可以影响P-gp呈高表达,而且从功能的探究入手,通过P-gp的功能验证实验,证实P-gp能够在RA FLS中发挥其外排功能,导致耐药的产生。
P-gp是ATP结合盒(ATP binding cassette,ABC)转运蛋白超家族成员,需要ATP作为能量来源介导药物外排。P-gp可识别和转运结构和药理作用不相关的中性正电荷的疏水性化合物,其作用底物除抗肿瘤药物(如新碱类和蒽环类药物)和抗生素类药物(如红霉素和放线菌素)外,还包括免疫性疾病的常用药物,如糖皮质激素和金制剂[13]。然而,P-gp是否是引起RA经典治疗药物MTX外排,导致其耐药的主要原因,目前仍存在争议。有观点认为细胞内MTX耐药的主要机制是还原叶酸载体介导的MTX摄取障碍而不是P-gp介导的外排,因为P-gp优先转运亲水性有机化合物,而并非如MTX这种二价阴离子化合物[14]。另一方面有研究显示表达P-gp的基因MDR1的某些基因型确实与MTX的疗效相关[15-17],但是,因为以上这几组研究数据均来自于使用小剂量MTX治疗的RA患者,并不能说明是否P-gp对于不同药物浓度的MTX作用程度不同。而本研究通过使用不同浓度的MTX刺激细胞,发现MTX各个浓度下MDR1过表达RA FLS的生存率均高于阴性对照组,而且其对MTX的耐药性提高了37.36倍,这说明MDR1介导的MTX外排也是MTX耐药的重要原因。
综上,本研究在体外构建高表达MDR1基因RA FLS的基础上,发现MDR1基因高表达可通过上调其编码蛋白P-gp的表达水平,增强其外排功能,从而降低RA FLS对RA治疗锚定药物MTX的反应性,引起对MTX的耐药。然而,临床中RA的治疗是一个相对复杂的过程,常常是多种机制的药物联合使用。而本研究中的细胞模型只是瞬时高表达MDR1基因,那么是否可以建立稳定表达MDR1基因的细胞模型,并以此作为基础探讨MDR1介导的多药耐药的分子机制,将有待于今后进一步的研究。

