术前外周血淋巴细胞与单核细胞比值评估T1期非肌层浸润型膀胱癌预后的临床价值
王清海,纪建磊,李 红,贺平丽,宋丽霞,赵 阳,王洪阳,黄 涛,孙晓霞,曹延炜,董 震,石冰冰
1青岛大学附属医院肾脏移植科,山东青岛 266000 2中国医学科学院 北京协和医学院 北京协和医院泌尿外科,北京 100730
膀胱癌是泌尿系统中最为常见的恶性肿瘤,其发病率和致死率均高居泌尿系统肿瘤首位,我国膀胱癌发病率高达7.5例/10万人口,且呈逐年上升趋势[1]。75%首诊为膀胱癌的患者为非肌层浸润型膀胱癌(non-muscle-invasive bladder cancer,NMIBC),T1期约占20%~25%[2-3]。经尿道膀胱肿瘤切除术是治疗T1期NMIBC的主要术式,但术后50%~70%的患者发生复发,10%~15%的患者进展为肌层浸润性膀胱癌,近远期预后较差[4-5]。探索NMIBC患者术后预后的术前预测因子,可指导对NMIBC患者进行预后评估,辅助临床诊疗策略制定,对改善患者预后具有重要意义。炎性反应可促进肿瘤的侵袭和转移,在膀胱癌的发病和进展中发挥重要作用,淋巴细胞、单核细胞作为机体重要的炎症细胞,参与了膀胱癌发病及进展的全过程[6-8]。淋巴细胞/单核细胞比值(lymphocyte-to-monocyte ratio,LMR)作为将淋巴细胞和单核细胞整合后的新型炎症标志物,现已被证实可用于辅助原发性肝癌、结直肠癌、上皮性卵巢癌及胃癌等多种恶性肿瘤的预后评估[9-13],然而目前尚未有LMR与膀胱癌关系的研究报道。本研究探讨了术前外周血LMR水平在评估T1期NMIBC患者术后预后中的价值,以期为今后的临床应用提供参考。
对象和方法
对象2010年10月至2016年10月在青岛大学附属医院泌尿外科行经尿道膀胱肿瘤切除术治疗、病理学检查诊断为T1期、随访资料完整的NMIBC患者215例,其中,男129例(60.00%),女86例(40.00%),平均年龄(68.9±12.0)岁(42~87岁)。排除标准:(1)合并术前严重感染患者;(2)合并心、脑、肾、肝、肺等重要器官严重器质性病变患者;(3)合并自身免疫性疾病患者;(4)合并其他恶性肿瘤患者;(5)合并贫血或造血系统疾病患者;(6)围手术期出现严重并发症患者。本研究经青岛大学附属医院医学伦理委员会批准,所有患者均签署知情同意书。
资料收集由经过统一培训的研究人员收集所有T1期NMIBC患者的临床资料,包括:(1)术前72 h内采集患者空腹外周静脉血5 ml,采用全自动五分类血细胞分析仪进行淋巴细胞和单核细胞计数,LMR为淋巴细胞计数与单核细胞计数绝对值的比值;(2)记录患者乳头状瘤比例、肿瘤大小、肿瘤数量、病理分级及膀胱内灌注治疗等情况。
临床随访通过电话、门诊及住院进行随访。按照美国国家综合癌症网络指南[14]要求,第1~2年每3个月随访1次;第3~5年,每6个月随访1次;以后每12个月随访1次。随访内容包括肿瘤标志物检测、腹部盆腔CT(或B超)及尿常规检查。无病生存(disease-free survival,DFS)和总生存(overall survival,OS)是本研究的共同终点。DFS定义为从T1期NMIBC的诊断开始至初次出现进展或由NMIBC导致的患者死亡。OS定义为从T1期NMIBC的诊断开始至患者死亡。随访截至2018年6月。
统计学处理采用SPSS 20.0统计软件,符合正态分布的计量资料以均数±标准差表示,组间比较采用Student’st检验;计数资料以例数(百分比)表示,组间比较采用χ2检验;作术前LMR与患者OS关系的受试者工作特征(receiver operating characteristic curve,ROC)曲线,确定LMR的最佳分界值;采用Kaplan-Meier生存曲线分析比较不同LMR水平T1期NMIBC患者的累积DFS率和OS率,组间比较采用Log-Rank检验;采用COX比例风险回归模型分析影响患者DFS和OS的因素;双侧P<0.05为差异有统计学意义。
结 果
随访情况215例T1期NMIBC患者临床随访2~92个月,平均DFS时间为(69.3±30.7)个月,DFS率为59.07%(127/215);平均OS时间为(73.1±29.1)个月,OS率为65.12%(140/215)。
LMR最佳分界值确定215例T1期NMIBC患者术前LMR与OS关系的ROC曲线见图1,曲线下面积为0.747(95%CI:0.669~0.824)。根据ROC曲线的最大约登指数确定LMR最佳分界值为3.86,灵敏度为72.9%,特异度为73.7%,此时约登指数最大为0.42。根据LMR最佳分界值将患者分为低LMR组(LMR<3.86,n=77)和高LMR组(LMR≥3.86,n=138)。
低LMR组和高LMR组T1期NMIBC患者临床资料比较低LMR组和高LMR组患者在性别(χ2=0.020,P=0.887)、年龄(t=0.884,P=0.378)、乳头状瘤比例(χ2=0.018,P=0.892)、肿瘤数量(χ2=0.747,P=0.388)、膀胱内灌注治疗(χ2=0.004,P=0.998)方面差异均无统计学意义;而低LMR组的肿瘤大小≥3 cm(χ2=8.350,P=0.004)和病理G3级患者比例(χ2=5.245,P=0.022)明显高于高LMR组(表1)。

ROC:受试者工作特征曲线;LMR:淋巴细胞/单核细胞比值
ROC:receiver operating characteristic curve;LMR:lymphocyte-to-monocyte ratio
图1ROC曲线显示LMR值和预后的关系
Fig1ROC curve of preoperative LMR in detecting patients’ prognosis
不同LMR水平T1期NMIBC患者累积DFS率和OS率比较采用Kaplan-Meier曲线比较不同LMR水平T1期NMIBC患者累积DFS率和OS率,结果显示,低LMR组患者累积DFS率和OS率分别为48.05%和51.95%,明显低于高LMR组的65.22%(χ2=4.784,P=0.029)和72.46%(χ2=7.146,P=0.008)(图2、3)。
影响T1期NMIBC患者DFS和OS的相关因素分析分别以DFS、OS作为应变量,采用单因素及多因素COX回归模型分析影响T1期NMIBC患者预后的相关因素,结果显示,肿瘤大小≥3 cm(HR=1.398,95%CI:1.042~1.875,P=0.025)、病理G3级(HR=1.266,95%CI:1.026~1.563,P=0.028)和LMR≥3.86(HR=2.347,95%CI:1.080~5.101,P=0.031)是影响T1期NMIBC患者DFS的独立因素(表2);肿瘤大小≥3 cm(HR=1.228,95%CI:1.015~1.484,P=0.034)、病理G3级(HR=1.366,95%CI:1.017~1.834,P=0.038)和LMR≥3.86(HR=2.008,95%CI:1.052~3.832,P=0.035)是影响T1期NMIBC患者OS的独立因素(表3)。
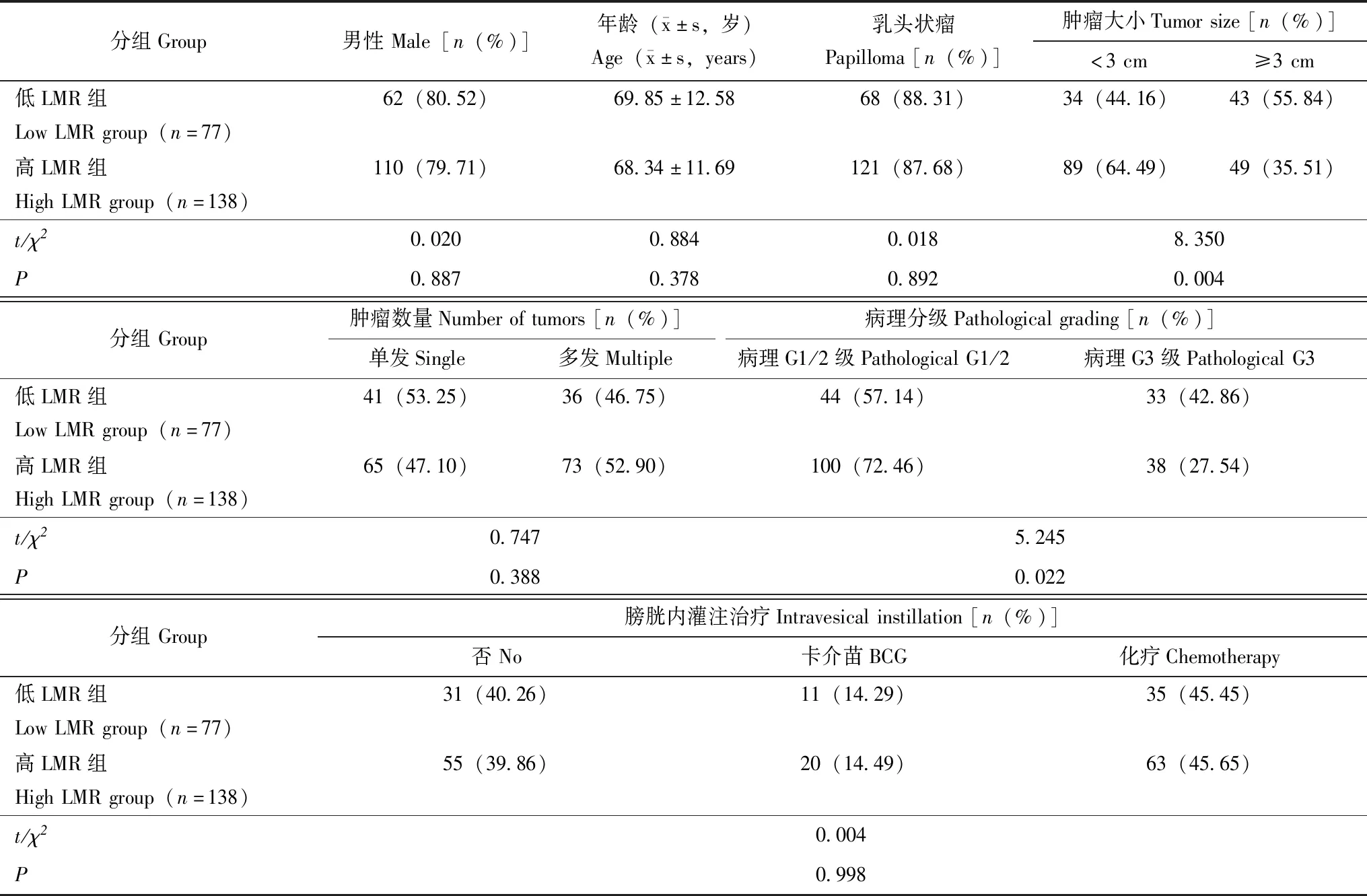
表1 低LMR组和高LMR组T1期NMIBC患者临床资料比较Table 1 Comparisons of clinical characterizations between low LMR group and high LMR group
NMIBC:非肌层浸润型膀胱癌;LMR:淋巴细胞与单核细胞比值;BCG:卡介苗
NMIBC:non-muscle-invasive bladder cancer;LMR:lymphocyte to monocyte ratio;BCG:bacillus Calmette-Guérin
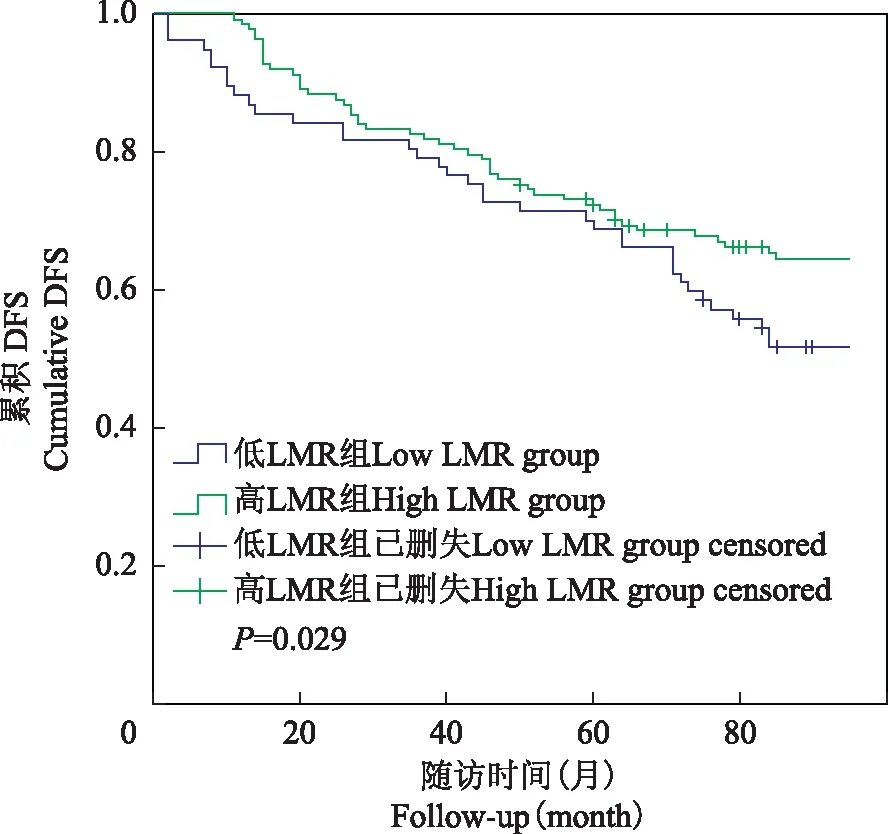
NMIBC:非肌层浸润型膀胱癌;DFS:无病生存
NMIBC:non-muscle-invasive bladder cancer;DFS:disease-free survival
图2不同LMR水平T1期NMIBC患者累积DFS率比较
Fig2Comparisons of cumulative DFS rates in stage T1 NIMBC patients with different LMR levels
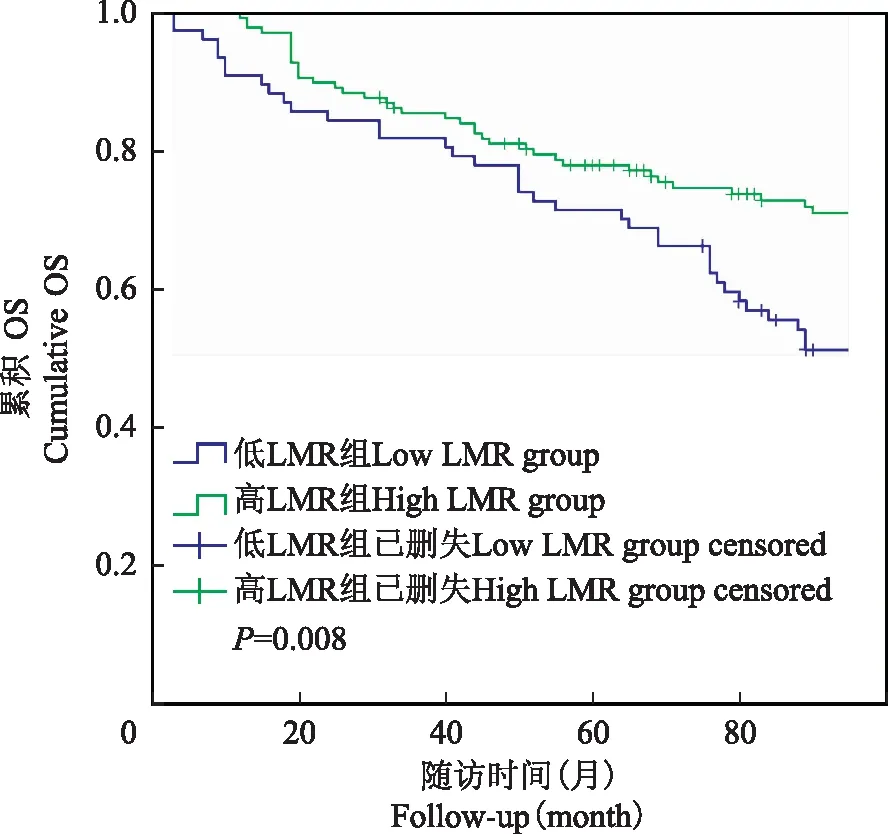
OS:总生存
OS:overall survival
图3不同LMR水平T1期NMIBC患者累积OS率比较
Fig3Comparisons of cumulative OS rates in stage T1 NIMBC patients with different LMR levels
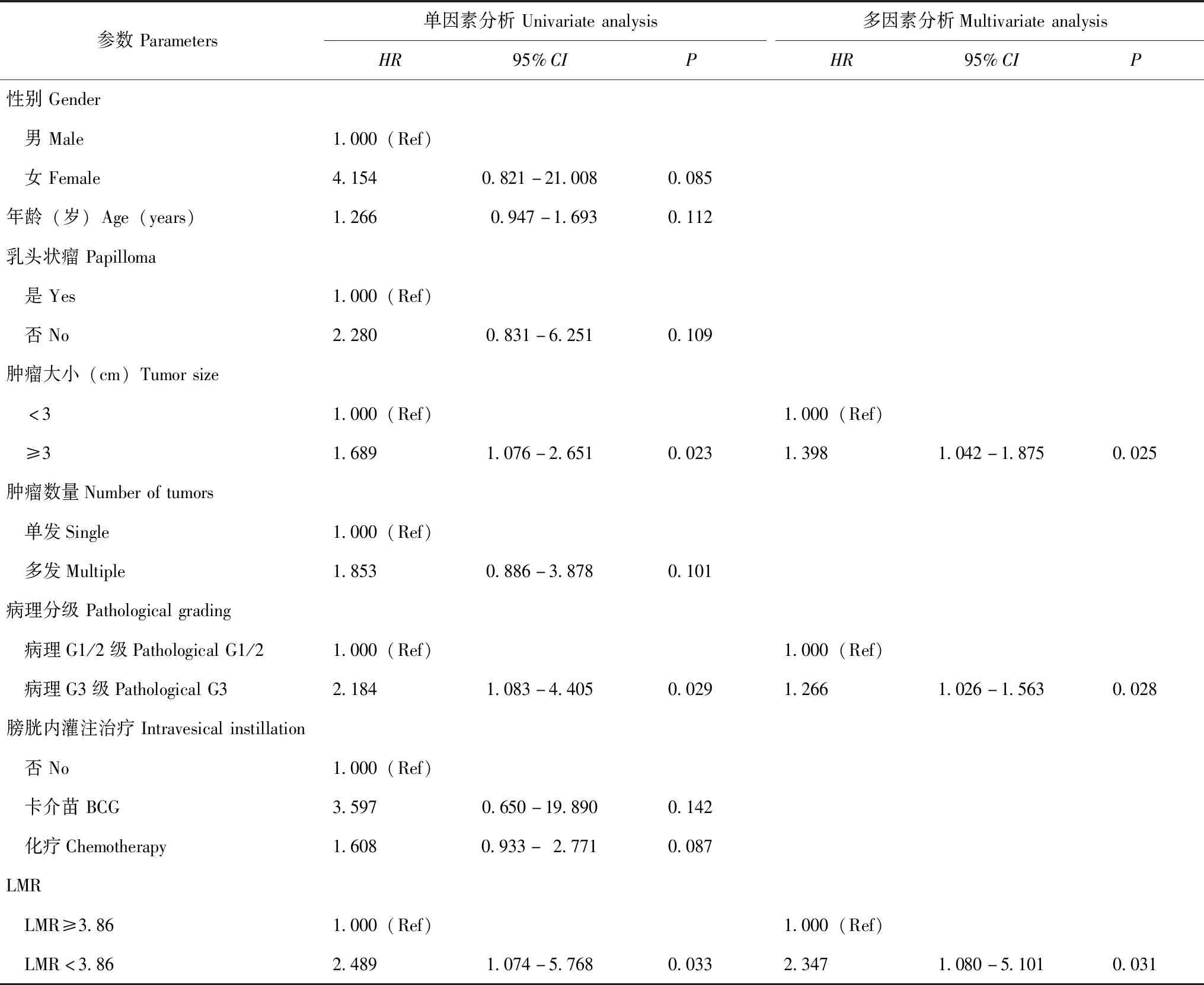
表2 单因素及多因素COX回归模型分析影响T1期NMIBC患者DFS的独立因素Table 2 Univariate and multivariate COX regression models to analyze factors associated with DFS in stage T1 NIMBC patients
DFS:无病生存
DFS:disease-free survival
讨 论
炎症与肿瘤关系密切,在肿瘤触发、发展、转移及侵袭过程中均发挥重要作用,近年研究已证实多种炎症标志物可用于肿瘤的危险分层和预后评估[15]。淋巴细胞是机体对肿瘤进行细胞和体液免疫应答的关键细胞,可通过诱导肿瘤细胞凋亡发挥抗肿瘤作用[16]。外周血低淋巴细胞计数是免疫应答较弱的标志,可表征机体免疫机能降低,对肿瘤细胞清除能力下降,对肿瘤组织生长控制能力减弱,与患者预后不良有关[17]。单核细胞特别是其分化的肿瘤相关巨噬细胞,一方面可分泌肿瘤坏死因子-α、白细胞介素-1、血管内皮生长因子等多种细胞因子,加速肿瘤微环境的形成,促进肿瘤发生发展与侵袭转移[18];另一方面可抑制肿瘤组织中的适应性免疫应答,诱导肿瘤细胞免疫逃逸[19]。研究表明,外周血高单核细胞计数可作为肿瘤负荷较大的微环境指标,与肿瘤不良预后密切相关[20]。LMR是淋巴细胞计数与单核细胞计数绝对值的比值,作为一项简便、快速、经济的指标能同时反映淋巴细胞和单核细胞状态,可在一定程度上体现机体抗肿瘤免疫与炎症反应间的动态关联,兼具淋巴细胞和单核细胞对肿瘤预后的预测优势,辅助多种肿瘤的预后评估[9-13],然而其与T1期NMIBC患者术后预后的关系尚未明确。
本研究对215例T1期NMIBC患者的术后预后进行了临床随访,通过作术前LMR与患者预后关系的ROC曲线,兼顾灵敏度和特异度确定LMR的最佳分界值为3.86。既往有关LMR与肿瘤患者预后关系的研究发现,在不同肿瘤中LMR的最佳分界值在2~6之间[21-22],有力的支持了本研究结果。本研究采用Kaplan-Meier曲线分析比较了不同LMR水平患者的累积DFS率和OS率,发现低LMR患者的累积DFS率与累积OS率均显著低于高LMR患者,提示低LMR水平的T1期NMIBC患者预后差于高LMR水平患者。
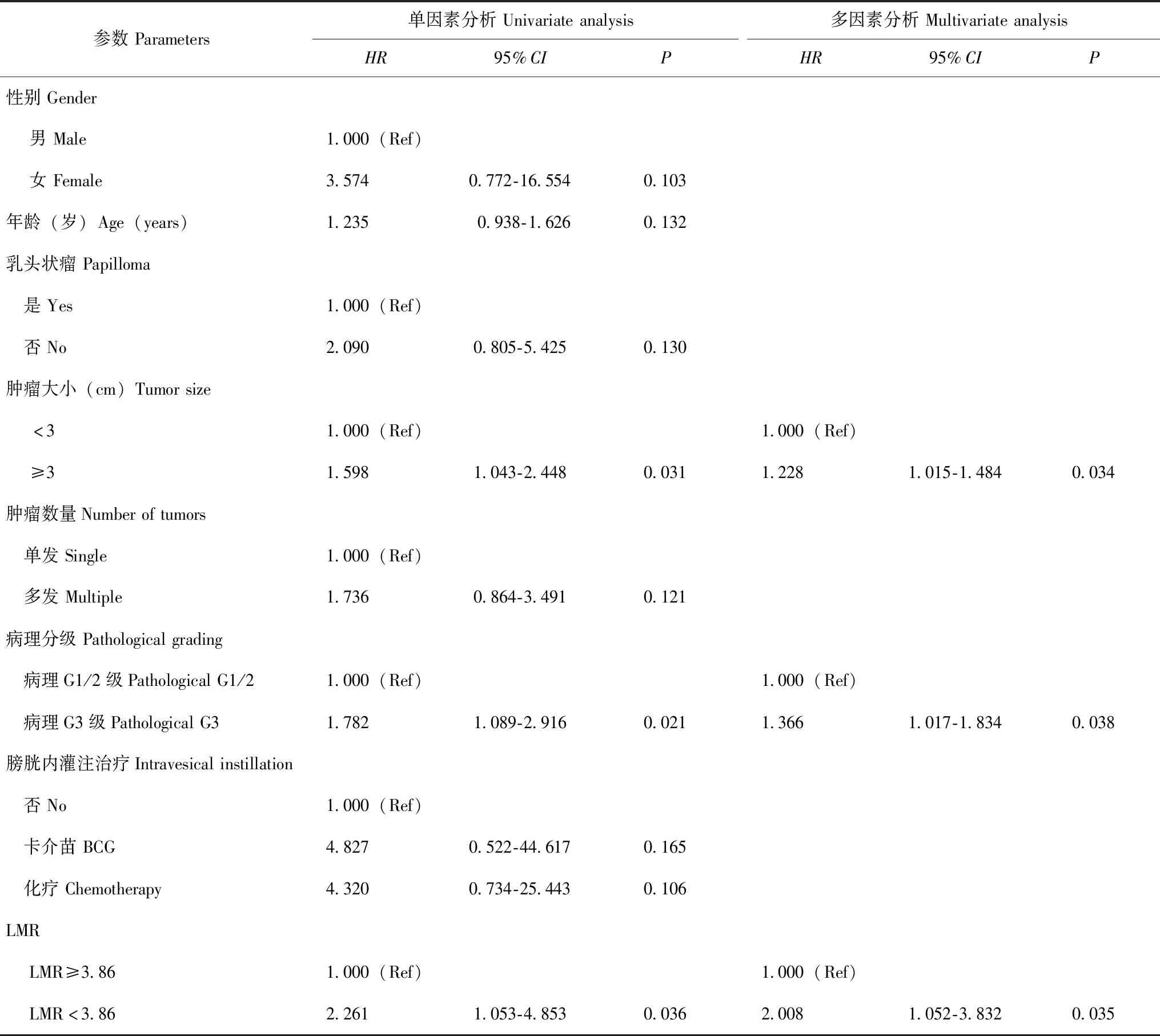
表3 单因素及多因素COX回归模型分析影响T1期NMIBC患者OS的独立因素Table 3 Factors associated with OS in stage T1 NIMBC patients(univariate and multivariate COX regression models)
如何实现对T1期NMIBC患者不良预后进行早期预警,有效提高此类患者的整体生存率,一直是泌尿外科领域和肿瘤领域的研究热点。本研究结合随访结果将T1期NMIBC患者的临床资料纳入COX比例风险回归模型进行分析,发现肿瘤大小≥3 cm、病理G3级、LMR≥3.86为影响T1期NMIBC患者DFS与OS的独立因素。肿瘤大小≥3 cm、病理G3级已经大量研究证实是T1期NMIBC患者预后不良的独立预测因素[23-24],与本研究结果相符;但外周血LMR水平是否亦与T1期NMIBC患者预后不良具有独立相关性,既往研究未予明确。本研究结果则进一步表明,LMR<3.86的患者与LMR≥3.86的患者相比NMIBC进展风险与死亡风险更高,提示术前监测T1期NMIBC患者LMR水平,可辅助评估患者术后预后情况,有助于指导临床制定个体化诊疗策略,具有较高的临床应用价值。但本研究为单中心研究,纳入的T1期NMIBC患者样本量相对较少,且尚未结合纤维细胞生长因子受体3、表皮生长因子受体、抑癌基因p53等与NMIBC预后相关的分子标志物进行分析,下一步将增大T1期NMIBC患者样本量,联合多中心,结合与NMIBC预后相关的分子标志物进一步验证研究结论。
综上,本研究结果显示,术前外周血LMR作为一项临床上简单易得、经济可靠的血常规指标,是影响T1期NMIBC患者预后的独立因素,低水平LMR患者术后的NMIBC进展风险与死亡风险更高。

