HBV相关性肾炎肾组织AIM2水平及其与炎性因子和肾脏炎症程度的相关性分析
张席军 李红莉 赵筱娟
乙型肝炎病毒(hepatitis B virus,HBV)感染引起的肝硬化、肝衰竭或肝癌等疾患对人类健康造成极大危害[1]。HBV感染可引起HBV相关性肾炎(HBV-associated glomerulonephritis,HBV-GN)等多种肝外相关疾病的发生[2]。黑色素瘤缺乏因子2(absent in melanoma 2,AIM2)是HIN-200蛋白家族的重要成员之一,其主要分布于细胞浆中,并且可为胞浆内的双链DNA所识别而激活,使得半胱氨酸天冬氨酸蛋白酶-1(cysteinyl aspartate specific proteinase-1,caspase-1)途径激活,进而可促使多种炎性因子的成熟及释放,如白细胞介素-1β(interleukin-1β,IL-1β)等,可进一步引发炎症反应,因此其在机体固有免疫反应而引起的炎症中发挥重要作用[3-4]。本研究通过分析HBV-GN患者肾组织中AIM2水平及其与炎性因子和肾脏炎症程度的相关性,旨在探讨AIM2的激活在HBV-GN中的可能致病机制,进而为加深该病发病机制的认识及治疗提供临床意义。
资料与方法
一、一般资料
收集本院2016年1月至2018年8月62例HBV-GN患者(HBV-GN组)和46例慢性肾小球肾炎(chronic glomerulonephritis,CGN)患者(CGN组)的临床资料。其中,HBV-GN组男39例,女23例;年龄22~68岁,平均(37.06±8.86)岁。CGN组男28例,女18例;年龄24~70岁,平均为(38.98±9.84)岁。两组患者性别和年龄等一般资料比较,差异均无统计学意义(均P>0.05)。
二、肾组织标本的获取及免疫组织化学检测
在10%中性甲醛固定液中取出活检标本,采用石蜡进行包埋,制备组织块。用乙醇进行梯度脱水,二甲苯透明30 min,浸蜡60 min。蜡块包埋后连续切片,每张切片厚度均为3 μm,将其切片放置在45 ℃温水中摊片,采用防脱载玻片进行处理,每张载玻片均捞取3块组织,控干水分,于70 ℃烤片1~2 h后置于切片盒中,于4 ℃环境下保存备用。脱蜡,用乙醇进行梯度水化;采用磷酸盐缓冲液冲洗3次,每次5 min;抗原热修复后,将切片放置在3%过氧化氢溶液中并在室温下孵育10 min,再用磷酸盐缓冲液冲洗3次,每次5 min;将切片的磷酸盐缓冲液擦干,各切片上滴加山羊血清50 μL,于室温下封闭5 min,将多余液体甩去。各切片上滴加一抗50 μL,于37 ℃环境下孵育60 min;用磷酸盐缓冲液冲洗3次,每次5 min,之后将切片的磷酸盐缓冲液擦干。在各切片上滴加二步法免疫组织化学检测试剂50 μL,于37 ℃环境下孵育20 min;用磷酸盐缓冲液冲洗3次,每次5 min。各切片滴加新鲜配制的DAB溶液,于显微镜下观察,用苏木精复染切片,采用乙醇进行梯度脱水后,中性树胶封片,最后进行镜检。
三、免疫组织化学检测结果判读[5]
阳性表达定义为于显微镜下可见棕黄色颗粒,可根据棕黄色颗粒显色强度及密度进行表达程度的划分。随机选取肾组织中10个高倍镜的观察视野,对其阳性细胞数进行计数,取其平均值。按照阳性细胞在总细胞数中的比例进行评分,分为0分:阳性细胞数的比例≤5%,记为阴性(-);1分:阳性细胞数的比例为6%~25%,记为弱阳性(+);2分:阳性细胞数的比例为26%~49%,记为阳性(++);3分:阳性细胞数的比例≥50%,记为强阳性(+++)。根据阳性细胞的着色程度进行评分,分为0分:无着色,记为阴性(-);1分:淡棕黄色,记为弱阳性(+);2分:棕黄色,记为阳性(+);3分:深棕黄色,记为强阳性(+++)。将上述阳性细胞数的评分与着色程度的评分相加,0~1分记为阴性表达(-),2分记为弱阳性(+),3~4分记为阳性(++),5~6分记为强阳性(+++)。其中,阳性表达率=(弱阳性例数+阳性例数+强阳性例数)/例数×100%。
四、统计学分析
结 果
一、免疫组织化学检测结果
在HBV-GN患者的肾组织中,AIM2主要分布于肾小球细胞浆中的内皮细胞和系膜细胞,且部分可见于肾小管及间质内。见图1。二、两组患者肾组织中AIM2表达水平的比较
HBV-GN组AIM2的阳性表达率为79.03%,较CGN组的32.61%明显升高(P<0.05),见表1。
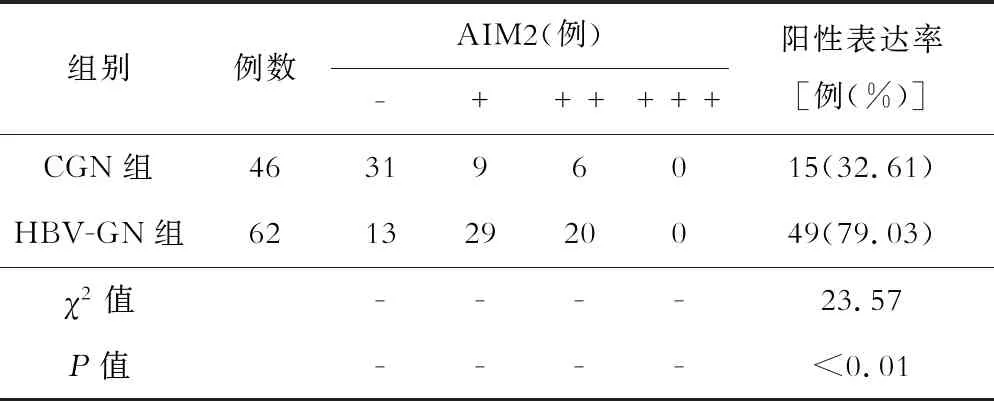
表1 两组患者肾组织中AIM2表达水平的比较
三、HBV-GN患者肾组织中AIM2的表达与IL-1β、caspase-1均表达的相关性
采用Spearman相关性分析可发现,HBV-GN患者肾组织中AIM2的水平与IL-1β、caspase-1均存在正相关关系(r=0.58、0.68,均P<0.01)。见表2。

表2 HBV-GN患者肾组织中AIM2的表达与IL-1β、caspase-1均表达的相关性(例)
讨 论
HBV感染程度的不同可导致肝脏出现不同程度的病变,且可导致多种不同程度的肝外表现,而HBV-GN是其中的一种常见病,也是继发性肾小球肾炎的常见病因。既往研究报道,在我国各种GN患者中,HBV-GN发病率为16.6%~32%[6]。目前,有关HBV-GN的具体发病机制仍未完全定论,但普遍观点认为该病与免疫反应密切相关[7]。因HBV感染后,抗原成分与抗体产生免疫复合物,并沉积于肾小球血管壁,可进一步引发机体Ⅲ型变态免疫反应,使肾小球基底膜受损,红细胞和蛋白漏出,导致肾脏损伤,最终诱发HBV-GN的发生[8]。IL-1β是重要的炎性因子之一,其在CGN的发生及发展的病理过程中起到重要作用[9]。作为模式识别受体之一,AIM2具有特异性识别抗原信号的作用,可通过感受细菌或病毒感染时释放至细胞浆的双链DNA,并通过结合接头蛋白ASC,生成炎性复合体——AIM2炎性小体,可进一步促使caspase-1活化,使之裂解IL-18、IL-1β等多种炎症因子[10]。HBV-GN患者中肾组织的固有细胞内存在乙型肝炎病毒样颗粒和HBV DNA复制,而作为胞浆内DNA识别受体之一,AIM2可能在肝细胞中通过识别HBV DNA,促使caspase-1途径激活,并进一步促进IL-1β等炎性因子释放,最终导致肝炎的发生[11]。另有研究认为,DNA识别受体具有识别pg RNA或HBV DNA的作用并可诱导固有免疫反应,这可能是HBV引起肝脏炎症的一种重要机制,而AIM2与HBV引起肝炎发生和发展机制过程中的重要DNA识别受体[12]。
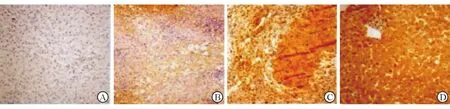
图1 AIM2在HBV-GN患者肾组织中的表达(HE染色,×400)A:阴性(-),B:弱阳性(+),C:阳性(++),D:强阳性(+++)
本研究发现,HBV-GN组AIM2的阳性表达率为79.03%,较CGN组的32.61%明显升高。提示胞浆内HBV DNA的发生可能促使AIM2的表达激活,继而促使下游炎性复合体激活,引发固有免疫反应,因此在HBV-GN的炎性过程中发挥重要作用。并且,本研究经Spearman相关性分析发现,HBV-GN患者肾组织中AIM2水平与IL-1β、caspase-1均存在正相关关系(r=0.58、0.68,P<0.01)。提示AIM2的表达水平可能与HBV-GN患者炎症进展程度存在一定关系。由此推断,AIM2可能通过识别且结合HBV DNA后被激活,使caspase-1活化而产生炎性复合体,促进IL-1β等致前炎性因子成熟、释放及排泄,从而导致HBV-GN患者肾损伤加重,提示AIM2在HBV-GN肾小球细胞炎性损伤的过程中可能起到重要作用。另外,本研究62例HBV-GN患者中,13例患者出现AIM2表达阴性的原因可能与以下几点密切相关:①肾脏细胞质内并无完整的HBV DNA;②肾脏细胞质内其他双链DNA可感应蛋白质,可通过感知HBV DNA而导致炎性损伤;DNA依赖的干扰素调节因子激活物可直接结合胞质内双链DNA,促使干扰素调节因子3转录因子的激活,增强TANK2结合激酶1的活性,可进一步引发固有免疫反应而造成炎症的发生;③通过结合干扰素诱导蛋白16等其他HIN-200家族蛋白,诱导免疫损伤。
综上所述,HBV-GN患者肾组织AIM2表达水平明显升高,且与IL-1β、caspase-1等多种炎性因子水平和肾脏炎症程度存在密切关系。

