慢性丙型肝炎患者microRNA122水平与肝组织炎症坏死程度的关系
程文婷 孔德华
慢性丙型肝炎(CHC)是我国患病率较高的一种肝脏疾病,主要因HCV感染所致。研究表明在急性感染者中,约55%~85%的患者进展成慢性,而慢性丙型肝炎危害性非常大,若未能及时治疗,则可进展为肝细胞性肝癌、肝硬化,对患者生命构成威胁[1]。研究发现多种炎症细胞因子参与了CHC进展过程,如白介素-2(IL-2)、白介素-4(IL-4)、白介素-5(IL-5)、白介素-6(IL-6)等,炎症因子释放增加会导致机体出现炎症反应,引起肝脏损害[2]。近年来,研究指出microRNAs参与了肝病病理过程,它对细胞凋亡、增殖有调节作用,而MicroRNA-122是肝脏特异性RNA,对维持肝脏功能运行有重要意义[3]。本次研究为了进一步了解CHC的病理特征,纳入100例患者为研究对象,分析CHC患者microRNA122水平与肝组织炎症坏死程度的关系,现报告如下。
资料与方法
一、纳入与排除标准
纳入标准:(1)符合慢性丙型肝炎抗病毒治疗专家委员会提出的《慢性丙型肝炎抗病毒治疗专家共识》中的诊断标准[4],临床诊断明确;(2)年龄≥18岁;(3)入院前3个月内无抗病毒、免疫抑制治疗史;(4)临床病例资料完整;(5)精神状态、认知正常;(6)知情同意。排除标准:(1)肾、肺、心、脑等重要器官损害;(2)癌症病史;(3)肝脏衰竭;(4)合并肝脂肪变、肝血管瘤等其他肝病;(5)慢性乙型肝炎、甲型肝炎。
二、一般资料
纳入我院2014年3月~2017年3月收治的CHC患者100例作为病例组,选取同期于我院体检的100例体检者作为对照组。病例组男56例,女44例,年龄23~75岁,平均(49.42±10.83)岁;体质指数18~26 kg/m2,平均(22.53±2.06)kg/m2;HCV基因型:1型84例,2/3型12例,6型4例;感染途径:输血感染26例,性传播感染49例,吸毒感染18例,不明原因7例。对照组男53例,女47例,年龄20~78岁,平均(51.69±12.32)岁;体质指数18~26 kg/m2,平均(22.34±2.11)kg/m2。两组性别、年龄、体质指数比较差异无统计学意义(P>0.05)。
三、检测方法
两组受检者均于入院当日留取5 mL血清样本,经实时荧光定量PCR法测定microRNA122在血清中的表达水平:(1)组织制片染色:石蜡包埋制片→切片→脱蜡→HE染色→Masson染色。①HE染色过程:切片、脱蜡、蒸馏水,苏木素染色(约5~10 min),利用水冲洗2次,伊红染色3 min,利用水冲洗2次,经数脂封片、固定。②Masson染色:切片、脱蜡、蒸馏水,苏木素染色(约5~10 min),流水蓝化,水洗,酸性品红液中染(6~8 min),水洗,经浓度为1%的磷钼酸中染(2~3 min),加苯胺蓝液,反应5 min,冲洗,烘干,树脂封片、固定。(2)提取血清microRNA:①取200 μL样本,加变性溶液混匀;②取氯仿300 μL混匀;③离心5 min,分离血清;④加无水乙醇混匀;⑤弃废液;⑥加Wash Solution,离心15 s;⑦弃废液;⑧重复上述步骤,空甩离心柱;⑨加DEPC水,离心30 s;⑩定量检测RNA。(3)PCR反应条件:95 ℃ 10 min,55 ℃ 2 min,72 ℃ 2 min,(95 ℃ 15 s、60 ℃ 4 min,12个循环),99.9 ℃,10 min。
四、观察指标
比较病例组、对照组患者microRNA122在血清中的表达水平,并按照肝组织炎症活动度分级标准(G)对病例组患者进行炎症程度分级,以≤G2级为轻度炎症组,>G2级为中重度炎症组,比较两组血清microRNA122表达水平。炎症程度分级标准[5]:采用G0~G4等级进行评估,无炎症活动为G0级,肝门区可见轻度炎症为G1级,轻微碎屑样坏死为G2级,中度碎屑样坏死为G3级,重度碎屑样坏死为G4级,分别赋0、1、2、3、4分,分值越高表明炎症坏死程度越重。
五、统计学方法

结 果
一、病例组、对照组的血清microRNA122表达水平比较
病例组血清microRNA122表达水平为(4.728~5.525)lg 拷贝数/μL,平均(5.153±0.213)lg 拷贝数/μL。对照组为(3.723~4.316)lg 拷贝数/μL,平均(4.009±0.242)lg 拷贝数/μL。病例组血清microRNA122表达水平高于对照组,差异有统计学意义(t=35.485,P=0.000)。
二、轻度炎症组、中重度炎症组的血清microRNA122表达水平比较
通过对患者的肝组织炎症坏死程度进行分级,提示轻度炎症组48例(48.00%),中重度炎症组52例(52.00%)。轻度炎症组血清microRNA122表达水平为(4.728~5.164)lg 拷贝数/μL,平均(4.893±0.021)lg 拷贝数/μL。中重度炎症组为(5.156~5.525)lg 拷贝数/μL,平均(5.242±0.032)lg 拷贝数/μL。轻度炎症组的血清microRNA122表达水平低于中重度炎症组,差异有统计学意义(t=91.181,P=0.000)。
三、血清microRNA122对CHC中重度炎症坏死的预测价值分析
血清microRNA122表达水平预测CHC中重度炎症坏死的曲线下面积为0.662(标准误=0.054,P=0.005,95%CI=0.556~0.768),最佳截断值为4.920 lg 拷贝数/μL,敏感度为0.596,特异度为0.646,ROC曲线图见图1。
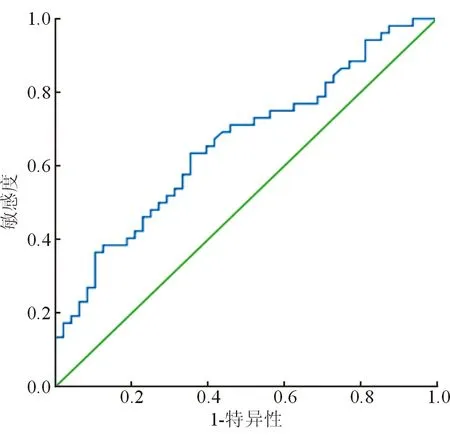
图1 血清microRNA122预测CHC中重度炎症坏死的ROC曲线图
四、CHC患者血清microRNA122表达与肝组织炎症坏死评分的相关性
CHC患者肝组织炎症坏死评分为(2.74±1.25)分,血清microRNA122表达水平为(5.153±0.213)lg 拷贝数/μL。经Pearson相关性分析提示,血清microRNA122表达水平与肝组织炎症坏死评分呈正相关(r=0.571,P=0.000),二者线性相关图见图2。
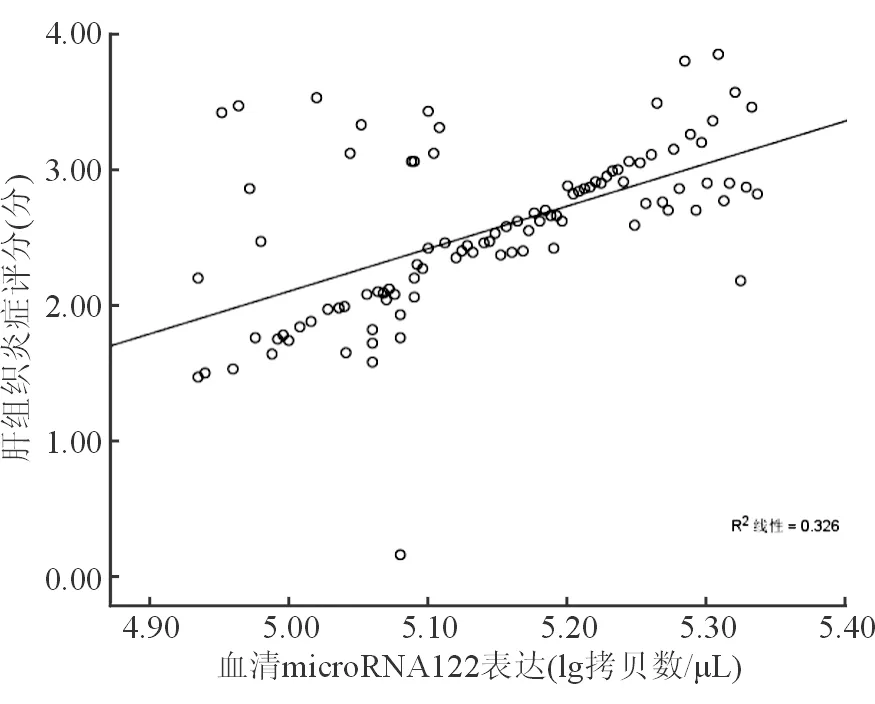
图2 CHC患者血清microRNA122表达与肝组织炎症坏死评分线性相关图
讨 论
我国HCV感染率非常高,约50%的患者经治疗后,预后良好,但仍有部分病例效果欠佳,其抗病毒治疗疗效可能与免疫病、肝纤维化、胰岛素抵抗、肥胖等因素相关[6]。近年来,有研究指出microRNA122对肝脏特异性微小RNA存在调节作用,miR-122内含核苷酸总数为85个,当其被灭活后,HCV复制能力下降,提示miR-122对HCV复制有促进作用[7]。另有研究证实microRNA-122与HCV复制呈正相关[8]。然而,既往研究中主要集中于分析microRNA-122与HCV复制的关系,缺乏对microRNA-122与肝组织炎症关系的探讨。肝脏炎症坏死程度是反映患者病情的重要指标,及时了解患者机体炎症情况,有利于进一步评估其疾病严重度,为疾病治疗提供依据。
本次研究着重于分析microRNA-122与CHC患者肝组织炎症坏死程度的关系,结果显示与体检者相比,CHC患者的血清microRNA122表达水平显著增高,提示这类患者病情进展可能与microRNA122在血清内的表达水平相关。研究表明与血清ALT相比,microRNA122对急性肝损伤的评估价值更高,能有效评价肝脏损害程度,即便患者血清ALT在正常范围,其microRNA122在血清中的表达明显增高,进一步证实血清microRNA122表达量对肝脏损害具有较高诊断价值[9],为本研究开展提供了理论依据。
CHC进展过程与机体炎症存在密不可分的关系,当发生HCV感染后,可导致机体免疫失衡,即Th1/Th2失衡,不利于清除HCV,且会抑制免疫应答反应,从而致使患者机体处于持续感染状态,进一步损害肝细胞功能。本研究根据CHC患者肝组织炎症坏死程度将其分为轻度炎症组、中重度炎症组,结果提示中重度炎症组的血清microRNA122表达水平高于轻度炎症组,提示血清microRNA122表达量增高可能与炎症程度相关。研究表明当出现药物性肝损伤、病毒性肝炎等肝损害时,microRNA122在外周血中的表达水平增高,且随着炎症程度加深,其表达量越高[10],与本研究结论基本符合。本研究通过绘制ROC曲线,证实血清microRNA122表达水平对CHC患者肝组织炎症坏死程度具有一定预测价值,且血清microRNA122表达与肝组织炎症坏死评分呈正相关,这可能的原因在于microRNA122参与了脂肪酸氧化反应过程,从而促进炎症进展。
综上,本研究证实与体检者相比,CHC患者的血清microRNA122表达水平增高,且血清microRNA122表达量与肝组织炎症坏死程度呈正相关,研究的创新之处在于明确了轻度炎症、中重度炎症的最佳截断值,能为临床治疗提供依据。此外,本次研究因受病例研究经费、研究时间等因素限制,导致纳入样本量少,未来还需扩大样本量,对此进行多中心、大样本量的探讨。

