雷帕霉素抑制肝纤维化病理进程的疗效及其机制
肖潇
我国为慢性乙型及丙型肝炎高发病率国家,易发生肝纤维化[1]。近年来,有报道称成熟肝细胞上皮间质化与肝纤维化有关;而雷帕霉素体外可抑制肝星状细胞增殖,体内可抑制四氯化碳致大鼠肝纤维化[2]。本研究探讨雷帕霉素对肝纤维化病理进程的抑制作用及其机制。
资料与方法
一、实验动物
健康雄性清洁级SD大鼠80只,鼠龄3~4个月,体质量230~270 g,由西安交大医学院实验动物中心提供,许可证号SCXK(陕)2012-003。
二、 主要仪器与试剂
主要仪器包括Kendro低温高速离心机(德国Sorvall公司)、DYNEX MRXⅡ型酶标仪(日本Dynex公司)、Olympus光学显微镜(日本Olympus公司)、RM6240B多通道生理信号采集处理系统(成都仪器厂)、YP100型压力换能器(成都仪器厂)、SHHWZICY420型电热恒温水浴箱(北京长安科学仪器厂)、DHG-9023A型电热恒温鼓风干燥机(上海精宏公司)、DYY-8型稳压稳流电泳仪(上海琪特)、Kadok DCs-120凝胶图像分析系统(美国Life Technologies公司)等。主要试剂包括雷帕霉素(华北制药股份有限公司,国药准字H20100079),E-cadherin、Connexin43、Vimentin、α-SMA等抗体均购自美国Santa Cruz公司,四氯化碳油溶液、组织细胞裂解液、ECL发光增强剂、兔二抗工作液、DAB显色剂等均购自美国PIERCE公司。
三、 实验方法
(一)纤维化动物模型制作及用药 取健康雄性清洁级SD大鼠32只,依据3 mL/kg体质量皮下注射四氯化碳油溶液40 ml/L,2次/周,持续8周,制备四氯化碳诱导大鼠肝纤维化模型。其中,雷帕霉素干预组于第6周同时按2 mg/kg体质量行雷帕霉素灌胃处理,1次/d,维持2周。另取16只大鼠纳为正常组。所有大鼠均于第8周处死。
(二)标本获取及保存 (1)肝脏组织标本:既定时间点处死大鼠,开腹后于腹主动脉取血,完整切离肝脏,分别于各肝叶处取一块肝脏(厚约4 mm),甲醛固定、常规脱水、石蜡包埋处理后将剩余肝脏组织切块,置入冻存管中,于液氮条件下保存;(2)肝细胞提取:以原位加体外循环胶原酶灌注percoll密度梯度离心法,行大鼠肝细胞分离。大鼠腹腔打开后经门静脉插管,注入肝素钠抗凝,50 mL注射剂缓慢灌注无钙D-HANKS液。冲洗肝脏,干净后0.05%胶原酶液行肝脏原位灌注,速度10 mL/min,2 min后行肝上下腔静脉结扎,将肝脏取出,行胶原酶液灌注至肝组织变软、苍白。肝脏抖动并钝性分离细胞,200铂不锈钢筛网过滤后洗涤,离心处理后获取肝细胞,置入冻存管,于液氮罐冻存备用。
(三)肝脏组织HE染色 (1)肝脏组织切片:切片前将包埋好的标本置入-20 ℃冰箱冷冻30 min。切片厚度3~5 μm,于普通载玻片上粘附后于60 ℃条件下烘烤,60 min后取出装盒;(2)HE染色:石蜡切片脱蜡至水,经PBS冲洗、苏木青染色、盐酸酒精分化、PBS漂洗等处理后晾干后中性树胶封片,镜检。
(四)肝脏组织中α-SMA表达检测 (1)载玻片及盖玻片处理、切片:载玻片洗净后置入多聚赖氨酸溶液(经1∶10去离子水稀释)中,浸泡5 min后烘烤装盒。切片于载玻片上粘附后烘烤装盒;(2)免疫组化:石蜡切片脱蜡至水,经PBS冲洗、浸泡、滴加二抗工作液、苏木素复染等处理后中性树胶封片,镜检。采用免疫组化检测肝组织中α-SMA表达。
(五)蛋白表达检测 将培养瓶中的细胞用细胞刷刮下后,经匀浆、S-PAGE胶制备、上样、电泳、转膜、封闭、结合一抗、洗涤、曝光显影、定影HRP-ECL发光处理后,运用Epson彩色图像扫描仪获取蛋白质信号条带图像。采用Western blot测定蛋白表达。
四、观察指标
分析三组肝脏组织α-SMA染色、HE染色结果,对比三组E-cadeherin、connexin43、Vimentin、α-SMA表达,并观察三组上皮间质转化通路重要蛋白p-smad2、p-smad3、smad2/3、smad4表达,探讨雷帕霉素抑制肝纤维化进程中肝细胞上皮间质转化机制。
五、统计学方法

结 果
一、大鼠肝纤维化模型建立及雷帕霉素干预效果分析
成功建立四氯化碳诱导大鼠肝纤维化模型,模型对照组和雷帕霉素干预组在8周时各有1只死亡,均经α-SMA组化、HE染色证实。经HE染色发现雷帕霉素干预组肝纤维化显著减轻,经免疫组化行经α-SMA再次验证。见图1~2。
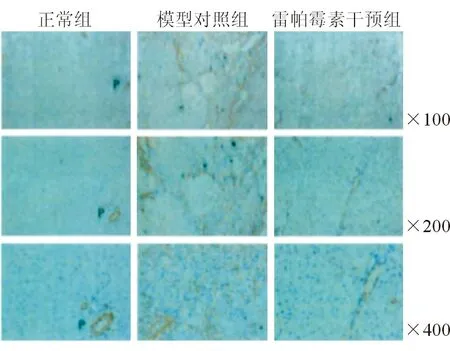
正常组肝组织α-SMA阳性细胞(黄褐色)表达少,汇管区(图P示处)附近门静脉、肝功静脉、胆管周围纤维组织可见;模型对照组肝组织α-SMA阳性细胞表达高于正常组,结构紊乱,于血管周围可见,且假小叶之间和内部出现α-SMA高表达阳性细胞;雷帕霉素干预组肝组织α-SMA阳性细胞较模型对照组减少,接近正常组,多见于血管、胆管周围,肉眼分析其总体阳性率接近于正常组阳性率。
图1三组肝脏组织α-SMA染色
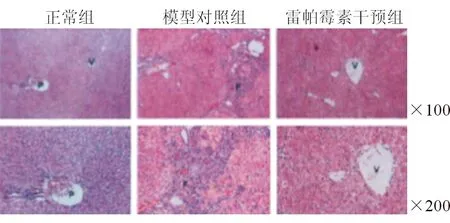
正常组肝组织结构清晰,肝细胞呈条索状自正常中央静脉(图V中示处)向四周放射,肝细胞形呈六边形,可见清晰肝窦,汇管区(图P示处)由胆管、门静脉、肝动脉构成,结构清楚;模型对照组肝组织中结构紊乱,假小叶形成明显,且小叶间与小叶内均可见大量成纤维细胞(图F示处),汇管区及中央静脉被破坏;雷帕霉素干预组肝组织中成纤维细胞较模型对照组减少,于中央静脉(图V示处)处可见,结构不正常,较对模型对照组好转。
图2三组肝脏组织HE染色
二、 雷帕霉素抑制肝纤维化进程中肝细胞上皮间质转化机制分析
模型对照组肝脏中肝细胞内Ⅰ型胶原表达较正常组明显增高(P<0.05),上皮标志物E-cadeherin、connexin43表达较正常组明显减少(P<0.05),间质细胞标志Vimentin、α-SMA表达较正常组明显增高(P<0.05),上皮间质转化通路重要蛋白p-smad2、p-smad3、smad2/3、smad4较正常组明显增高(P<0.05)。雷帕霉素干预组肝脏内肝细胞Ⅰ型胶原表达及Vimentin、α-SMA表达较模型对照组显著下降(P<0.05),肝细胞E-cadeherin、connexin43表达较模型对照组明显增高(P<0.05),p-smad2、p-smad3、smad2/3、smad4表达较模型对照组显著下降(P<0.05),见图3~5。
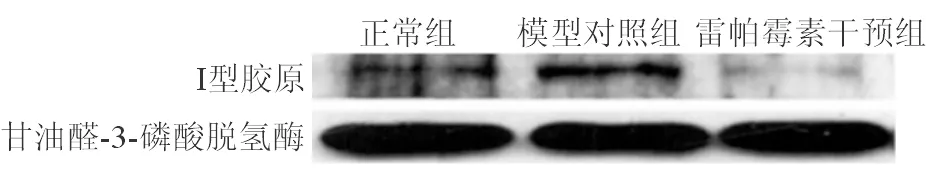
Western blot示与正常组相比,模型对照组肝细胞内Ⅰ型胶原表达明显升高;与模型对照组相比,雷帕霉素干预组Ⅰ型胶原表达明显下降(甘油醛-3-磷酸脱氢酶表达较一致,证实总蛋白即上样量基本相同,重复3次结果一致)。
图3三组肝细胞内Ⅰ型胶原表达变化
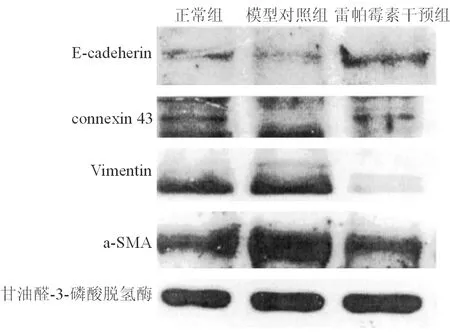
与正常组相比,模型对照组上皮标记明显减少,间质标记物明显增多,即E-cadeherin、connexin43表达明显减少,Vimentin、α-SMA表达明显增高;与模型对照组相比,雷帕霉素干预组上皮标记物明显增多,间质标记物明显减少,即E-cadeherin、connexin43表达明显增高,Vimentin、α-SMA表达明显降低(甘油醛-3-磷酸脱氢酶为内参,调整上样量差异,重复实验3次,结果基本一致)。
图4三组肝细胞上皮和间质标记物变化
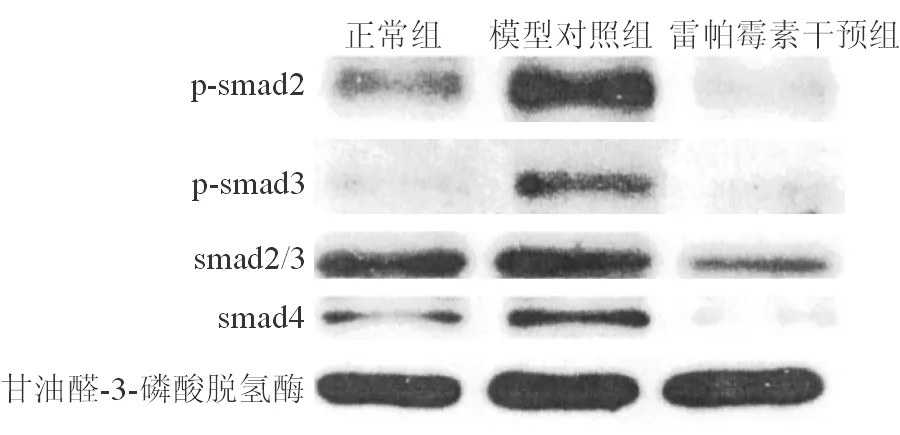
与正常组相比,模型对照组上皮间质转化通路重要蛋白p-smad2、p-smad3、smad2/3、smad4表达明显增多;与模型对照组相比,雷帕霉素干预组p-smad2、p-smad3、smad2/3、smad4表达明显下降(甘油醛-3-磷酸脱氢酶为内参,调整上样量差异,重复实验3次,结果基本一致)。
图5三组肝细胞内上皮间质转化通路重要蛋白表达变化
讨 论
近年来有研究表明,肝细胞上皮间质转化与肝纤维化有关[3]。Nishikawa等[4]采用TGF-β1处理体外培养所致大鼠成熟肝细胞,发现肝细胞经TGF-β1处理后白蛋白表达明显下降,Ⅰ型胶原表达上升;而TGF-β1处理后尚存活肝细胞伴上皮间质转化,推测肝纤维化中肝细胞上皮间质转化起着重要作用。王川林[5]等发现,肝纤维化中纤维组织母细胞部分源于成熟肝细胞。四氯化碳诱导大鼠肝纤维化模型属接近肝炎肝纤维化模型。本研究经建立该模型发现,大鼠肝纤维化过程中成熟肝细胞发生上皮间质转化,E-cadeherin、connexin43表达明显减少,间质细胞标志Vimentin、α-SMA表达明显增高,且发现这类肝细胞分泌Ⅰ型胶原增多,预示肝纤维化过程中肝细胞上皮间质转化发挥着重要作用。本研究发现,肝细胞内上皮间质转化通路重要蛋白p-smad2、p-smad3、smad2/3、smad4明显增高,进一步证实肝细胞上皮间质转化参与肝纤维化过程。
雷帕霉素属新型免疫抑制剂,其结合FK结合蛋白,使细胞因子与其受体结合后细胞内信号转导途径受阻,诱导细胞分化、增殖受抑;其中,磷酸酰肌醇激酶相关激酶调控诸多翻译元件蛋白合成,在细胞大小、增殖中起着调节作用,多因雷帕霉素靶蛋白(TOR)对mRNA翻译起始具有调控功能。雷帕霉素作用靶点磷酸酰肌醇激酶相关激酶属AKT下游重要基因,而AKT已被证实与上皮间质转化密切相关。AKT-mTOR通路调控细胞体积、侵袭性,而上皮细胞间质转化后其侵袭性增强、体积增大。临床证实,雷帕霉素能抑制上皮细胞上皮间质转化。雷帕霉素提前干预可使细胞体积、侵袭性下降,而此种情况在上皮间质化过程中也存在。目前雷帕霉素被广泛应用于移植领域,而肾移植术后移植肾脏纤维化属肾移植术后肾脏慢性失功机制,细胞因子(包括TGF-β1等)引起肾脏近端小管上皮细胞上皮间质转化,最终诱发肝纤维化。Xiang等[6]通过研究各种免疫抑制剂对TGF-β1所致肾脏近端小管上皮细胞上皮间质转化的影响,发现雷帕霉素可使上皮间质转化受抑。而李文文等[7]报道,雷帕霉素体外、体内分别可抑制肝星状细胞增殖、四氯化碳诱导大鼠肝纤维化。Bridle等[8]发现,雷帕霉素可抑制TGF-β1、CTGF、PDGF表达,上调p27、p21,抑制p70s6k磷酸化,抑制肝纤维化。
本研究发现,雷帕霉素干预组肝细胞较模型对照组更接近正常组织中肝细胞表面标记表达,提示阻断肝细胞上皮间质转化是雷帕霉素抑制肝纤维化重要机制。本研究结果显示,雷帕霉素干预组肝脏内肝细胞Ⅰ型胶原表达及Vimentin、α-SMA、p-smad2、p-smad3、smad2/3、smad4表达较模型对照组明显下降,肝细胞E-cadeherin、connexin43表达较模型对照组明显增高,提示雷帕霉素可下调smad蛋白,而这类蛋白在肝细胞上皮间质转化中被激活,证实雷帕霉素可能经下调这类蛋白抑制肝细胞上皮间质转化,从而减轻肝纤维化。
——雷帕霉素

