Zucker糖尿病肥胖大鼠脑血管病变特点和发病机制研究
王木兰,陈姣姣,郁 晨,马全鑫,徐松涛,陈民利
(浙江中医药大学,中医药科学院/比较医学研究所,杭州 310053)
据流行病学调查显示,2017年全球糖尿病患者约有4.25亿人,预测到2045年,全球将会有6.29亿人患有糖尿病[1]。糖尿病会引起多组织多脏器的并发症,如糖尿病肾病,糖尿病视网膜病变及糖尿病性脑血管病(diabetic encephalopathy,DE)等,DE是糖尿病并发症中较严重且常见的一种,致残率高,严重威胁着人类的健康。DE的病变特征包括颅内大血管和微血管病变,颅内大血管的病变主要为血管狭窄、闭塞,微血管病变则表现为基底膜增厚、渗透性增加和微循环障碍等[2]。
目前关于DE动物模型的发病特点和机制研究较少,寻找与人类发病机制类似、病理特点相近的动物模型至关重要。Zucker糖尿病肥胖(zucker diabetes fatty,ZDF)大鼠具有肥胖、胰岛素抵抗、脂质紊乱及糖耐量异常等代谢综合征,前期表现为高胰岛素血症,后期胰岛β细胞功能衰竭,与人类2型糖尿病发病进程相似,以微血管并发症为主要病变特征,常用于糖尿病及其并发症的研究[3-4]。本文利用磁共振成像技术、病理组织学和分子生物学方法,观察ZDF大鼠DE的病理特点并初步探讨其发病机制,为ZDF大鼠用于DE的研究提供实验基础和参考。
1 材料和方法
1.1 实验动物
SPF级8~9周龄雄性ZDF大鼠及同周龄的雄性瘦型(zucker lean, ZL)大鼠各8只,由北京维通利华实验动物技术有限公司提供[SCXK(京)2016-006];饲养于浙江中医药大学动物实验研究中心屏障实验室[SYXK(浙)2018-0012],环境温度:(22±2)℃,相对湿度:50%~60%,光照:12 h/12 h 明暗交替,噪声<50 dB;在 IVC笼内饲养,自由饮食。所有动物实验经浙江中医药大学实验动物伦理审查委员会审核通过(编号: IACUC-20180502-01)。
1.2 主要试剂与仪器
血糖检测试剂,购自上海申能德赛诊断技术有限公司;糖化血红蛋白(HbA1c)检测试剂,购自爱尔兰Trinity Biotech 公司;苏木色精,购自上海伯奥生物科技有限公司;曙红Y,购自国药集团化学试剂有限公司;生物素山羊抗大鼠IgG抗体,购自美国Immunoway公司;ALB和IgG抗体,购自美国Santa Cruz公司;ZO-1与Occludin抗体,购自美国Affinity公司;Mounting Medium With DAPI,购自北京中杉金桥生物技术有限公司。
7020全自动生化分析仪(日本,日立公司);Discovery750超导磁共振扫描仪(美国,GE公司);HM335E 半自动石蜡切片机(德国,Microm公司);Nana Zoomer 2.0RS 数字切片扫描设备(日本,滨松公司);自动染色机(德国,Leica公司);H-7650 透射电子显微镜(日本,日立公司);VS120-S6-W数字病理切片(荧光)扫描分析仪(日本,Olympus公司)。
1.3 实验方法
1.3.1 动物模型的建立
取8~9周龄雄性 ZDF 大鼠8只,饲喂 Purina#5008饲料,连续饲喂12周;另取8只同周龄雄性ZL大鼠饲喂普通饲料,作为正常对照组。ZDF大鼠每笼2只,ZL大鼠每笼4只。
1.3.2 一般状态观察
造模结束后,进行Y迷宫实验,具体方法为:实验过程包含训练期与测试期,大鼠均由起始臂放入。训练期时,用挡板将新异臂隔开,大鼠在起始臂和其他臂内自由活动10 min后,放回IVC笼内。1 h后进行测试,去掉新异臂挡板,大鼠可在3个臂中自由活动5 min。摄像记录5 min内大鼠在新异臂内停留的时间。具体实验操作参照窦萌萌[5]论文中的实验方法学,定量分析:大鼠对新异臂的探索时间/总时间(5 min)×100%。
禁食不禁水10 ~12 h,称取体重,并通过颌下取血,采集全血测定糖化血红蛋白(HbA1c);分离血清,检测空腹血糖(fasting blood sugar, FBS)。
1.3.3 磁共振血管成像
对大鼠进行磁共振血管成像(magnetic resonance angiography,MRA)扫描。具体方法如下[6]:大鼠麻醉后行俯卧位,采用GE Discovery750超导磁共振扫描仪与大鼠专用线圈。MRA用三维时间飞跃(3D time-of-flight,3D TOF)序列扫描,具体参数如下:重复时间(repetition time,TR)=31 ms,回波时间(echo time,TE)=4.9 ms,翻转角(flip angle)=30°,层厚(slice thickness)=0.6 mm,视野(field of view,FOV)=80 mm×100 mm,矩阵=384×256(frequency × phase)。
1.3.4 病理组织学观察
腹腔注射戊巴比妥钠(45 mg/kg)麻醉,使用4%多聚甲醛灌注20 min,摘取脑组织,取一部分脑组织于10%中性甲醛中固定,用于常规病理和免疫荧光染色,另一部分脑组织取皮质部脑组织,切成约1 mm3小块6~8粒,置于2.5%的戊二醛中固定,用于透射电镜切片制作。
48 h后取甲醛固定组织,脱水、透明、浸蜡、包埋、切片、脱蜡后制成石蜡切片,苏木素-曙红(HE)染色后光学显微镜下观察脑组织病理变化;对Alb、IgG、ZO-1和occludin蛋白进行免疫荧光染色后,荧光显微镜下观察不同蛋白的表达情况,并利用Image J软件进行定量分析,计算平均光密度。取戊二醛固定的脑组织样本,依次经过脱水、浸透、包埋及切片,枸橼酸铅染液中染色,透射电镜观察。
1.4 统计学方法

2 结果
2.1 ZDF大鼠一般体征与行为学的变化
20周龄时,与正常对照组ZL大鼠比较,ZDF大鼠体重、FBS和HbA1c均显著升高(P<0.01);Y迷宫实验中模型对照组ZDF大鼠在新异臂停留的时间显著低于正常对照组(P<0.05)(图1)。
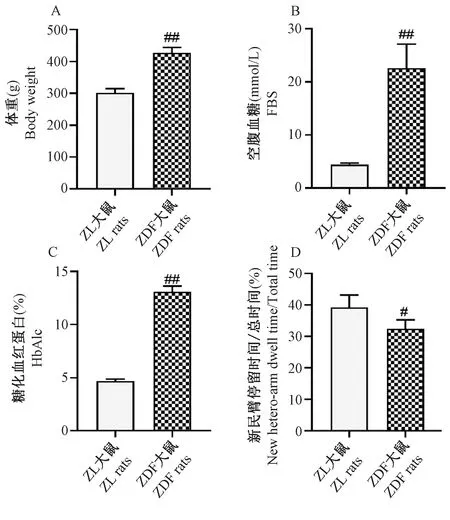
注:与ZL大鼠比较,#P<0.05,##P<0.01。图1 ZDF大鼠一般体征与行为学变化Note. Compared with ZL rats, #P<0.05,##P<0.01.Figure 1 The changes of general physical signs and behavior in ZDF Rats
2.2 ZDF大鼠脑血管形态学的改变
由磁共振血管成像图可见,正常对照组大鼠椎动脉较粗壮,脑内动脉清晰可见,未见狭窄、闭塞等现象;模型对照组大鼠椎动脉显影与正常对照组无明显区别,但脑内动脉出现节段性狭窄,远端分支少且显影差,部分出现血流中断与远端不显影等严重闭塞情况(图2)。常规病理学观察可见,与正常对照组相比,模型对照组大鼠脑血管管腔狭窄,神经元数量减少且发生排列紊乱与核固缩等情况(图2)。
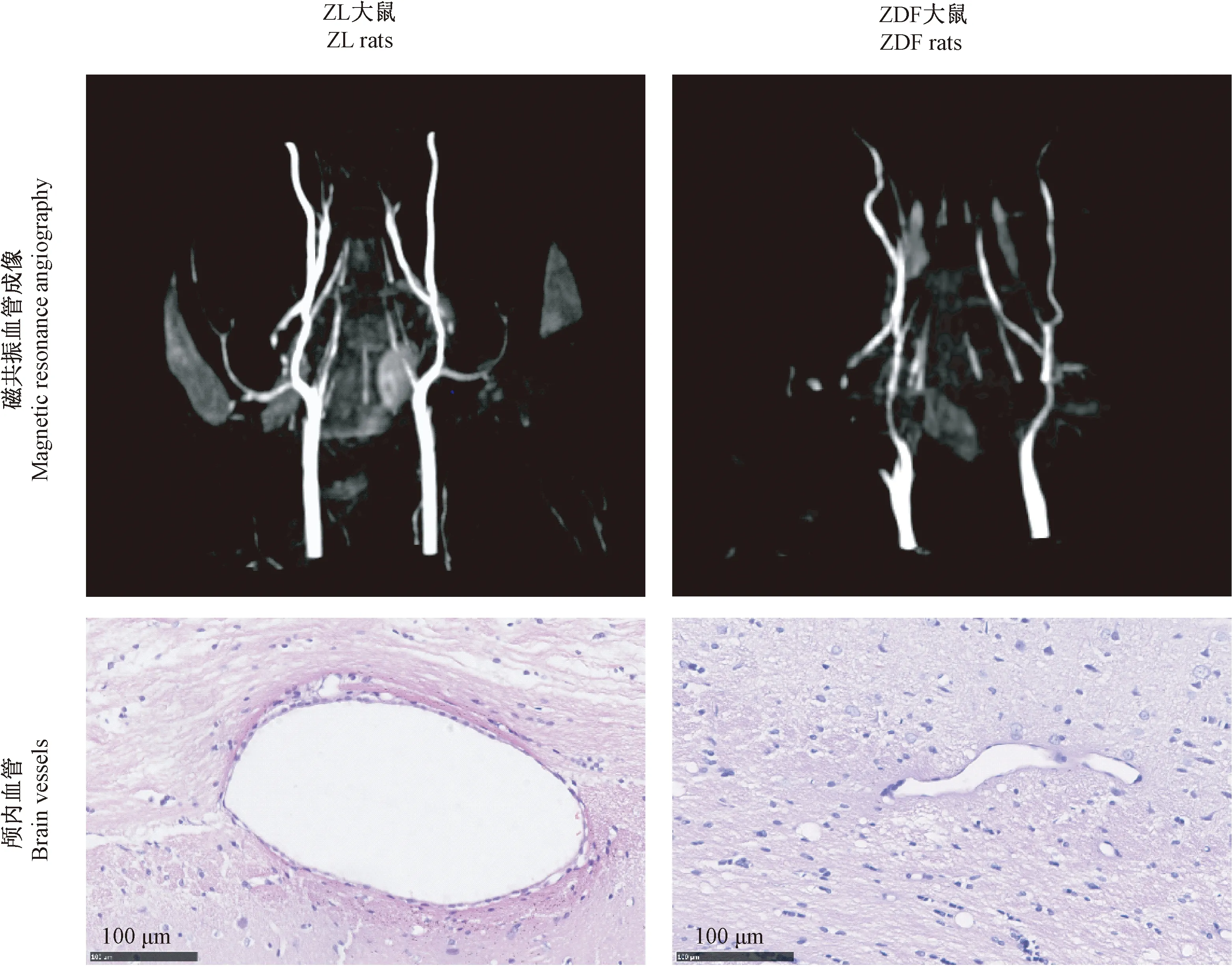
图2 ZDF大鼠脑内大血管形态变化Figure 2 Histological changes of large vessels in the brain tissues of rats.HE staining

图3 ZDF大鼠脑内微血管形态变化Figure 3 Histological changes of cerebral microvessels of the ZDF rats
2.3 ZDF大鼠脑微血管超微结构的改变
正常对照组ZL大鼠脑组织皮层微血管管腔较大,血管周边有星形胶质细胞附着,并存在少量髓鞘,细胞内部细胞器清晰可见,无明显异常;模型对照组ZDF大鼠微血管发生严重闭塞,血管周围神经纤维水肿、线粒体退化缺失(图3)。
2.4 ZDF大鼠脑血管渗透性的改变
免疫荧光染色结果可见,对照组ZL大鼠脑组织血管周围无Alb和IgG表达,而ZDF大鼠脑组织血管周围Alb和IgG有较多阳性表达(图4A,4B)。通过定量分析可见,ZDF大鼠脑组织中Alb和IgG表达均显著升高(P<0.01)(图4C,4D)。
2.5 ZDF大鼠脑血管紧密连接蛋白的表达
免疫荧光染色结果可见,对照组ZL大鼠脑组织皮质血管壁上均有较丰富的occludin和ZO-1蛋白表达,而ZDF大鼠脑组织血管壁occludin和ZO-1蛋白表达较少(图5A,5B)。通过定量分析可见,ZDF大鼠脑组织中occludin和ZO-1蛋白表达显著降低(P<0.05)(图5C,5D)。
3 讨论
糖尿病患者发生脑血管病的风险是非糖尿病患者的4~10倍,且为糖尿病患者死亡的重要因素[7],而DE的诊断和发病机制尚不明确。疾病动物模型的建立和评价是研究疾病病理特点和治疗手段的关键环节,寻找与人类DE致病因素相似且符合DE发病特点规律的动物模型至关重要,但目前关于DE动物模型的观察和评价研究并不系统、完善。本文通过行为学、影像学、病理和分子生物学实验对ZDF大鼠DE的病理特点进行了评价,并对其发病机制进行了探讨。
认知功能障碍是DE的主要病症之一,本课题研究者利用Y迷宫实验对ZDF大鼠的认知功能进行了评价。评价啮齿类动物的认知功能障碍常用Morris水迷宫的方法,但ZDF大鼠生性好静懒动且肥胖,水迷宫实验时常常浮于水面,不配合实验,因此本实验采用Y迷宫实验,利用动物对新环境的探索本能评价ZDF大鼠的认知功能,实验过程中对动物无伤害、无刺激,且操作简便[8-9]。大鼠在每个臂停留的时间理论上应为33%左右,但由于大鼠对新环境的探索,在新异臂停留的时间会上升,但记忆力下降时,大鼠对新异臂的探索时间下降[10]。本实验结果显示,正常对照组大鼠平均对新异臂探索时间为39.2%,而模型对照组大鼠在新异臂停留时间下降,提示ZDF大鼠已发生认知功能障碍和记忆能力损伤。
MRA是一种无创性、基于磁共振成像的血管成像技术。MRA可生成动脉和少量的静脉的图像,以评估它们的狭窄、闭塞、动脉瘤或其他异常[11]。在本实验中,ZL大鼠脑内血管轮廓清晰、粗壮,而模型
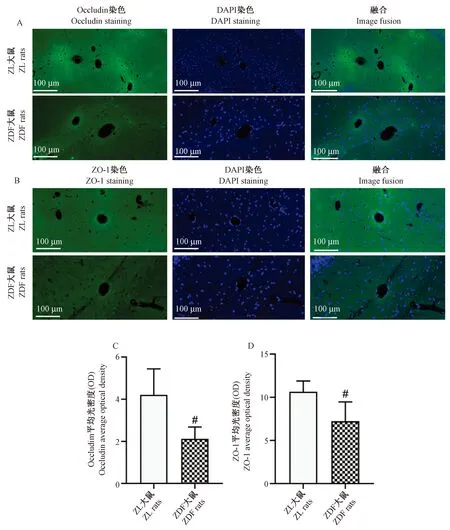
注:A:大鼠脑皮质组织Occludin免疫荧光染色;B:大鼠脑皮质组织ZO-1免疫荧光染色;C:大鼠脑皮质组织中Occludin表达的变化;D:大鼠脑皮质组织中ZO-1表达的变化。 与ZL 大鼠比较,#P<0.05,##P<0.01.图5 ZDF大鼠脑组织中Occludin和ZO-1的表达Note. Compared with the ZL rats, #P<0.05,##P<0.01.Figure 5 Expression of occludin (A,C) and ZO-1 (B,D) in the brain tissue of ZDF rats.Immunofluorescence staining
组大鼠脑血管发生明显的节段性狭窄和部分闭塞,提示在代谢紊乱的环境下,ZDF大鼠脑内大血管已发生病变,通过常规病理学观察,进一步证实了ZDF大鼠脑内大血管出现狭窄。
透射电镜可观察毛细血管状态和周围神经细胞的超微结构。本实验研究发现,ZDF大鼠脑组织微血管出现严重闭塞,血管周围神经纤维水肿、线粒体退化、缺失。推测可能是由于局部供血不足引起神经细胞损伤,从而导致ZDF大鼠认知功能障碍。
Alb是哺乳动物中最丰富的血液蛋白质,IgG由浆细胞产生,是血清和细胞外液中含量最高的一类免疫球蛋白。正常情况下两者均不能通过血-脑屏障(blood-brain barrier, BBB),但在高血糖、高血脂、胰岛素抵抗等病理因素条件下,BBB通透性增加,导致Alb和IgG从血液穿过BBB进入脑组织[12-13]。本实验中,由免疫荧光染色结果可见,正常对照组大鼠脑血管附近几乎无Alb和IgG渗出,而模型对照组大鼠脑血管发生严重的Alb和IgG渗漏,说明ZDF大鼠BBB通透性增加。有研究显示,糖尿病动物模型血脑屏障通透性的增加和认知功能的降低与糖尿病的严重程度有一定相关性[14],这与本研究结果一致。
BBB的屏障特性显著依赖于相邻细胞之间的紧密连接[15-16]。因此,ZDF大鼠脑组织中ALB渗漏可能与紧密连接蛋白表达水平有关。组成紧密连接的蛋白质至少有40种,包括跨膜蛋白Occludin和细胞质蛋白[17]。ZO-1是一种与紧密连接相关的外周膜蛋白,它具有交联和固定紧密连接链蛋白支架的作用[18]。本实验通过脑组织免疫荧光定量分析后发现,正常对照组ZL大鼠脑血管壁上有丰富的Occludin和ZO-1蛋白表达,但模型对照组ZDF大鼠Occludin和ZO-1表达均显著降低,提示ZDF大鼠脑血管紧密连接蛋白缺失,导致BBB通透性增加,进而引起Alb渗漏和认知功能障碍。
综上所述,20周龄的ZDF大鼠表现为典型的肥胖和高血糖状态,出现认知功能障碍,脑内大血管狭窄、形变,微血管闭塞,周围神经纤维水肿,发病机制可能为紧密连接蛋白缺失导致BBB功能破坏,血管渗透性增加,从而产生血管形态和功能病变。

