TGF-β3,HA,PTHrP对人脐带间充质干细胞成软骨分化的影响
周晓旭,彭 俊,胡 海,张映辉,佟明华*,顾为望,*
(1.南方医科大学实验动物中心,广州 510000; 2.南部战区空军医院,广州 510000;3.五邑大学, 广东 江门 529020)
1 材料和方法
1.1 实验材料
胎儿娩出后立即结扎脐带,无菌处理后放入生理盐水中,充分洗净脐动静脉内的血液,剪成1~2 cm长度。用止血钳和镊子分离脐动静脉,外膜。剪碎脐带成1 mm3大小的组织块,用PBS清洗一遍,均匀放置在培养瓶中,加脐带间充质干细胞培养基,置于37℃,5% CO2的培养箱中培养。48 h后换液,培养。取第三代细胞进行实验。(经家属知情同意后取足月健康产妇的新生儿脐带)
1.2 主要试剂与仪器
间充质干细胞成软骨分化基础培养基,丙酮酸钠,ITS,抗坏血酸,脯氨酸,地塞米松,青链霉素(铂晋生物),TGF-β3(Peprotech),透明质酸(山东福瑞达),PTHrP(Peprotech),人脐带间充质干细胞培养基(赛业),FBS(赛业),CD34,CD45,CD90,HLA-DR(BD),RNA提取液(Servicebio),HyPureTMMolecular Biology Grade Water(HyClone),RevertAid First Strand cDNA Synthesis Kit(Thermo),FastStart Universal SYBR Green Master (Rox)(Roche)。
流式细胞仪(BD),显微镜(Olympus),离心机(Anke),匀浆仪(赛维尔生物),台式高速冷冻型微量离心机(DragonLab),荧光定量PCR仪(ABI),超净工作台(苏净安泰),超微量分光光度计(Thermo),标准试剂型纯水仪(青岛富勒姆),离心管(Axygen Biosciences),CO2培养箱(NAPCO)。
1.3 实验方法
1.3.1 人脐带间充质干细胞的鉴定
流式细胞仪检测表面抗原:取第3代脐带间充质干细胞,制成1×106~2×106/mL单细胞悬液,加抗体,避光20 min,PBS洗一遍,用流式细胞仪进行细胞表面标志的测定。
成脂诱导分化:取P3HUC-MSCs,加入成脂诱导分化培养基,培养14 d后,油红O染色。
宁波舟山港:初步测算,宁波舟山港约13%的美国航线箱量将受到影响。宁波舟山港集装箱吞吐量中美国航线占比为17%,国际航线受影响程度约2.2%。
成骨诱导分化:P3HUC-MSCs,加入成骨诱导分化培养基,培养21 d后,茜素红染色。
1.3.2 人脐带间充质干细胞成软骨诱导分化
当第2代细胞融合到80%~90%时,用0.25%胰酶消化,获得第3代脐带间充质干细胞,计数。取5×105的细胞转移至15 mL离心管中,250 r/min离心4 min。弃上清,加入1 mL基础培养基,重悬细胞,重悬后1000 r/min离心5 min,重复一遍。将所得的细胞沉淀用0.5 mL的成软骨诱导分化完全培养基重悬,重悬后离心1000 r/min离心5 min。离心完毕后,将离心管的管盖拧松,置于37℃,5% CO2的培养箱中培养。实验分成7组进行,见图1。

图1 诱导成软骨分化的分组Figure 1 Groupping of the chondrogenic differentiation test
1.3.3 HE染色观察
培养完成后,用4%多聚甲醛固定,石蜡切片脱蜡置于水中,苏木素染色,伊红染色,脱水封片,显微镜镜检,图像采集分析。
1.3.4 阿利新蓝染色观察
将培养后的样品用4%多聚甲醛固定,石蜡切片脱蜡置水,阿利新蓝染色,脱水封片,显微镜镜检,图像采集分析。
1.3.5 荧光定量PCR检测
取出待检测的样,检测标志基因Ⅱ型胶原,X型胶原,SOX9,ACAN的基因表达量。用Trizol法提取总RNA,逆转录成cDNA后进行PCR扩增。引物均由Servicebio公司合成,以ACTIN为参照基因,各基因引物序列见表1。数值由2-ΔΔCT计算得出。

表1 各基因引物序列
1.4 统计学方法

2 结果
2.1 人脐带间充质干细胞的培养及鉴定
2.1.1 人脐带间充质干细胞形态学观察
人脐带间充质干细胞生长迅速,增殖能力良好,细胞呈“梭形”生长,随着细胞大量生长后,细胞呈“旋涡状”生长。见图2。

图2 人第三代脐带间充质干细胞(Bar=500 μm)Figure 2 The third-generation human umbilical cord mesenchymal stem cells
2.1.2 流式细胞仪检测细胞表面抗原
应用流式细胞仪检测细胞表面抗原后显示,CD44和CD90为阳性,阳性率分别为99.69%和99.74%,CD34和HLA-DR的表达率是0.04%和0%,小于2%,符合间充质干细胞的定义。见图3。2.1.3 成脂成骨诱导分化能力
人脐带间充质干细胞成脂分化后,经油红O染色,镜下可见脂滴被染成橙红色,见图4。成骨分化后,经茜素红染色,镜下可见钙质结节被染成红色,见图5。
2.2 不同细胞因子组合的人脐带间充质干细胞成软骨分化的能力
2.2.1 HE染色
通过G2组和G1组相比,G4组和G3组相比,诱导28 d比21 d形成的软骨组织染色阳性区域增大,细胞增多,G6组G7组和G5组相比,G7组的阳性染色区域较大,G6组染色较深且分布均匀。培养21 d的三组相比,G1组染色阳性区域最小,细胞聚集在软骨组织外围,细胞最少,G3组较G1组染色阳性区域无明显差别,细胞分布均匀,数量较G1组多,G5组较前两组染色区域大,细胞较密集。培养28 d的四组相比,G2组染色分布不均,细胞数量较少, G4组G6组染色阳性区域无明显差别,G4组有部分未染色,细胞较少分布较松散,G6组细胞多,分布均匀且密集,G7组染色区域较大,细胞较多。见图6。
2.2.2 阿利新蓝染色
阿利新蓝染色检测酸性黏多糖,结果同HE染色较一致。见图7。
2.2.3 荧光定量PCR检测基因表达量
TGF-β3组和TGFβ3/HA组,培养28 d较21 d,COL2α1、COL10α1、SOX9、ACAN表达量上升。在TGFβ3基础加入HA后,COL2α1、SOX9、ACAN的表达量增加。差异有统计学意义。再加入PTHrP后,和TGFβ3/HA组比较,COL2α1、SOX9、ACAN的表达量上升,COL10α1的表达量下降,G5组G3组、G6组G4组、G7组G4组、G7组G6组之间均有统计学差异。说明HA,PTHrP可以上调Ⅱ型胶原、SOX9、ACAN的表达量,降低COL10α1的表达量,且加入PTHrP两周比加入一周效果更好。见图8。
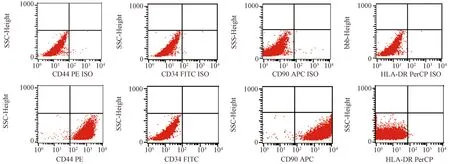
图3 人脐带间充质干细胞流式细胞检测Figure 3 Human umbilical cord mesenchymal stem cells determined by flow cytometry
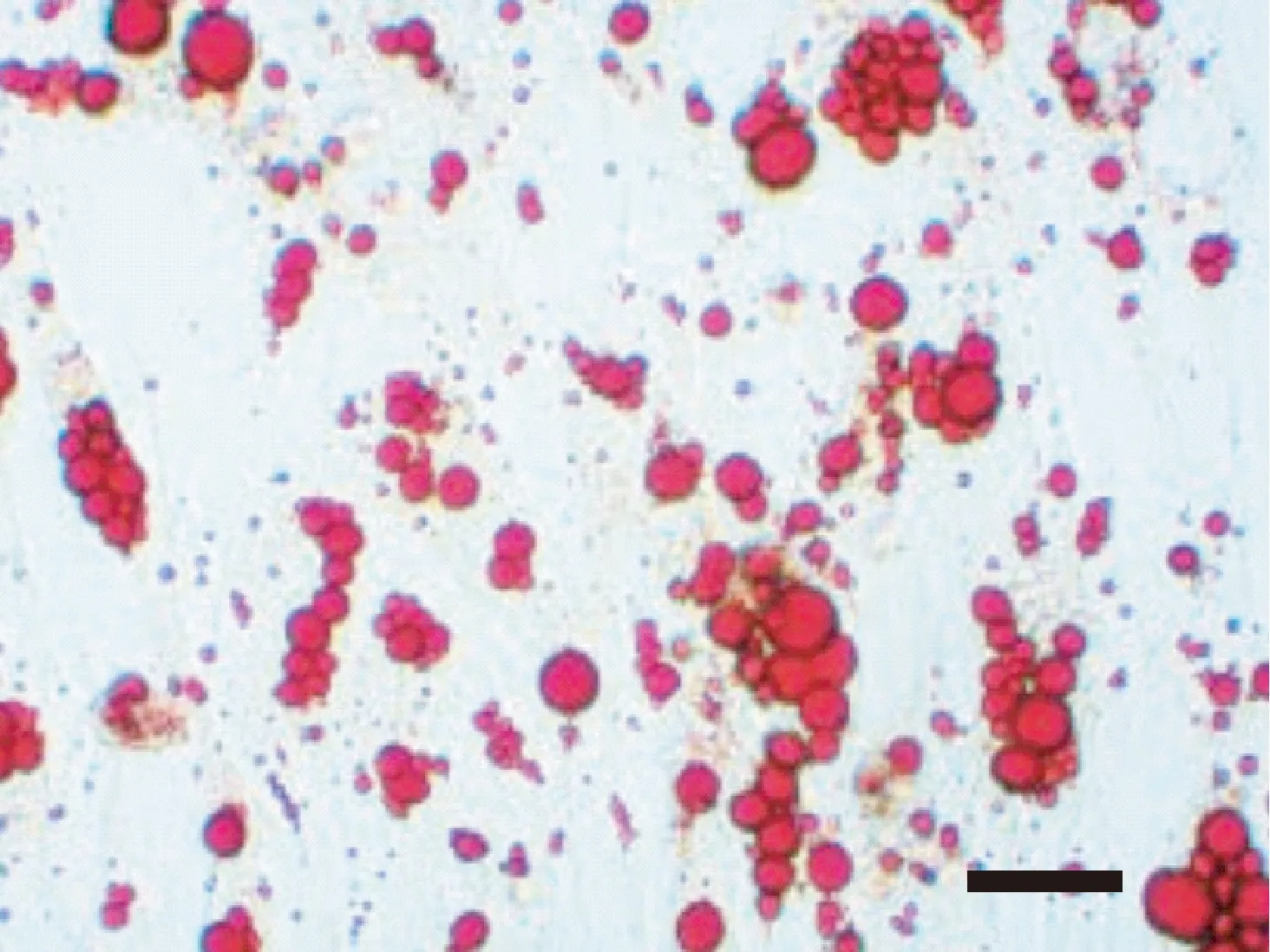
图4 成脂分化图(Bar=100 μm)Figure 4 Adipogenic differentiation

图5 成骨分化图(Bar=100 μm)Figure 5 Osteogenic differentiation
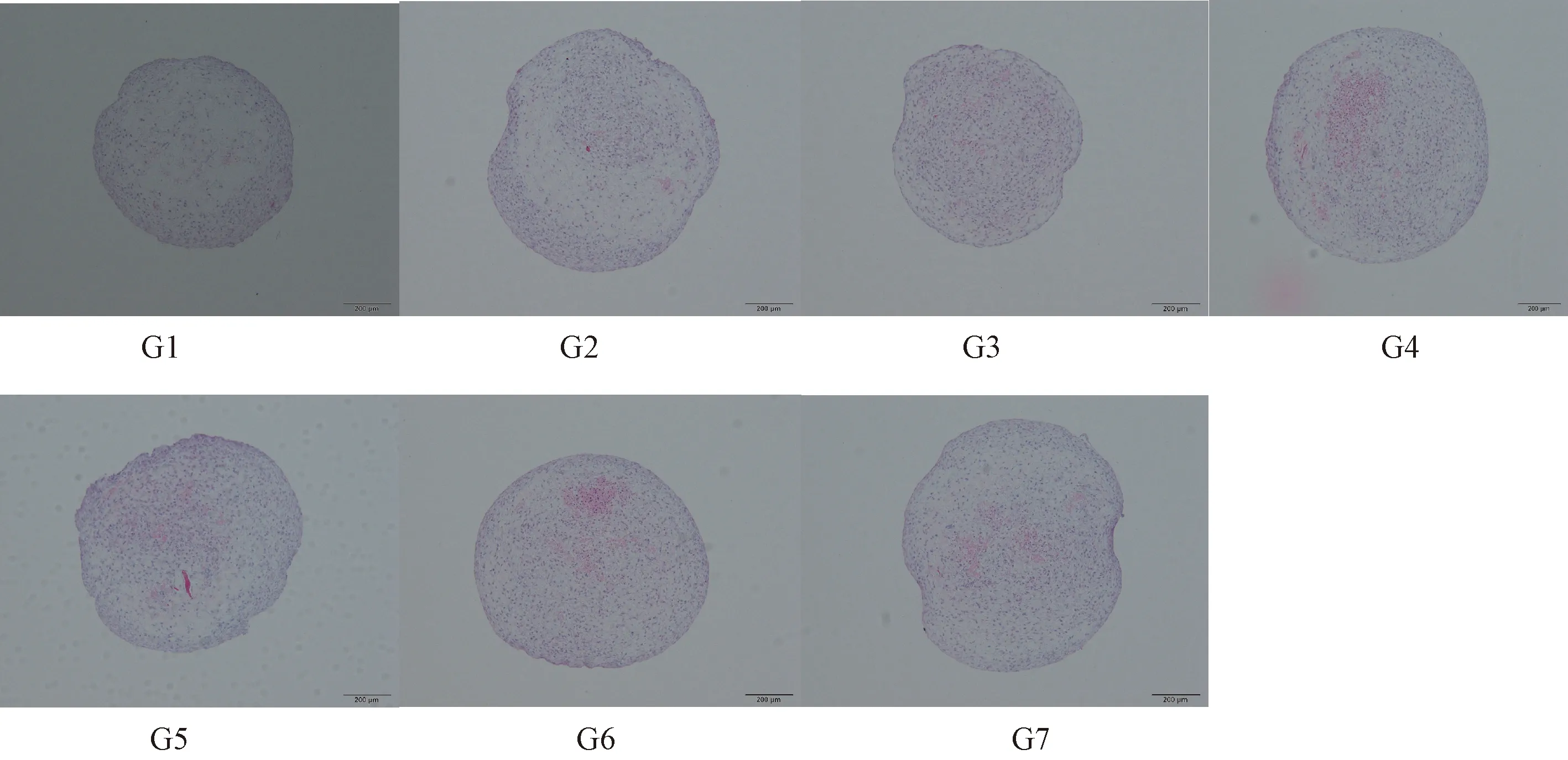
图6 人脐带间充质干细胞加入不同细胞因子组合后形成的软骨组织的HE染色(Bar=200 μm)Figure 6 Morphology of the cartilage tissues in each group, formed by human umbilical cord mesenchymal stem cells combined with different cytokines. HE staining.
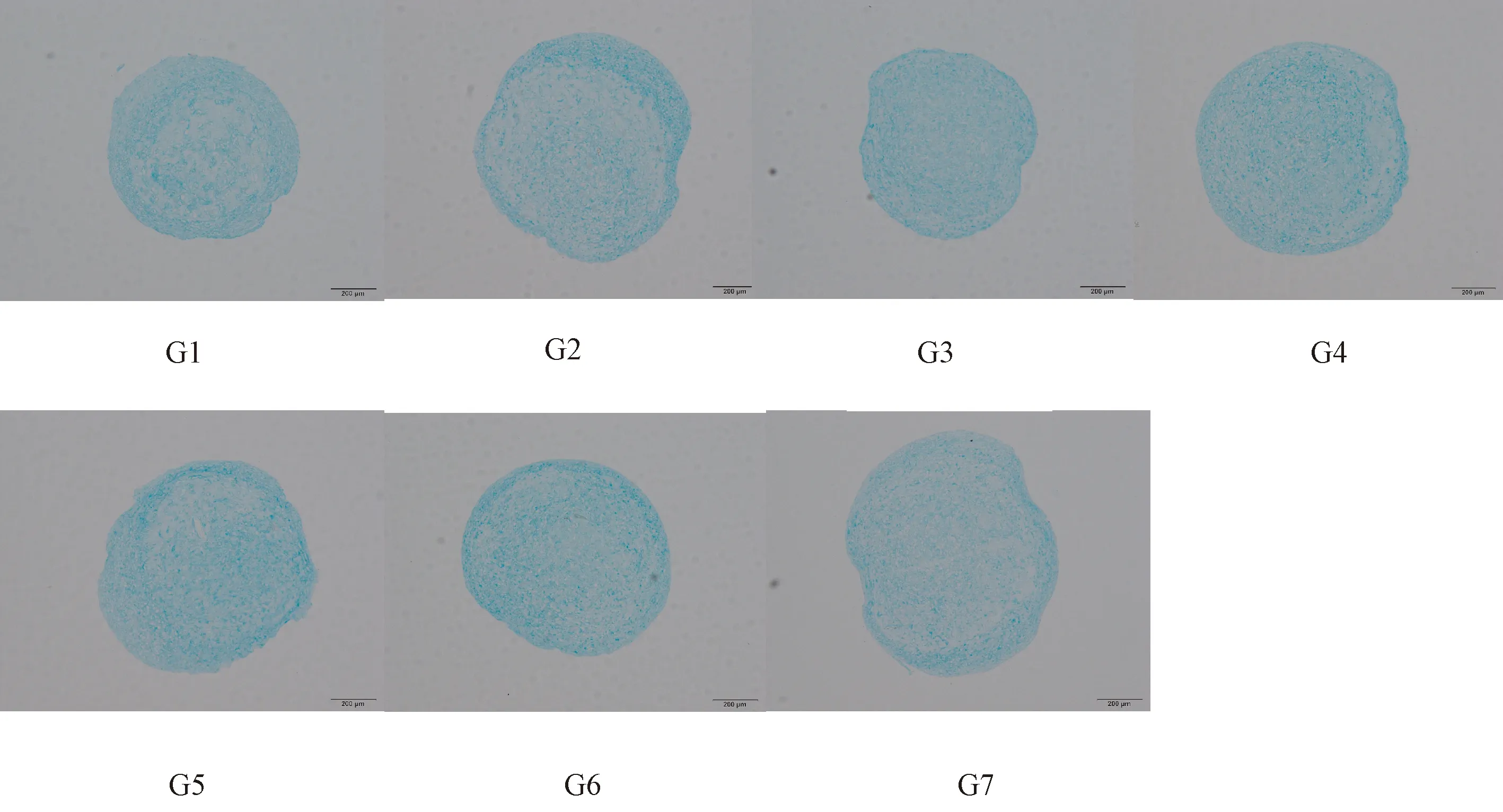
图7 人脐带间充质干细胞加入不同细胞因子组合后形成的软骨组织的阿利新蓝染色(Bar=200 μm)Figure 7 Morphology of the cartilage tissues formed by human umbilical cord mesenchymal stem cells in each group, combined with addition of different cytokines. Alcian blue staining.
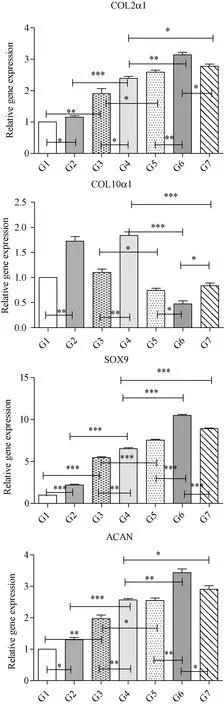
注:两两相比,*P<0.05,**P<0.01,***P<0.001.图8 各组软骨的基因表达量Note. Comparison between two groups,*P<0.05, **P<0.01, ***P<0.001.Figure 8 Expression of the chondrogenic genes in each group
3 讨论
软骨是由软骨细胞、胶原和蛋白多糖组成,由于无血管、神经及淋巴组织的特性,一旦损伤很难自我修复,一直是临床亟待解决的难题。随着组织工程技术和间充质干细胞技术的进步和发展,已经有很多实验研究表明干细胞向软骨细胞分化的能力[3-4]。为了让干细胞向软骨定向分化,一般是在培养时加入细胞因子或利用生物支架等等,例如转化生长因子-β家族(TGF-β)、骨形态发生蛋白(BMP)、胰岛素样生长因子(IGF)、成纤维样生长因子(FGF)、甲状旁腺激素相关蛋白(PTHrP)、Ⅱ型胶原透明质酸支架[5-6]。本实验就是通过HE、阿利新蓝染色以及测定Ⅱ型胶原、X型胶原、SOX9、ACAN的表达量来探讨TGF-β3,HA及PTHrP三者对人脐带间充质干细胞成软骨分化的联合作用。COLⅡ关节软骨的重要组成成分,是检测hUCMSCs向软骨分化效果的指标。ACAN是软骨细胞特异性的标志物,基因表达和产物可用于评估软骨形成[7]。COL2α1、ACAN的表达量高表明成软骨分化的效果好。X型胶原是软骨细胞肥大的标志,会使软骨细胞失去性能,进一步分化导致肥大的软骨细胞钙化。SOX9是软骨发育和成熟过程中的关键转录因子,多种信号通路在软骨形成过程中调节S0X9的表达和活性[8-9]。
众所周知,TGF-β3是经典的成软骨诱导因子,可以促进软骨细胞增殖,调节软骨细胞分化,增强ECM的合成,在软骨形成过程中起到重要的作用。从本实验中可以看出,只加入TGF-β3培养21 d就可以诱导hUCMSCs成软骨分化,培养28 d时,形成的软骨细胞数量增多,酸性黏多糖增加,COL2α1、SOX9及ACAN的表达量增加。TGF-β3与TGFβR-Ⅱ结合,激活Smad蛋白信号通路,表达Ⅱ型胶原和SOX9[10-11]。
HA是一种酸性黏多糖,是关节滑液和软骨基质的重要组成成分,有润滑、保护和营养关节软骨的作用。在MSCs成软骨分化的过程中,HA不仅可以用作支架材料,也可以作为调节因子。多项研究证实了HA可以促进软骨的形成[12-15],主要是通过与一些细胞表面受体(CD44,CD168,RHAMM等)的相互作用[16-17]。本研究的结果也表明HA和TGF-β3有协同作用。在TGF-β3基础上加入HA后,明显可以促进软骨细胞的增殖,上调COL2α1,ACAN,SOX9的表达量,促进软骨生成的效果优于单TGF-β3的效果,并且培养28 d效果也优于21 d。
PTHrP是抑制软骨细胞肥大的重要因素,而细胞肥大的特征之一就是COL-X的增多。本研究的结果表明PTHrP联合TGF-β3/HA可以抑制COL-10α1的表达量,增加COL-2α1、SOX9、ACAN的表达量,并且PTHrP作用的时间也影响抑制细胞肥大的效果。在添加PTHrP的三组中,虽然从14 d或21 d使用1周的PTHrP,都能促进软骨生成,抑制细胞肥大,但联合应用TGF-β3,HA28天,在第14天时加入PTHrP一起培养再培养14 d的效果最好,COL-2α1、SOX9、ACAN的表达量最高,而COL-10α1的表达量最低。多数学者认为,PTHrP通过与Ihh形成负反馈轴来调节软骨分化,离开细胞周期变成肥大的软骨细胞分泌Ihh诱导合成PTHrP,作用于PTH/PTHrP受体(PTH1R),受体激活触发几种不同的细胞内信号传导途径,包括Gαs/腺苷酸环化酶/环腺苷一磷酸(cAMP)/蛋白激酶A(PKA)和Gαq/ 11 /磷脂酶Cβ/蛋白激酶C(PKC)等,抑制软骨细胞持续肥大,使软骨细胞保持增殖状态,并且负反馈调节Ihh[18-19]。体外MSC在软骨形成的第一天开始表达PTHrP,并且随后下调PTHrP表达,伴随着促进肥大成熟[20]。当PTHrP合成的水平降至一定程度时,软骨细胞会停止增生并发生肥大[21]。KIM[22]的实验结果表明PTHrP可以促进软骨形成并抑制MSCs体外软骨形成中的肥大,SOX9,GAG和COL-2α1的表达量增加,COL-10α1的表达量减少,本实验结果与之相似。有研究表明SOX9会直接抑制软骨细胞COL-10α1和VEGFA等的肥大基因表达[23-24]。猜测是PTHrP一定程度上通过上调SOX9,抑制COL-10α1的表达。但是也有研究者认为PTHrP限制了软骨细胞的分化和成熟。PTHrP选择性抑制X型胶原的合成,对Ⅱ型胶原合成基本没有影响,而合成X型胶原是软骨细胞分化成熟的标志,提示PTHrP可抑制软骨细胞成熟过程[25]。造成这种结果的不同主要考虑是由于使用PTHrP的剂量、分子量、时间等的不同引起的。只有N末端完整的PTH和PTHrP才能有效刺激聚集蛋白聚糖合成[26]。
综上所述, TGF-β3,HA, PTHrP可以不同程度的促软骨分化。本实验表明,这其中联合应用TGF-β3,HA 28 d,在第14天时加入PTHrP一起培养,这种组合方式促进HUC-MSCs成软骨分化效果最好,且能抑制细胞肥大。但缺乏相应的体内实验,下一步将进行动物实验或进一步研究其具体的信号通路。

