肝癌相关指征在化学诱发小鼠肝癌过程中的动态研究
陈 峰,周 磊,苏 静,张大维*
(1.吉林省肿瘤医院,长春 130000; 2.长春中医药大学附属医院, 长春 130000; 3.吉林大学基础医学院,长春 130000)
恶性肿瘤作为世界上危害人类生命健康最严重的疾病之一,一直是医学领域内受到广泛重视的研究课题[1]。肝癌的发生与免疫功能有着密切的关系,免疫防御功能的降低和免疫监视功能低下易造成体内发生肿瘤[2]。肝癌是一种常见的恶性肿瘤,具有死亡率高、转移性强等特点[3-5]。随着科学日新月异的发展,手术、TACE(肝动脉化疗栓塞)、局部治疗、静脉化疗、生物靶向治疗等多种治疗方式能够显著提高肝癌患者的生活质量,延长部分患者的生命,但适应者数量有限,且术后恢复效果不佳,综合而言,肝癌的病死率仍居高不下,治疗效果欠佳[6]。因此深入研究肝癌的发生机制,了解肝癌发生过程中机体的变化,能够为后续肝癌的监控和治疗提供重要的依据和治疗策略[7-9]。建立肝癌动物模型是深入肝癌研究的前提条件,化学诱导法、原位移植法、基因修饰法是常见的三种建模方式[10]。其中化学诱发以操作便捷、价格低廉、易成型且肝癌发生过程与人类相似等特点,被广泛应用,而化学诱发中尤以DEN(二乙基亚硝铵)的效果最佳,DEN 是一种属于N-亚硝基的有机物质,能够诱导很多组织形成肿瘤,例如:肝、胃、造血系统、肺等多种组织[11-13]。利用DEN进行诱导,可对肝产生严重的损伤,具有较强的致癌性、致畸性和突变性,最直接的表现是中性粒细胞浸润,广泛的小叶出血性坏死,肝细胞异常分裂,胆管增生,纤维化,和桥接坏死,并最终导致肝癌[14]。据研究表明,DEN致癌剂联合CCL4(四氯化碳)促癌剂能够缩短诱导周期,同时能够减少模型动物的死亡率,大大提高成模率[15]。因此,本次试验选择DEN联合CCL4共同诱导小鼠肝癌发生,以达到高效建立小鼠肝癌模型的目的[16-18]。判断肝癌模型的相关指征主要有模式动物体重变化,形态特征,肝组织结构,肝脾指数,血液中谷丙转氨酶、谷草转氨酶、肌酐和总胆红素的含量及血清中总蛋白、白蛋白和尿素氮含量变化等[19]。本实验主要从这几个方面进行不同时间点的监测,以呈现出小鼠肝癌模型构建过程中相关指征的动态变化趋势,为肝癌模型构建及其病理研究提供参数和技术依据[19]。
1 材料和方法
1.1 实验动物
实验动物:SPF级30日龄雄性C57BL/6J小鼠42只,体重18~22 g,购自长春市亿斯实验动物技术有限责任公司[SCXK(吉)-2016-0003],在吉林大学基础医学院动物实验中心屏障环境下饲养[SYXK(吉)-2018-0001],并按照3R原则给予人道关怀。该研究已经通过吉林大学基础医学院伦理委员会审批,审批编号:2019年49号。
1.2 主要试剂与仪器
二乙基亚硝胺(DEN, Sigma);四氯化碳(天津市富宇精细化工有限公司);橄榄油(成都市科龙化工试剂厂)。
多功能酶标仪(型号:HBS-1096),电子分析天平(型号:FA2204B),恒温箱(型号:DHP120)。
1.3 实验方法
1.3.1 实验动物分组及造模
对照组(control group):正常雄性C57BL/6J小鼠21只,常规喂养;模型组(model group):正常雄性C57BL/6J小鼠21只,常规喂养。
1.3.2 给药方法
小鼠购入后在屏障环境下进行适应性饲养1 d,第2天针对模型组小鼠首先用DEN进行1次腹腔注射100 mg/kg(生理盐水配制);第2周再用DEN进行一次腹腔注射100 mg/kg(生理盐水配制),第3周后开始以CCl4和橄榄油(配制体积比20∶80)灌胃,0.05 mL/10 g,每周2次;持续灌胃至第20周,其中从第8周开始,CCl4和橄榄油溶液剂量增加为0.10 mL/10 g。
1.3.3 常规观察指标及检测指标
DEN诱发肝癌的过程大概要经过3个阶段,即肝硬变前期(1~8周)、肝硬变期(8~14周)、癌变期(14~20周);分别于造模后4、8、12、16、20、24、28周检测各项指标,基本能反映出肝癌诱变不同时期的变化特点。
诱癌开始后,每周称量小鼠体重;分别于造模4、8、12、16、20、24、28周后,随机选择模型组小鼠3只,对照组小鼠3只脱颈致死;观察两组小鼠肝的形态、颜色、质地和肉眼可见的肝表面癌结节数(拍照留存);取肝、肾称重并计算肝、肾/体重比,即肝脾指数。并于20周开始计算小鼠存活率和诱癌成功率,存活率=每组存活的小鼠数/各组小鼠总数 × 100%,诱癌成功率=诱癌成功小鼠数/各组小鼠数 × 100%。
将造模4、8、12、16、20、24、28周后处死的3只小鼠,取肝、肾和脾组织,一部分送去病理检测,一部分用作转录组测序,剩余组织的冻存液氮中以备后续使用。提取血液测定其中谷丙转氨酶、谷草转氨酶、肌酐和总胆红素的含量及血清中总蛋白、白蛋白和尿素氮含量。
1.4 统计学方法

2 结果
2.1 各组小鼠表征及肝癌发生状况
42只小鼠在肝癌诱发过程中,模型组小鼠死亡2只,一只在建模后的第6周死亡,另一只在建模后的第8周死亡。存活率为90.5%。死亡小鼠进行病理检测主要表现在肝水肿、充血、有大量炎细胞浸润。在建模的过程中,对照组小鼠肝无异常变化,肝色泽红润,表面光滑(见图1-1)。模型组小鼠普遍出现食欲下降、毛色暗淡、脱毛、整体状态差、体重降低等现象,相比对照组小鼠,模型组小鼠的肝组织在不同时期呈现出不同状况:在建模早期肝体积逐渐增大,颜色仍旧红润、质软、表面光滑,未见结节(图1-2);建模中期,小鼠肝重量增加,颜色逐渐变暗、变硬,表面凹凸不平、粗糙,有大小不等的结节,(图1-3);建模后期,小鼠肝表面出现大小不一、直径在1.0~3.0 mm之间的灰白色肝结节(图1-4)。建模成型后,肝表面粗糙、质硬,可见诸多结节,既有4.0~15.0 mm的单发大结节,也有1.5~3.0 mm的多发灰白色小结节(图1-5)。模型组存活的19只小鼠中,诱癌成功15只,成功率为78.95%。

图1 肝癌模型小鼠各阶段肝的形态变化Figure 1 Changes of gross appearance of the mouse livers
2.2 各组小鼠体重变化
与对照组小鼠比较,造模前各组组小鼠体重无明显差异。化学诱导建模第4周时,模型组小鼠平均体重开始下降。造模 4~12周,模型组小鼠体重均低于正常组;造模第12~28周,模型组小鼠均明显低于正常组小鼠(P<0.05,图2)。
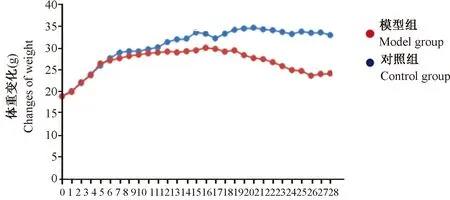
图2 各组小鼠体重变化对比Figure 2 Comparison of the changes of body weight in the mice
2.3 各组小鼠肝、肾功能和肝中蛋白含量的变化
实验测定、分析了不同时期建模组和对照组小鼠的肝肾功能变化,结果表明:模型组小鼠血清中谷丙转氨酶(GPT)、谷草转氨酶(GOT)、肌酐和总胆红素显著升高,说明模型组小鼠肝受到严重损伤。与对照组小鼠比较,模型组小鼠血清中总蛋白、白蛋白和尿素氮含量显著降低,模型小鼠血清中尿素氮可能与小鼠体内低蛋白水平有关,而γ-谷氨酰转肽酶(γ-GT)和碱性磷酸酶(ALP)虽有轻微增高的变化,但变化不明显(图3)。
2.4 各组小鼠肝、脾指数变化
模型组小鼠的肝、脾指数均明显高于对照组,同时,随着建模时间的延长,肝脾指数逐渐增加,表明建模组小鼠的肝脾受到一定程度的损伤(表1)。
2.5 各组小鼠肝、肾病理结果
成模结束后,选取肝癌模型小鼠和对照组小鼠进行HE染色病理分析,结果显示:对照组小鼠肝组织结构无异常现象,肝小叶结构清晰,肝细胞索以中央静脉为中心向四周整齐排列;而模型组小鼠肝组织逐渐出现异常,建模12周以前,肝的变化主要表现在细胞变大,并呈现空泡状变化,细胞排列混乱,细胞核都挤向细胞一侧,同时能够观察到有部分炎性细胞的浸润,可以看到为数不多的由于肝细胞凝固坏死形成的嗜酸性小体。在建模16周后,模型组小鼠的肝小叶结构逐渐消失不见,形成假小叶,中央静脉缺失或偏离原来位置,肝细胞索结构紊乱,并出现肝细胞越来越多的坏死,有些会出现空泡状的变化,细胞核出现大小不一的现象,同时很容易观察到嗜酸性小体,细胞形状出现明显变化。建模20周后,模型组小鼠肝细胞状态明显表现出肝癌特征,细胞排列非常紊乱并拥挤,细胞的大小、形态各异,可见巨核,核异型性非常明显,间质间可见较明显的炎细胞浸润(图4)。

图3 各组小鼠肝、肾功能和肝中蛋白含量的变化Figure 3 Changes of liver and kidney functions and liver protein contents in the mice
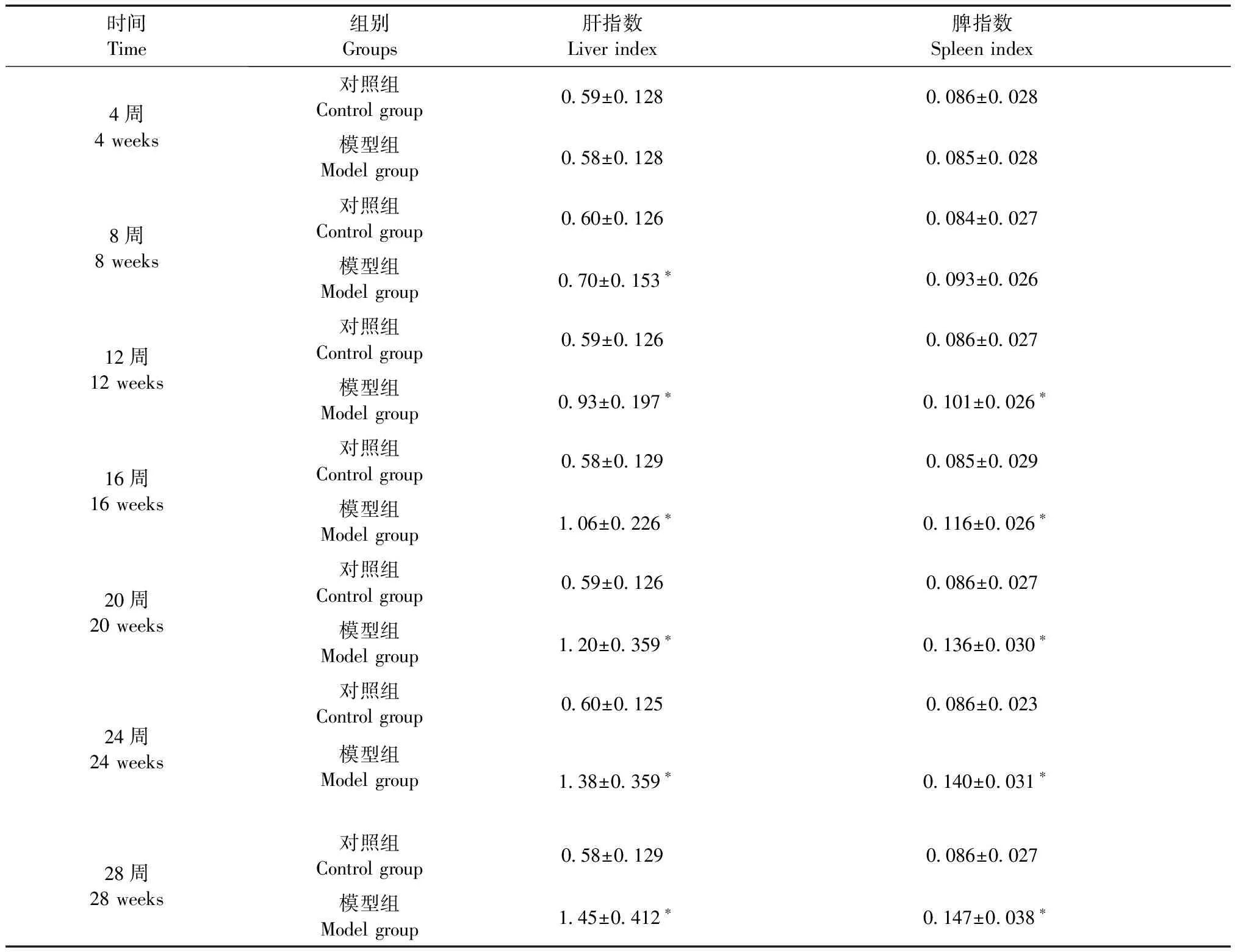
时间Time组别Groups肝指数Liver index脾指数Spleen index4周4 weeks对照组Control group0.59±0.1280.086±0.028模型组Model group0.58±0.1280.085±0.0288周8 weeks对照组Control group0.60±0.1260.084±0.027模型组Model group0.70±0.153∗0.093±0.02612周12 weeks对照组Control group0.59±0.1260.086±0.027模型组Model group0.93±0.197∗0.101±0.026∗16周16 weeks对照组Control group0.58±0.1290.085±0.029模型组Model group1.06±0.226∗0.116±0.026∗20周20 weeks对照组Control group0.59±0.1260.086±0.027模型组Model group1.20±0.359∗0.136±0.030∗24周24 weeks对照组Control group0.60±0.1250.086±0.023模型组Model group1.38±0.359∗0.140±0.031∗28周28 weeks对照组Control group0.58±0.1290.086±0.027模型组Model group1.45±0.412∗0.147±0.038∗
注:与对照组比较,*P<0.05。
Note. Compared with the control group,*P<0.05.

图4 肝病理图(HE染色,×200)Figure 4 Pathological changes in the liver tissues of the mice at different stages.HE staining
3 讨论
肝癌动物模型的建立是肝癌研究的基础,而化学诱发小鼠肝癌模型是基础科学研究和临床研究中经常使用的模型建立方式,同时由于其类似人类肝癌形成过程,因此,是目前进行肝癌研究的首选建模方式[20-22]。
DEN作为比较常用的化学致癌剂,致癌率较高,因此,常被用作肝癌动物模型的启动剂和致癌剂[23]。另外,有研究表明,CCL4对肝也具有较大的毒性,也会对肝造成损伤,因此,本实验通过以DEN为启动剂进行腹腔注射,在这里经过改良,将一次注射,改为两次注射,以增加启动刺激性,为成功建模奠定基础[19]。而后通过以CCl4和橄榄油混合液进行灌服,联合诱发小鼠肝癌模型的建立,通过这种方式建立模型的病理变化会经过肝炎、肝硬化、非典型性增生,最后肝癌形成的过程,这些变化过程与人类肝癌形成的变化过程非常相似,另外,此种模型的重复性和稳定性都较好,因此,该模型的建立对研究人类肝癌具有重要作用,为肝癌的治疗奠定基础[19-22]。本实验以C57BL/6J小鼠为实验对象,在诱癌实验早期观察到模型小鼠的病理改变主要为肝细胞的炎性损伤、增生浸润引起肝组织的变性和肿大。在诱癌的中-晚期则出现嗜酸性结节小体、空泡结构和肝硬化、肝癌的发生[10,23]。本实验组肝细胞性肝癌阳性率为78.95%,肝组织均呈明显肝硬化改变。这些病理改变与人类肝癌在肝硬化的基础上发生有一定的相似之处[24-25]。小鼠在诱癌实验过程中死亡的主要原因在早期和中期为诱癌剂的毒性作用引起的中毒性死亡,而在晚期则主要是因为肿瘤晚期动物体质衰竭引起的死亡[26]。
由于致癌剂二乙基亚硝胺(DEN)的化学毒性作用,传统一次性给药方法后小鼠在诱癌阶段的实验性死亡明显增加,影响了诱癌数量及诱癌周期,导致实验观察结果的误差[27]。在本研究中笔者采用化学诱癌剂DEN分次饲喂法结合后期添加一定配比CCl4/橄榄油建模方法,这样可缓解诱癌剂对建模小鼠的毒副作用,有效地降低了建模小鼠的实验性死亡率。
本实验中,通过对模型组小鼠和对照组小鼠体重、肝脾指数、病理、血清中谷丙转氨酶(GPT)、谷草转氨酶(GOT)、肌酐和总胆红素及血清中总蛋白、白蛋白和尿素氮含量的检测获得了建模不同时期的动态数据。在建模初期各项指标与对照组相差无几,随着建模时间的延长,模型组小鼠逐渐表现出肝癌的症状。实验结果显示,在建模16周左右,建模小鼠各项指标表现出较为显著的变化,24~28周均表现出明显的肝癌症状,实验对不同时间节点检测分析的表征数据能够很好体现肝癌模型的发展变化。
通过本肝癌小鼠建模实验,笔者认为:①建模小鼠的分组要合理,每笼动物7~8只,尽可能给动物充足的活动空间;②保证每只动物同时进食,药量均匀;③饲料、饮水要清洁充足;④由于小鼠有啃食死鼠的习性,如发现精神状态差、不好动、不进食的动物,要分笼喂养,以防患病小鼠死后被同类吃掉;⑤诱癌剂DEN应按照所需配制浓度充分溶解于生理盐水。
本实验结果表明,随着诱癌时间的延长,小鼠肝硬化程度逐渐加重,肝癌的发生率明显上升。发生肿瘤的模型小鼠肝表面见有大小不等的灰白色结节,肿块增大、数量增多并相互融合。说明本实验所诱发的小鼠肝癌与人类肝癌相似,本模型可以模拟人类肝癌发生、发展的基本过程[28]。

