基于数据库分析RASAL1和RASAL2在非小细胞肺癌中的表达及其临床意义
宋姗姗,陈 昊,张 强,王永芳,聂艳红*
(1.徐州医科大学附属连云港市第一人民医院,江苏 连云港 222061; 2.连云港市第二人民医院,江苏 连云港 222023)
肺癌的发病率和死亡率位于全球恶性肿瘤的第一位,其中非小细胞肺癌(non-small cell lung cancer, NSCLC) 占肺癌的85%,且多数患者在确诊时已处于晚期[1]。靶向治疗是NSCLC晚期患者的重要治疗手段,虽然目前的分子靶向治疗已使部分患者受益,但总体预后仍然较差,故寻找有效的分子靶标仍具有重要的临床意义。Ras蛋白激活类似物1(ras protein activator like 1,RASAL1)和大鼠肉瘤蛋白活化因子2(ras protein activator like 2,RASAL2)均属于RasGTP酶活化蛋白家族(GTPase-activating protein, RasGAP)中的GAP1家族的成员。RASAL1定位于人第12号染色体(12q24.13), 而RASAL2基因定位于人第1号染色体(1q25),编码的蛋白由1139个氨基酸组成。两者均具有GTP酶的活性,能水解GTP为GDP使Ras蛋白失活,从而参与肿瘤的发生发展及转移[2-3]。国内外已有RASAL1和RASAL2在多种肿瘤中的研究报道[3-7],但RASAL1和RASAL2在肺癌中的研究还较少。本文基于全球最大的癌基因芯片数据库Oncomine和生存相关的Kaplan-Meier Plotter数据库的大数据信息,综合分析RASAL1和RASAL2在NSCLC中的表达及与生存预后的关系,为后期实验及潜在的临床价值提供指导。
1 材料和方法
1.1 数据库来源和方法
利用Oncomine数据库(https://www.oncomine.org/)分析RASAL1和RASAL2在NSCLC中的表达差异。登录Oncomine数据库首页,设定条件:1)Gene:RASAL1/2; 2)Analysis Type: Cancer vs Normal Analysis。进一步分析RASAL1/2在NSCLC中的表达:① Cancer Type: Non-Small cell Lung carcinoma; ②Data Type: mRNA; ③临界值设定条件:Pvalue<1E-4,fold change>2,gene rank=top 10%; ④其他为数据库默认设定。最后勾选NSCLC相关研究进行compare的二次分析。
基于Kaplan-Meier Plotter数据库(http://kmplot.com/analysis/)分析RASAL1和RASAL2与NSCLC患者临床生存预后的关系。登录Kaplan-Meier Plotter数据库首页,选择肺癌页面(Lung cancer),设定条件: ①Gene:RASAL1/2; ②Split patients by: Auto select best cutoff; ③Survival: OS/PPS; ④Histology: adenocarcinoma/squamous cell carcinoma; ⑤勾选需要分析的分层指标;⑥其他为数据库默认设定。
1.2 统计学方法
采用SPSS 23.0软件进行统计学分析,检验均采用双侧检验,以P<0.05为差异有统计学意义。RASAL1和RASAL2在正常组织与NSCLC组织中的表达差异采用t检验。Kaplan-Meier模型分析RASAL1和RASAL2与NSCLC患者临床生存预后之间的关系。
2 结果
2.1 RASAL1和RASAL2在NSCLC与正常组织中的表达差异
Oncomine 数据库包含715个基因表达数据集和86733个样本数据,其中RASAL1基因有549个数据集,样本数据为72466个,RASAL2基因有641个数据集,样本数据为78639个。Oncomine数据库中,RASAL1基因有355项不同类型的研究结果,其中16项差异有统计学意义,4项表达增高,12项表达降低,RASAL1在肺癌中高表达;RASAL2基因有426项不同类型的研究结果,其中23项差异有统计学意义,表达增高的研究有13项,降低的有10项,RASAL2在肺癌中低表达。综合分析11项(见附件参考文献8-15)关于RASAL1在NSCLC组织与正常组织中表达的研究,发现RASAL1在NSCLC所有差异表达基因中的中位数排名是1614.0,P=2.38E-7,表明RASAL1在NSCLC中高表达(见图1)。对RASAL2在NSCLC组织与正常组织中表达的17项研究[8,11,14-15]分析发现,在NSCLC所有差异表达基因中RASAL2的中位数排名是1486.0,P=0.013,表明RASAL2在NSCLC中低表达(见图1)。另外,分析不同病理类型NSCLC组织中RASAL1和RASAL2的表达水平发现,RASAL1在NSCLC中均高表达,RASAL2均低表达(P<0.05,见表1,表2)。

注:A RASAL1在11项NSCLC过表达研究中的比较分析;B RASAL2在17项NSCLC低表达研究中的比较分析。颜色越深表示芯片中基因表达越高。图1 RASAL1和RASAL2在Oncomine数据库中NSCLC中的表达Note. A Comparison of RASAL1 across 11 analyses over-expression; B Comparison of RASAL2 across 17 analyses under-expression. The darker the color, the higher the gene expression in the chip.Figure 1 Expression of RASAL1 and RASAL2 in NSCLC in the Oncomine database.
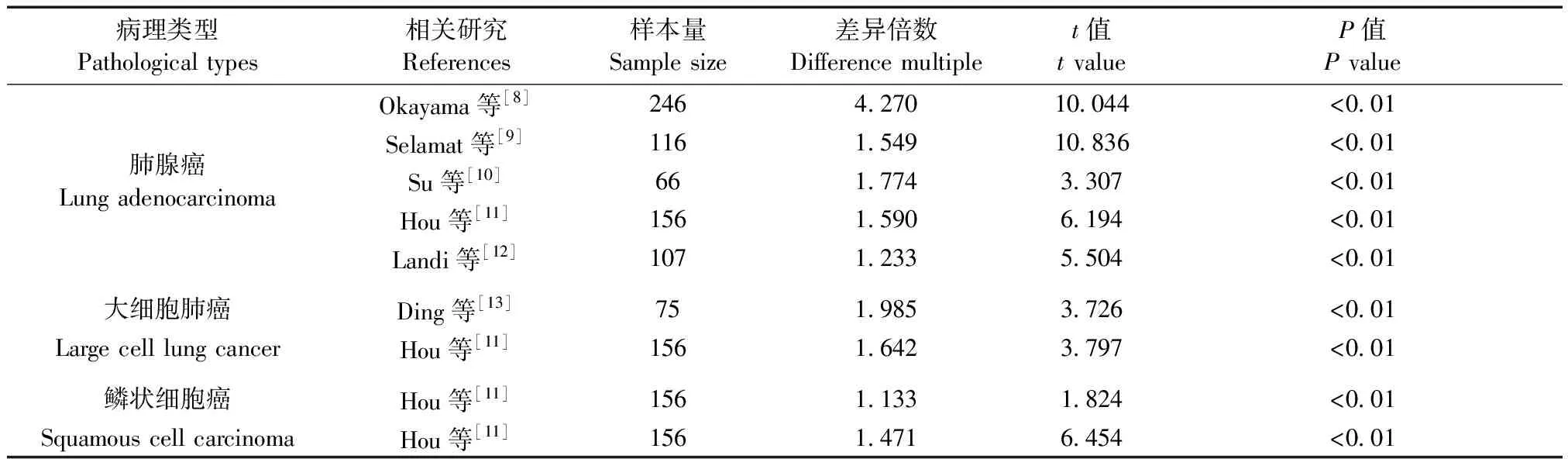
病理类型Pathological types 相关研究References样本量Sample size 差异倍数Difference multiplet值t valueP值P valueOkayama等[8]2464.27010.044<0.01Selamat等[9]1161.54910.836<0.01肺腺癌Lung adenocarcinomaSu等[10]661.7743.307<0.01Hou等[11]1561.5906.194<0.01Landi等[12]1071.2335.504<0.01大细胞肺癌Ding等[13]751.9853.726<0.01Large cell lung cancerHou等[11]1561.6423.797<0.01鳞状细胞癌Hou等[11]1561.1331.824<0.01Squamous cell carcinomaHou等[11]1561.4716.454<0.01
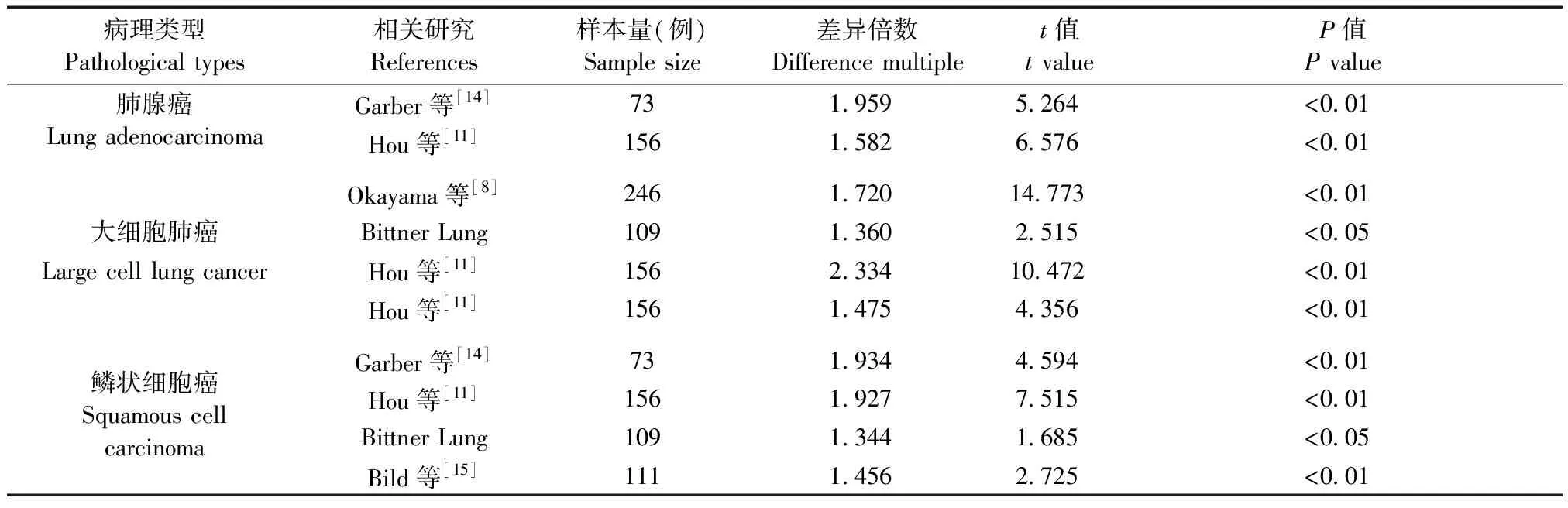
表2 不同病理类型的NSCLC组织与正常组织中RASAL2的表达差异
2.2 RASAL1和RASAL2与NSCLC患者临床预后的关系
Kaplan-Meier Plotter数据库中RASAL1在NSCLC中的研究样本为1926个,RASAL2的样本为1145个,结果显示RASAL1低表达组及RASAL2高表达组的NSCLC患者的生存预后较好。RASAL1低表达组和RASAL2高表达组患者的总生存时间(overall survival, OS)和复发后生存(post-progression survival, PPS)均显著增高(P<0.05,RASAL1的HR分别为1.35、1.39,95% CI分别为1.19~1.54、1.05~1.83,RASAL2的HR分别为0.6、0.56,95% CI分别为0.49~0.72、0.35~0.88)。进一步亚型分析,低表达RASAL1的肺鳞状细胞癌和肺腺癌患者及高表达RASAL2的肺腺癌患者的生存时间均显著长于高表达组(HR分别为1.35、1.73、0.52,95% CI分别为1.03~1.78、1.34~2.23、0.4~0.67),而RASAL2的表达与肺鳞状细胞癌患者的生存预后无相关性。(图2)。低表达的RASAL1与接受放化疗的NSCLC患者的良好生存预后相关(样本量分别为73、178,HR分别为2.12、1.59,95%CI为1.23~3.68、1.05~2.40),与未接受放化疗的患者的生存预后无关。而在RASAL2与NSCLC患者预后关系的研究中,接受放化疗的研究的样本例数较少,无法统计。此外,低表达的RASAL1和高表达的RASAL2与早期患者(I期和II期)的良好预后相关,在男、女及吸烟、不吸烟的患者中均与预后相关。而与分级和晚期(III期和IV期)患者的生存预后差异无统计学意义。

注:A~C: RASAL1在NSCLC、肺鳞状细胞癌、肺腺癌中;D~F: RASAL2在NSCLC、肺鳞状细胞癌、肺腺癌中。图2 RASAL1和RASAL2与NSCLC患者预后的关系Note. A-C: RASAL1 in NSCLC, lung squamous cell carcinoma, lung adenocarcinoma. D-F: RASAL2 in NSCLC, squamous cell carcinoma, and lung adenocarcinoma.Figure 2 Relationship between RASAL1 and RASAL2 expressions and prognosis in patients with NSCLC
3 讨论
NSCLC是肺癌最常见的病理类型,包括腺癌、大细胞癌和鳞状细胞癌,但确诊时多已错失手术治疗时间,故预后相对较差[16-17]。近年来,随着生物标志物的不断发现,靶向药物的临床应用,患者的生存预后有所改善[18-19]。但肺癌的高发病率及死亡率仍持续增长,故亟需寻找新的生物标志物以提高诊断、治疗及预后评估[20]。
Ras是最早发现的人类癌基因,其失调与肿瘤的发生发展密切相关。RASAL1和RASAL2作为Ras的调节基因,也与肿瘤的形成密切相关[21-22]。在胃癌中,Chen等[3]发现低表达的RASAL1能促进胃癌细胞的增殖、侵袭和迁移,显示了RASAL1的抑癌作用。Liu等[23]研究发现,上调甲状腺癌中的RASAL1同样能抑制癌细胞的生长、迁移和侵袭。此外,在肝癌[6]、结直肠癌[24]等多种肿瘤中的研究均显示RASAL1表达降低,从而促使肿瘤的发生,且低表达的RASAL1与不良预后相关。但尚未见RASAL1与NSCLC的相关报道。RASAL2在肿瘤中的研究尚存争议,Hui等[5]发现,RASAL2在膀胱癌中抑制肿瘤的发生,但在肝癌中,RASAL2上调促进肿瘤细胞的增殖和转移[25]。即使在同一种肿瘤或同一种肿瘤的不同分型中,RASAL2的研究结果也不同。在结直肠癌中,Jia等[4]研究表明,下调RASAL2能促进结直肠癌细胞的增殖,上皮-间质转化和转移,而Pan等[26]发现,RASAL2在结直肠的原发肿瘤及转移癌中表达增加,且高表达的RASAL2与患者的不良预后相关。在乳腺癌中,伴随RASAL2的失活,LuminalB型乳腺癌发生侵袭和转移[27],但过表达的RASAL2对三阴性乳腺癌起促侵袭和转移的作用[28]。目前,关于RASAL2在肺癌中的研究,仅报道了其对肺腺癌的抑制作用[29]。鉴于此,我们通过生物数据库分析RASAL1和RASAL2在NSCLC中的表达差异及与患者临床生存预后的关系,为进一步研究RASAL1和RASAL2在NSCLC中的作用提供参考和理论依据。
利用Oncomine数据库检索RASAL1基因发现:共12项研究,包括脑、食管和头颈部等多部位的肿瘤,显示RASAL1低表达;共4项研究,包括结直肠癌、卵巢癌及肺癌组织,显示RASAL1高表达。RASAL1在NSCLC组织中的研究共11项,对其二次分析发现,RASAL1在NSCLC中的表达较正常组织增加。RASAL1在肺癌中的表达与已报道的在其他肿瘤中的表达结果相反,可能是由于组织特异性导致的,这与数据库中分析的RASAL1在不同部位肿瘤中的表达不同相符,也可能是样本量小导致的误差,具体原因及机制还有待于大量实验验证。RASAL2基因的数据集有641个,样本数为78639个,有统计学差异的研究有23项。23项研究中,包括结直肠癌、食管癌、肾脏肿瘤及肺癌等多部位共10项研究显示RASAL2表达降低,在乳腺癌、结直肠癌及胃癌等多部位共13项研究显示RASAL2表达增加。RASAL2在结直肠癌中的文献报道既有高表达的也有低表达的,这与数据库的结果符合,猜测RASAL2的表达差异可能与肿瘤亚型相关。对17项关于NSCLC组织和正常组织中RASAL2的研究深入分析发现,RASAL2在NSCLC中表达降低,这与Li等[29]的研究结果一致。综上,我们得出RASAL1和RASAL2的表达在不同肿瘤中存在差异,在同一肿瘤中可能还与肿瘤亚型相关;在NSCLC中,RASAL1表达增加,RASAL2表达降低。Kaplan-Meier Plotter数据库分析表明,低表达的RASAL1和高表达的RASAL2与NSCLC患者的良好预后相关,结合RASAL1和RASAL2在NSCLC中的表达水平,猜测RASAL1可能在NSCLC中起促进癌发生的作用,而RASAL2可能作为抑癌基因而存在。进一步分析,RASAL1在鳞癌和腺癌中均与患者预后相关,RASAL1的表达可能不与NSCLC的病理类型相关;RASAL2只在腺癌中与患者生存预后相关,RASAL2可能与NSCLC的病理类型相关,亦或样本量小(271个样本)引起的实验误差。此外,低表达的RASAL1与接受放化疗的NSCLC患者的良好预后相关(RASAL2样本量小无法分析),表明RASAL1可能是潜在的治疗靶点;RASAL1和RASAL2在早期患者中的表达与生存预后相关,表明其可能在疾病的早期发挥作用,但仍需大量的研究来验证。
总之,在NSCLC中,RASAL1高表达,RASAL2低表达,且低表达的RASAL1和高表达的RASAL2与早期患者良好的临床预后相关,故猜测RASAL1在NSCLC的早期形成中可能起促进作用,RASAL2起抑制作用。RASAL1对NSCLC患者预后的影响还与放化疗相关,其可能是改善辅助治疗的重要靶点。RASAL1和RASAL2可能是NSCLC诊断、治疗及预后评估的潜在生物标志物,但限于数据库的研究范围及样本量,上述猜测还有待于进一步的研究。

