犬腺病毒I 型和II 型TaqMan 双重荧光定量PCR 方法的建立
巨敏莹,王艳杰,刘东霞,张 斌,韩 宇,乌吉斯古楞,宋庆庆,关平原
(1.内蒙古农业大学兽医学院,内蒙古呼和浩特 010018;2.金宇保灵生物药品有限公司,兽用疫苗国家工程实验室,内蒙古呼和浩特 010020)
犬腺病毒(canine adenovirus,CAV)又称犬传染性肝炎病毒,其基因组为双股DNA。犬腺病毒病是对包括犬在内多种哺乳动物的一种致病性强、感染范围广、高度接触性传染病[1-2]。CAV 有两个血清型:CAV-I 型和CAV-II 型。CAV-I 型是传染性犬肝炎的病原体,引起的特征性病症为肝小叶坏死、肝实质和内皮细胞核包涵体[3-4],以急性坏死性肝炎为特征,恢复期病犬角膜由浑浊逐渐变为蓝白色,因此又称犬的“蓝眼病”[5]。CAV-II 型是传染性气管支气管炎的病因之一,可引起犬轻度急性上呼吸道疾病,患病率很高[6]。在感染细胞的核内,CAV-II 排列紧密,呈典型的结晶状;而CAV-I排列相对疏松,有时也能呈现紧凑排列,但其所形成的结晶不如CAV-II 明显[7]。
CAV-I 和CAV-II 型的共感染频率较高,在同一份病料中经常可检测到两种CAV 病毒。但因两种病毒之间存在交叉反应,导致血清学方法在诊断中的应用有限[8],因此需要建立一种特异性强、敏感性高的CAV-I 型和CAV-II 型鉴别检测方法。本试验建立了用于鉴别检测CAV-I 和CAV-II 的TaqMan 双重荧光定量PCR。该方法操作简便、特异性强、敏感性高、重复性好。
1 材料与方法
1.1 样品来源和主要试剂
CAV-I 型、CAV-II 型病毒以及犬瘟热病毒(CDV)、犬副流感病毒(CPIV)、犬细小病毒(CPV)、犬冠状病毒(CCV),均由金宇保灵生物药品有限公司兽用疫苗国家工程实验室提供。
Axyprep 体液病毒DNA/RNA 提取试剂盒,购 于AxyGen 公 司;AceQ®QPCR Probe Master Mix 试剂(批号L/N7E241E8),购于Vazyme 公司;E.COLI JM109 感受态细胞、SOC Medium、MiniBEST Agarose GelDNA Extration Kit Ver 4.0(批号AI10973A),购自Takara 公司;TOPO TA Clong® kit for sequencing PCR®4-TOPO® vector,购 自invitrogen 公 司;Scientific Gene JET Plasmid Miniprep kit ck0502(批 号00532991),购 自Thermo 公司。
1.2 引物和探针设计
依据GenBank 中已登录的CAV I 型和II 型基因序列(CAV-I 型GenBank 号KP840549.1,CAVII 型GenBank 号EU717145.1),利用DNAstar 软件中的MegAlign 模块进行序列分析并设计引物,设计1 对符合两种病毒的通用引物,以及2 条标记不同发光基团能够区分两种基因型的探针(表1)。引物探针由上海生工有限公司合成。

表1 CAV-I 和CAV-II TaqMan 双重荧光定量PCR 引物和探针
1.3 病毒核酸提取
参照Axyprep 体液病毒DNA/RNA 提取试剂盒说明书,提取CAV-I、CAV-II、CDV、CPIV、CPV、CCV 的病毒DNA 或RNA,将提取的核酸样品置于-20 ℃冰箱保存待用。
1.4 质粒标准品制备
分别以CAV-I 和CAV-II 型病毒为模板,参照如下反应体系(表2,总体积25 μL)和循环条件(表3)进行PCR 扩增,以获得目的片段。将PCR 目的片段胶回收纯化克隆至TOPO 载体中,重组质粒转化至E.coliJM109 感受态细胞,经菌液鉴定和测序,筛选阳性克隆,扩大培养后提取质粒;将提取的质粒用Qubit 3.0 进行质粒浓度测定,并根据拷贝数计算公式计算拷贝数,然后进行10 倍梯度稀释,获得8 个梯度标准品(108~101copies/μL)。CAV-I 型 和CAV-II 型 各个梯度标准品按照1:1 比例混匀,制备CAV-I 和CAV-II 混合标准品。

表2 CAV-I 和CAV-II 标准品制备PCR 反应体系

表3 CAV-I 和CAV-II 标准品制备PCR 反应程序
1.5 方法建立及条件优化
采用25 μL 反应体系,利用方阵法,对CAV-I 型和CAV-II 型TaqMan 双重荧光定量PCR方法的引物浓度(100~500 nm),探针浓度(100~500 nm),模板加入量(1~5 μL)、退火温度(52、54、56、58、60 ℃)等进行优化,以获得最佳反应体系和循环条件。
1.6 标准曲线建立及敏感性试验
将CAV-I 和CAV-II 混匀重组质粒标准品(108~101copies/μL),采用本研究建立的TaqMan双重荧光定量PCR 方法进行扩增,通过Bio-Rad CFX 96 荧光定量PCR 仪及软件生成标准曲线,并对该方法进行敏感度检测。
1.7 特异性试验
采用建立的TaqMan 双重荧光定量PCR 方法,对CAV-I、CAV-II、CDV、CPIV、CPV、CCV 等病毒核酸进行检测,同时设立阴性对照,判定该方法的特异性。
1.8 重复性试验
3 人配3 组体系,采用本研究建立的TaqMan双重荧光定量PCR 方法进行PCR 扩增,计算组内和组间变异系数,分析方法的重复性。
1.9 临床样品检测
将收集的41 份通过人工攻毒取得犬组织和拭子样品进行基因组DNA/RNA 提取,以待检样品为模板,采用建立的TaqMan 双重荧光定量PCR 检测方法和普通PCR 检测方法进行样品检测,并对检测结果进行符合率分析。
2 结果
2.1 质粒标准品制备
以CAV-I 和CAV-II DNA 为模板,利用设计好的引物对其进行扩增,获得预期大小的目的片段。目的片段进行切胶回收纯化后克隆于TOPO 载体,构建的CAV-I 重组质粒浓度为76.5 ng/μL(1.7×1010copies/μL),CAV-II重组质粒浓度为66 ng/μL(1.4×1010copies/μL)。以I 型和II 型稀释后的等比例体积混合模板作为双重荧光定量PCR 的标准品模板。
2.2 反应体系和条件优化
优化后的反应体系如表4 所示(总体积25 μL),循环条件如表5 所示。
2.3 标准曲线建立
采用已建立的CAV-I 和CAV-IITaqMan 双重荧光定量PCR 的反应体系和循环条件进行荧光定量PCR 检测。结果(图1 和图2)显示:CAV-I 和CAV-II 相关系数分别为0.998 和0.999,效率分别为101.2 和100.0,均在 90%~110%之间,具有良好的线性关系;CAV-I 和CAV-II 的回归方程分别为y=-3.293x+42.809 和y=-3.321x+41.490。因此,可以根据所检测临床样品的Cq 值,并参照标准曲线对临床样品进行检测。
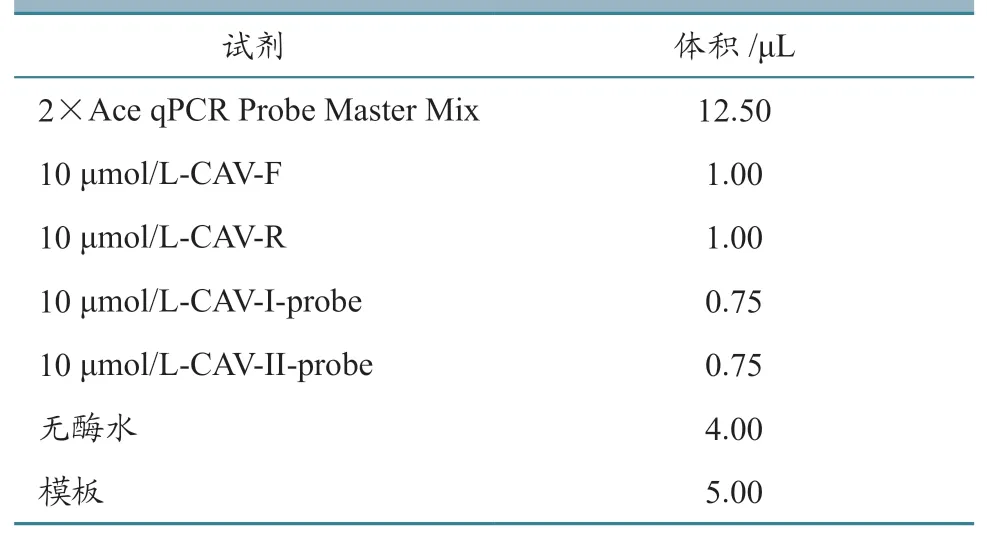
表4 反应体系优化结果
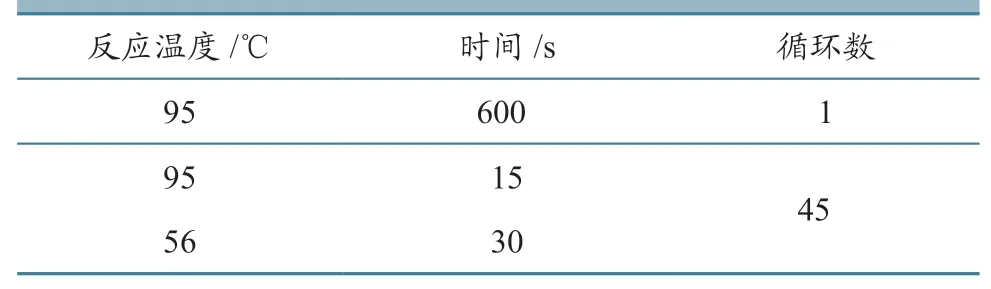
表5 循环条件优化结果
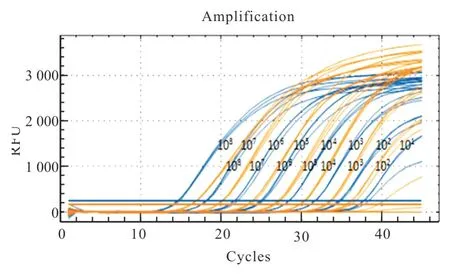
图1 CAV-I 和CAV-II TaqMan 双重荧光定量PCR 曲线
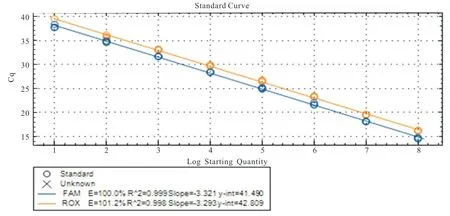
图2 CAV-I 和CAV-II TaqMan 双重荧光定量PCR 法标准曲线
2.4 敏感性试验
采用已建立的CAV-I 和CAV-IITaqMan 双重荧光定量PCR 的反应体系和循环条件进行灵敏度验证,发现CAV-I 和CAV-II 最小检测量分别为100 copies/μL 和10 copies/μL(图3),表明所建立方法的敏感性高。
2.5 特异性试验
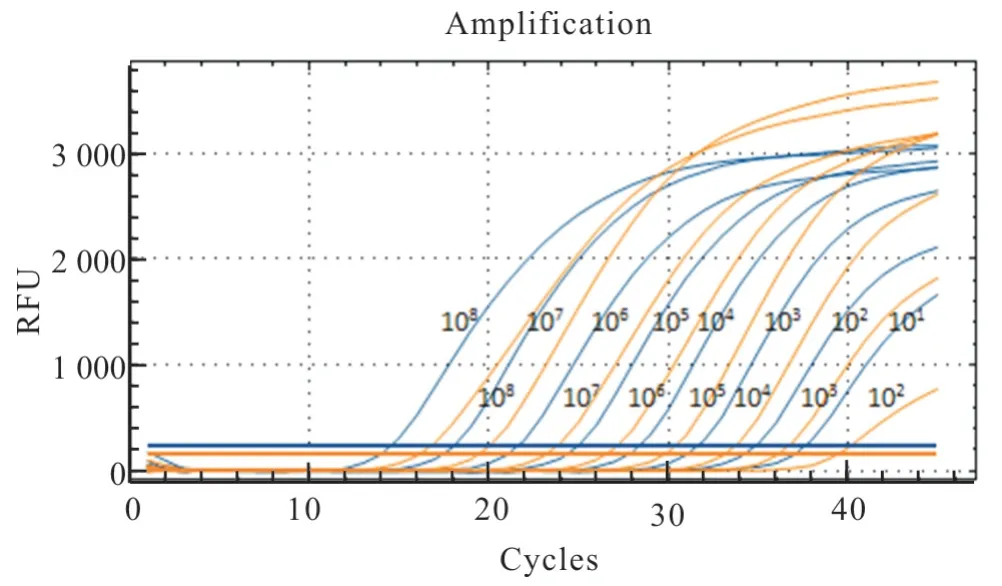
图3 CAV-I 和CAV-II TaqMan 双重荧光定量PCR 探针敏感度检测结果曲线
采用已建立的CAV-I 和CAV-IITaqMan 双重荧光定量PCR 反应体系和循环条件进行相关病毒核酸检测,每个样品做2 个重复,并设立阴性对照和CAV I 和II 型阳性对照(每个样品2 个重复)。特异性结果显示,仅CAV-I 和CAV-II 核酸出现典型的“S”扩增曲线,且CT 值均小于35,而其他病毒核酸样品和阴性对照均没有出现扩增曲线(图4),表明所建立方法具有较好的特异性。
2.6 重复性试验
采用已建立的CAV-I 和CAV-IITaqMan 双重荧光定量PCR 反应体系和循环条件进行方法重复性验证,发现其组内和组间变异系数均小于5%(表6),表明该方法具有较好的重复性。
2.7 临床样品检测结果
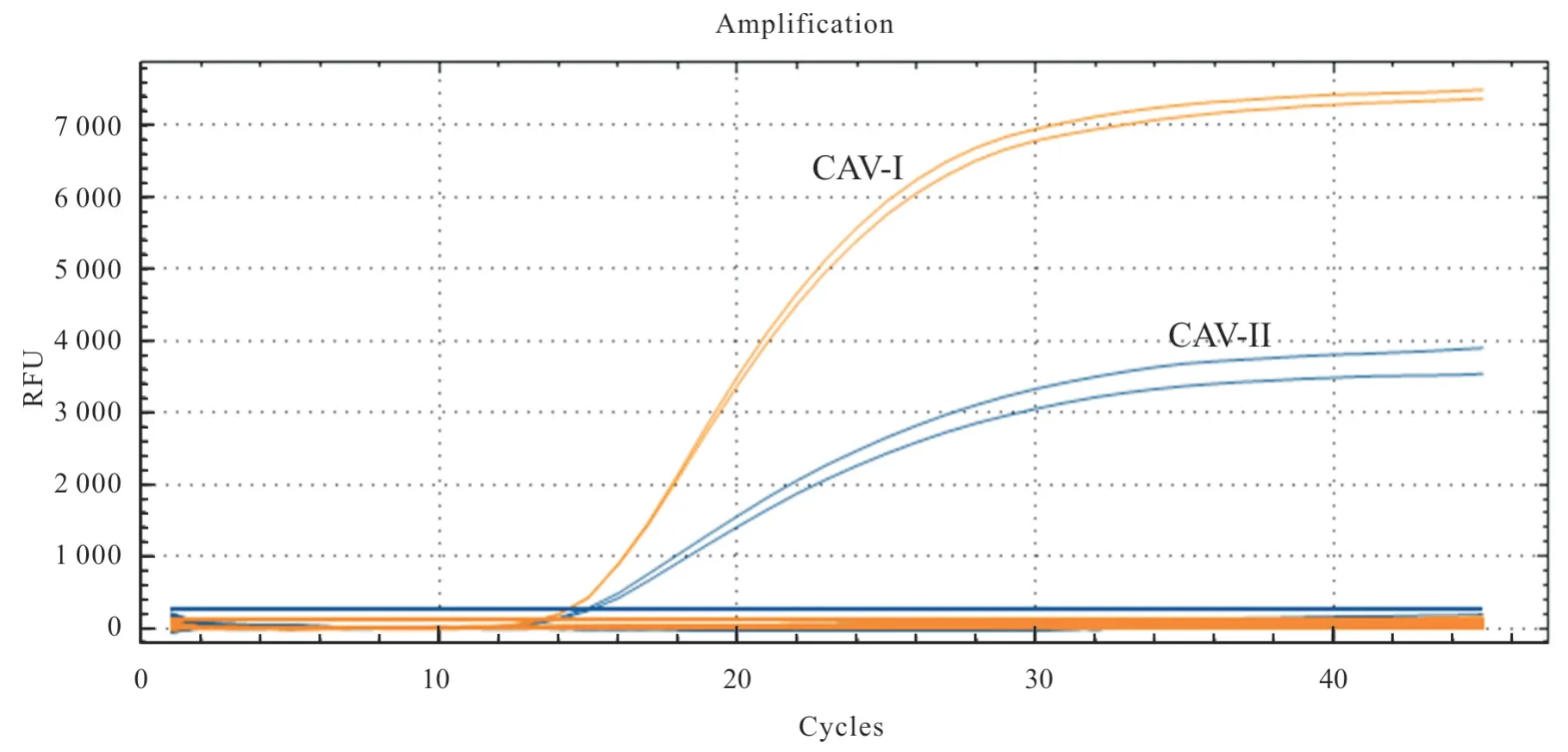
图4 CAV-I 和CAV-II TaqMan 双重荧光定量PCR 特异性检测结果

表6 重复性试验结果
采用已建立的CAV-I 和CAV-IITaqMan 双重荧光定量PCR 反应体系和循环条件,对从人工模型攻毒犬采集到的41 份样品进行检测,同时采用普通方法进行符合率分析。结果(表7)显示:普通方法检出25 份阳性,其中CAV-I 型19 份(阳性率46.3%),CAV-II 型 6 份(阳性率14.6%);本研究建立方法检出27 份阳性,其中CAV-I 型20 份(阳性率48.7 %),CAV-II 型7 份(阳性率17.1 %)。两种方法总符合率为95.12%。
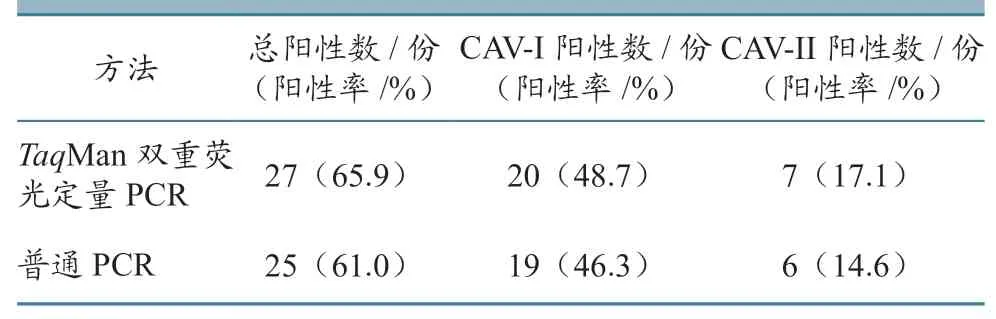
表7 两种方法检测结果比较
3 讨论
随着人们生活水平的提高,犬与人类的接触变得更加频繁和密切,因此犬健康也得到人们极大重视。CAV 除可感染犬和狐外,还可感染狼、黑熊、臭鼬、豚鼠、大熊猫、银狐、北银狐以及虎等[9-11]。普通人群中的CAV 感染抗体阳性率较高(35%),兽医人员更高(49%);人感染此病虽不表现症状,但存在隐性感染的风险[12]。病犬和带毒犬是本病主要的传染源,通常痊愈犬排毒期长达180~270 d。本病既可间接传播,也可垂直传播,给犬业发展以及其他动物养殖造成巨大损失。随着分子生物学发展,我国研究者已经对犬CAV-I 和CAV-II 病毒进行了分离鉴定,并且能够通过普通PCR 方法对该病毒进行检测,但本研究建立TaqMan 双重荧光定量PCR 方法可实现快速定量检测。
临床样本检测中,TaqMan 双重荧光定量PCR 方法检测结果准确,与已知病毒类型相符合,表明建立的TaqMan 双重荧光定量PCR 方法可靠性高。与薛向红等[13]建立的CAV-I 型SYBR Green 方法相比较,二重荧光定量方法能同时检测到CAV 的两种基因型,因而节省了检测时间;与Balboni Andrea 等[14]建 立 的CAV I 型 和II 型SYBR Green 实时荧光定量方法相比较,本试验建立方法更加直观具体。与普通PCR 方法相比较,本试验建立的TaqMan 双重荧光定量PCR 方法不仅省时、省力,而且可以同时快速区分I 型和II 型,这为CAV 感染的检测以及流行病学调查提供了便捷快速的方法。

