高等植物硫酸盐吸收与代谢的调控机制
刘祉辛 孙亿敬 李姣爱 上官燕 孙旭武

摘 要: 硫酸盐同化是原核生物、真菌和光合生物将无机硫酸盐转化为硫化物的途径,硫酸盐被进一步整合到氨基酸的碳骨架中形成半胱氨酸或同型半胱氨酸.硫酸盐是植物可利用的主要无机硫形式,其能被特定的硫酸盐转运蛋白吸收并转运到质体,特别是叶绿体中,被还原并同化为半胱氨酸.硫酸盐的代谢受需求驱动且被高度调控.然而,在不同生物中硫酸盐的代谢调控的分子机制是不同的.综述了高等植物硫酸盐吸收和代谢调控的分子机制,初步讨论了硫酸盐代谢调控的分子机制中存在的问题及其潜在的研究策略.
关键词: 高等植物; 硫酸盐; 吸收; 代谢; 调控
中图分类号: Q 756 文献标志码: A 文章编号: 10005137(2019)04046009
Abstract: Sulfate assimilation is a pathway used by prokaryotes,fungi and photosynthetic organisms to convert inorganic sulfate to sulfide,which is further incorporated into carbon skeletons of amino acids to form cysteine or homocysteine.Sulfate,the major form of inorganic sulfur utilized by plants,is absorbed and transported by specific sulfate transporters into plastids,especially chloroplasts,where it is reduced and assimilated into cysteine.The metabolic pathway is highly regulated in a demanddriven manner.However,this regulation is not necessarily identical in various biological groups.The molecular mechanisms of sulfate uptake and metabolism regulation in higher plants were reviewed here,the issues and potential research strategies on the molecular mechanisms of sulfate metabolism regulation were preliminarily discussed as well.
Key words: higher plant; sulfate; uptake; metabolism; regulation
0 引 言
硫在自然界中以不同的氧化態、无机、有机和生物有机形式存在.对于生物体,硫是许多功能所需的重要元素.它在氨基酸、多肽和蛋白质、铁硫簇、硫辛酸和其他辅因子中以还原形式存在,在磺酸基修饰蛋白质、多糖、脂质中以氧化形式存在.此外,还原的硫化合物如硫化氢可用作电子供体,用于大量不同类型的细菌和古菌,包括紫色和绿色硫细菌的化学营养或光自养生长.相比之下,氧化硫化合物如硫酸盐可作为呼吸中的末端电子受体发挥作用,以支持硫酸盐还原菌的生长.植物、酵母和大多数原核生物通过将无机硫酸盐还原成硫化物来满足其对还原硫的需求,然后将其结合到有机化合物中.硫对植物生长至关重要,硫在植物体内参与了许多生物过程,包括抗病性,2种含硫氨基酸的生物合成,对活性氧、异生素和重金属的解毒作用等[1-5].
1 植物硫代谢
高等植物硫酸盐代谢主要发生在质体,特别是叶绿体中[4].KOPRIVOVA等[6]结合生化和分子生物学方法已经揭示了腺苷5′磷酸硫酸还原酶是硫代谢途径的关键酶.结合转录组和代谢组的分析结果使人们认识到细胞受硫饥饿影响的过程,以及其在农业中产生的严重问题.此外,关于硫酸盐吸收和同化调控的分子机制的报道增进了人们对硫代谢途径的了解.这些新的发展得益于对模式植物拟南芥的研究.然而,越来越多的研究表明:并非所有与硫代谢有关的生物学问题都可以在拟南芥中得到解决,并且在拟南芥上获得的知识也并非都可以适用于其他物种.
硫酸盐通过硫酸盐转运子吸收并在整个细胞和植物中分布.植物和藻类中有多种具有不同性质和功能的硫酸盐转运蛋白[7](表1).典型的硫酸盐转运蛋白通常是有pH依赖性的H+/SO2-4的共转运蛋白,其含有10~12个跨膜螺旋,随后是sulfate transporter and antisigma antagonist(STAS)结构域[8].拟南芥具有12个硫酸盐转运蛋白基因,根据序列相似性和功能可以划分为5组.所有这些基因与最初鉴定的cDNA克隆highaffinity sulfate transporter 1(SHST1)具有显著的序列相似性[8].第1组编码高亲和力的硫酸盐转运蛋白负责吸收土壤溶液中的硫酸根进入根细胞[9].第2组编码低亲和力转运蛋白是植物体内硫酸盐移动转运所必需的,它们位于根和叶的木质部薄壁组织和韧皮部细胞中[10].第4组转运蛋白定位于液泡膜中并负责液泡中的硫酸盐流出[11].目前对第3和第5组的硫酸盐转运蛋白的功能所知甚少,有限的信息表明:sulfate transporters 3;5(SULTR3;5)提高了拟南芥中根-茎硫酸盐的易位速率[12].出人意料的是,第3组硫酸盐转运蛋白被发现参与了豆科结核固氮[13].虽然大部分硫酸盐代谢是发生在叶绿体中的,至今关于定位在叶绿体的硫酸盐转运子的报道却较少[4],CAO等[14]研究发现SULTR3;1位于叶绿体中,通过SULTR3;1GFP定位分析、蛋白质印迹分析、蛋白质输入以及比较分析敲除突变体,对基因互补的转基因植物和野生型植物叶绿体中硫酸盐吸收的分析表明:SULTR3;1的突变体的叶绿体中硫酸盐的摄取率显著降低了.通过在sultr3;1突变体中过表达野生型SULTR3;1蛋白进一步证实了SULTR3;1是负责转运硫酸盐到叶绿体中的转运蛋白之一.
细胞内的硫酸盐进一步代谢成各种初级和次级代谢产物.为了同化为半胱氨酸,硫酸盐必须被运输到质体中并在三磷酸腺苷(ATP)硫酸化酶(ATP sulfurylase,ATPS)催化的反应中通过腺苷酸化成腺苷5′磷酸硫酸(adenosine 5′phosphosulfate,APS).APS被APS还原酶(APS reductase,APR)还原成亚硫酸盐.亚铁硫化物被铁氧还蛋白依赖性亚硫酸还原酶(sulfite reductase,SiR)进一步还原为硫化物,其通过O-乙酰丝氨酸(巯基)裂合酶(Oacetylserine (thiol)lyase,OASTL)掺入到O-乙酰丝氨酸(Oacetylserine,OAS)的氨基酸骨架中以形成半胱氨酸.OAS是通过丝氨酸乙酰转移酶(serine acetyltransferase,SAT)催化乙酰辅酶A来乙酰化丝氨酸而合成的[1].SAT和OASTL形成半胱氨酸合酶的多酶复合物[15].半胱氨酸可以直接掺入蛋白质或肽中,例如谷胱甘肽(glutathione,GSH).GSH是最丰富的低分子量巯基,在植物胁迫防御、氧化还原调节,硫储存和运输中扮演了重要的角色.此外,半胱氨酸也可以被进一步代谢并作为硫的还原供体用于合成甲硫氨酸、铁硫中心、各种辅酶和次级代谢产物.硫酸盐同化途径的一个中间体亚硫酸盐可以被代谢成为叶绿体膜的主要组分——硫脂[16].虽然硫酸盐的还原仅发生在质体中,半胱氨酸则可以在所有3个能够进行蛋白质合成的区域(质体、线粒体和胞质溶胶)中合成[1](图1).
然而,硫也存在于氧化态的植物代谢物中,作为磺基来修饰碳水化合物、蛋白质和许多天然产物.很大一部分已知的硫酸化代谢物在生物防御和非生物胁迫的植物防御中发挥着重要的作用.其中一个很好的例子是芥子油苷,它参与了防御草食动物和病原体[17],也影响着十字花科蔬菜的味道和风味,其部分降解产物异硫氰酸酯具有抗癌活性[18].另一大类硫酸化合物是硫酸化黄酮类化合物[19],用于对活性氧的解毒和对植物生长的调节[20].硫酸化合物可以直接参与植物对病原体的防御,如茉莉酸(jasmonic acid,JA)的硫酸化衍生物[21]或硫酸化β1,3葡聚糖[22].磺基(即硫酸化)的转移由磺基转移酶(sulfotransferases,SOT)催化[23].SOT反应需要3′磷酸腺苷5′磷酸硫酸酯(3′phosphoadenosyl 5′phosphosulfate,PAPS)作为硫酸盐供体,具有游离羟基的化合物作为受体.由于硫酸盐基团的生物受体的结构多样性,在高等真核生物中发现了多种同种型的SOT[23].PAPS由APS激酶磷酸化APS合成.因此APS可以从质体中的初级硫酸盐同化途径中撤出.此外,在细胞溶质中似乎有一条硫酸化PAPS合成途径,因为在质体和细胞质中均存在ATPS和APS激酶活性,而APR和SiR是严格限制在质体中的[1].
ATPS由多基因家族编码,其活性在植物的细胞质和叶绿体中均可以被检测到.在细胞溶质和质体中都可以找到APS激酶(APS kinase,APK)[1].然而由APR催化的APS的还原仅在质体中发生[24].质体和细胞质中的ATPS活性以不同方式为下游通路提供APS,并且它们的作用可以根据亚细胞定位而变化.在拟南芥基因组中存在4个ATPS基因(ATPS1,-2,-3和-4)[25].4种ATPS的蛋白质编码区全部具有N末端前导序列,其具有质体靶向转运肽的特征,随后是ATPS催化结构域.尽管在所有4种ATPS中都存在转运肽,但在拟南芥叶片的叶绿体和细胞质中均可检测到ATPS活性[24].尽管基于预测替代性翻译起始分析表明:ATPS2可编码2种同种型(即质体和胞质定位)的ATPS[26],其胞质ATPS的身份仍然存有争议[25].最近BOHRER等[27]研究发现:ATPS2可以被翻译成2种不同的异构体,这2种异构体在拟南芥中可以双重定位于质体和细胞质中.
2 植物硫代谢的生化调控机理
硫酸盐同化作用受复杂的信号网络调控.最重要的信号分子是半胱氨酸前体(OAS).OAS是半胱氨酸合成的限制性因素,可以诱导APR活性和Lemna minor硫醇的合成速率.在拟南芥中,OAS可以诱导所有参与硫酸盐同化基因的mRNA积累,并能显著增加硫酸盐同化的水平[6].OAS也能对半胱氨酸合成酶复合物造成强烈影响,OAS浓度的增加会导致复合物解离和SAT失活.由于OAS会在缺硫期间积累,并且会对半胱氨酸合酶和硫酸盐同化基因的表达产生影响,其被认为是植物硫状态的介质[15].转录组分析进一步暗示OAS可以作为调节因子影响基因的表达[28].此外,代谢物与基因网络的分析揭示了几个硫酸盐同化基因如ATPS3,APR2和APR3,SULTR1;1,SULTR1;2和SULTR2;1的表达与OAS水平密切相关[29].相反,由硫缺陷调控的其他基因如SiR,APS激酶或第3组硫酸盐转运蛋白的转录水平与OAS无关,表明OAS不是硫缺陷的唯一传感器[29].由此可见,OAS是调节植物硫稳态的重要参与者,但其确切的分子功能和调节途径的其他组成部分尚未明确.此外,研究发现当减少硫化氢、半胱氨酸或谷胱甘肽时也会引发硫酸盐吸收和同化活性的强烈下降.在拟南芥根培养物中,通过补充半胱氨酸或GSH可降低APR活性和转录水平[30].通过L-丁硫氨酸(一种γ-ECS的抑制劑)阻断GSH合成减轻了对APR的阻遏,表明GSH有可能为信号分子[30].
最近的研究结果显示:植物激素对硫营养的调节非常重要[31].OHKAMA等[31]的研究表明玉米素处理可以导致APR和低亲和性硫酸盐转运蛋白mRNA的加速积累.相反,细胞分裂素会抑制拟南芥根系的高亲和力硫酸盐转运蛋白的表达和硫酸盐的吸收能力.生长素(indole3acetic acid,IAA)也可能参与了硫吸收的调节,缺硫会诱导参与IAA合成的NIT3腈水解酶基因的表达.从拟南芥SULTR1;2启动子中鉴定出的负责硫饥饿反应的顺式作用元件含有生长素应答因子(auxin response factor,ARF)结合序列.虽然JA不影响硫响应启动子元件的表达[31],但其可能参与对硫酸盐同化的调节.使用甲基茉莉酮酸酯处理拟南芥会导致参与硫酸盐同化和GSH合成的许多基因的mRNA水平快速但短暂的增加,但并不影响硫代谢物水平.虽然硫饥饿能诱导JA生物合成的基因表达,但是JA并不参与调控硫营养[28].JA诱导硫酸盐同化可能有其更重要的意义,因为JA参与的胁迫信号途径和含硫化合物在植物胁迫防御中都发挥了重要作用.有趣的是,经脱落酸(abscisic acid,ABA)和水杨酸(salicylic acid,SA)处理的植物中的GSH水平有所增加.ABA在对环境胁迫的适应性反应中发挥着重要作用,并导致活性氧增加.因此不清楚GSH合成是由ABA自身调节还是由ABA处理产生的氧化胁迫所调节的.由于ABA诱导胞质OASTL的mRNA积累[32],暗示ABA可能对硫代谢的控制具有更深远的作用.SA在防御病原体的植物防御中起核心作用.用SA处理烟叶以及用烟草花叶病毒感染,能在接种处而非在全叶片中诱导GSH含量的增加[33].另外,用生物活性SA类似物2,6-二氯异烟酸进行处理也可增加GSH的水平[34].
3 硫代谢的转录调控
目前人们对于硫酸盐同化调控的分子机制知之甚少.除了SERAT3,1,ATPS4和APK2[35]之外,sulfur limitation1 (SLIM1)也是调节硫酸盐转运蛋白对硫饥饿反应的因子之一,但其似乎不影响硫酸盐同化基因的表达.然而,ATPS4转录可能间接受SLIM1的调控.ATPS4是miR395的靶基因,SLIM1可依赖性地诱导miR395.另一方面,在Col0和slim1突变体[35]中,所有3种APR同种型基因的mRNA都被硫饥饿强烈地上调了.硫饥饿会影响许多轉录因子的表达水平,尽管这些转录因子的表达的改变会导致硫醇水平的变化,但这些因子并不直接调节硫醇的代谢反应[36].
不同于对硫酸盐的同化过程的调控,细胞内含硫化合物硫代葡萄糖苷的生物合成受复杂的转录因子网络的调控[37].目前研究最多的转录因子属于R2R3MYB家族的2个组[37]:第1组特异性地参与脂肪族硫代葡萄糖苷合成的控制,包括MYB28,MYB76和MYB29[37];第2组包括MYB51,MY122和MYB34,影响吲哚硫代葡萄糖苷的合成[38].通过基因过表达,RNAi或TDNA插入等措施改变这些转录因子的表达,引起硫代葡萄糖苷生物合成基因的转录水平以及硫代葡萄糖苷水平的改变[37].除了MYB因子之外,硫代葡萄糖苷合成也受草食动物和茉莉酸甲酯诱导的转录因子OBP2[39]和钙调蛋白结合蛋白IQDOMAIN 1(IQD1)的调控.响应硫限制的信号途径,包括MYB因子表达等都受SLIM1的调节[35].APS激酶表达水平的降低会导致硫代葡萄糖苷水平的降低和硫代葡萄糖苷生物合成基因的上调,表明可能可以通过这些MYB因子共同调节初级硫酸盐同化基因的表达.
4 硫代谢的转录后调控
有关APR和ATPS调节的大量研究表明它们在mRNA水平、蛋白质积累和酶活性之间存在良好的相关性[6],其调控主要发生在转录水平上.另一方面,尽管在转录水平上也发生了调节,SAT和OASTL的半胱氨酸合成及活性受半胱氨酸合成酶多酶复合物中蛋白质-蛋白质相互作用的调节更强烈.SAT通过与OASTL相关联而被强烈地激活,然而,OASTL仅在复合体中具有调节作用.两种酶的相互作用受OAS浓度的强烈影响,OAS导致复合物的解离,而硫化物则以相反的方式起作用并强化结合.然而,SAT也受到半胱氨酸的反馈抑制.有趣的是,单个SAT亚型对半胱氨酸的敏感性显著不同.例如,在拟南芥中,胞质中的SAT受半胱氨酸的抑制,而在豌豆中SAT是质体形式的[40].
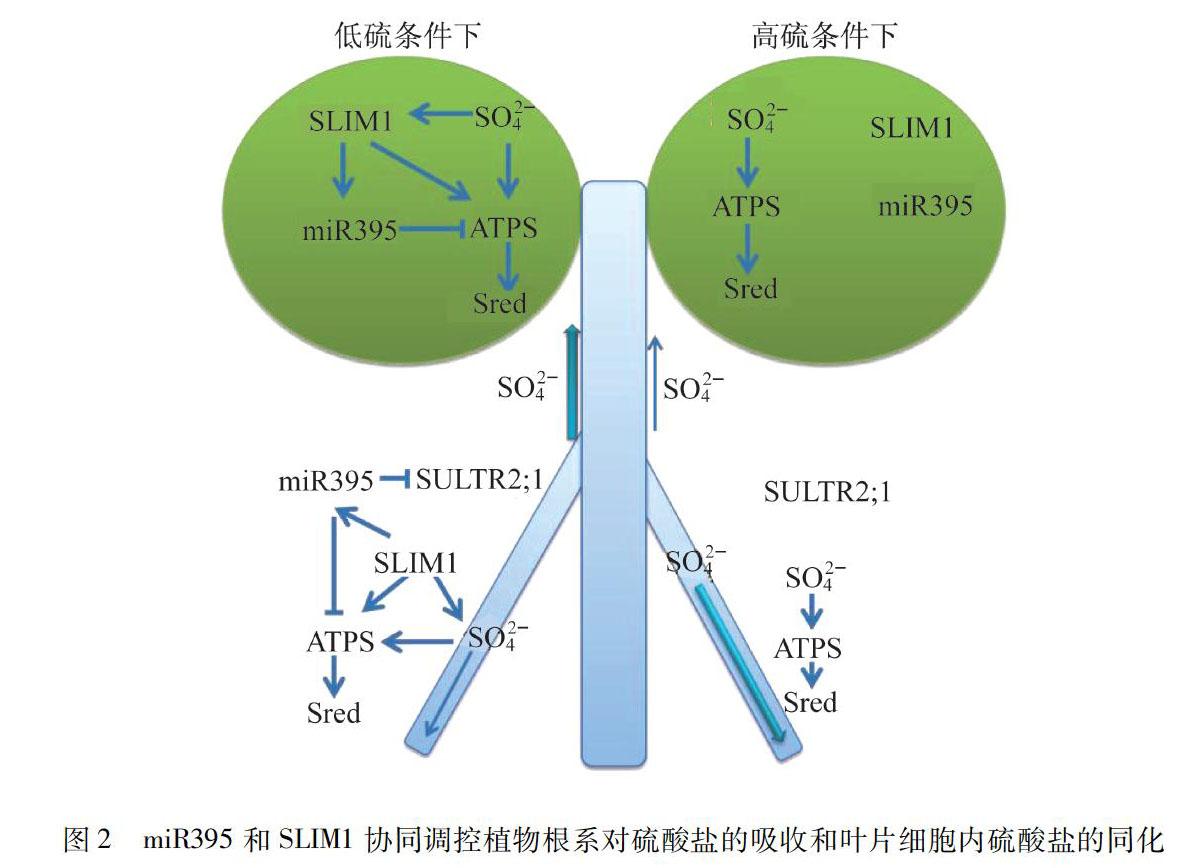
拟南芥基因组分析表明:硫酸盐同化的两个组分,低亲和力硫酸盐转运蛋白SULTR2;1和ATPS是miR395[41]的靶基因,编码同种型ATPS的ATPS1和ATPS4,以及SULTR2;1的mRNA可以被miR395所降解[41].硫酸盐饥饿强烈诱导miR395的积累.响应硫酸盐饥饿,在甘蓝型油菜植物的韧皮部发现了更高水平的miR395[42].最近,对全部6个miR395基因及其靶标的系统分析揭示ATPS1,ATPS4和SULTR2;1是叶子和根部中的miRNA的靶标,而在叶子中约50%的ATPS3被降解[43].miR395d和miR395f在高硫酸盐和低硫酸盐条件下表达都非常弱,但其他4个miR395家族成员的表达强烈地受硫酸盐缺陷所诱导.miR395a和miR395b在缺硫酸盐的情况下在根中表达量最高,而miR395c和miR395e在缺硫酸盐培养基[43]中生长的幼苗的根和叶中均强烈上调.硫酸盐饥饿通过SLIM1诱导miR395的积累[43].在硫饥饿植物的根中,尽管miR395的积累水平增加了,SULTR2;1的转录水平实际上也增加了.对比分析miR395和SULTR2;1的组织特异性表达表明miR395的作用可能是将SULTR2;1限制在木质部细胞中[43].LIANG等[44]的研究表明:miR395负责叶片中硫酸盐的积累,以及从老叶向幼叶的转运,并且表明SULTR2;1,ATPS1和ATPS4在这一过程中扮演了关键的角色.然而,关于miR395调控对ATPS的影响,对其酶活性和下游整个硫酸盐同化的影响,特别是流经途径的通量的了解甚少.尽管对细胞质中ATPS异构体的研究还很少,但是这一点是很重要的,因为ATPS可以定位于质体和胞质中[45].响应硫酸盐饥饿,虽然miR395靶基因ATPS4的mRNA水平强烈地下调了,但是总的ATPS活性仅受到了中等影响.miR395与SLIM1转录因子一起维持ATP硫酸化酶转录的最佳水平,以使硫酸盐缺陷植物中通过硫酸盐同化途径的通量增加.ATPS单独表达影响硫酸盐的易位和通量.SULTR2;1在硫酸盐转运至芽的过程中发挥着重要作用.因此,miR395是控制植物硫酸盐同化作用的调节通路的一个组成部分,具有复杂的作用机制[45].进一步分析基因表达水平和不同组织中的硫酸盐代谢活性发现:miR395和SLIM1对硫酸盐的吸收和代谢的调控依赖于叶片中硫的状态.当叶片中发生硫饥饿时,低硫信号诱导SLIM1,miR395和ATPS的表达,进而减少了叶片细胞内硫酸盐的还原同化.在根部,SULTR2;1参与调节硫酸盐向木质部薄壁细胞的迁移,miR395抑制SULTR2;1的水平,使得更多的硫酸盐转移到叶片,同时抑制了硫酸盐在根部组织中的还原.相反,当叶片中硫酸盐过高时将抑制miR395与SLIM1的表达,此时更多的硫酸盐被高水平的ATPS所还原同化.在根部,较高水平的SULTR2;1促使更多的硫酸盐向根的木质部薄壁细胞迁移,同时更多的硫酸盐在根部被ATPS所还原[45](图2).
由图2可知,植物在正常硫酸盐(SO2-4)供应下,SLIM1和miR395维持ATPS1和ATPS4转录物的水平,以将硫酸盐同化成有机硫化合物(Sred).当硫酸盐供应受限制时激活SLIM1,其直接诱导根硫酸盐转运蛋白SULTR2;1的表达来增加硫酸盐的吸收.SLIM1诱导miR395的积累,其限制木质部SULTR2;1的表达,从而增强硫酸盐向植株地上部分的转运,同时抑制硫酸盐在根部的韧皮部中的运输.miR395抑制ATPS4的转录物水平,并与SLIM1一起调节ATPS的表达使得通过SLIM1独立诱导APR实现的硫酸盐同化通量增加.
miR395和SLIM1能相互配合,能精細调控当植物在不同的硫酸盐供应条件下,其根部和地上部组织对硫酸盐的吸收、运输和代谢,确保植物地上部分在土壤低硫条件下得到足量的硫酸盐;而当植物处于过度硫酸盐环境时,避免地上部分遭受过度的硫酸盐所引发的氧化胁迫.在这个调控过程中,根系的储硫和转移硫的能力将强烈地影响地上部分硫酸盐的恰当供给.将来,围绕硫酸盐对植物根系的结构和发育的调控的研究将有助于加深对植物硫代谢的调控机理的理解.
5 前景展望
为了确保植物对硫代谢的快速和精确的调节,必须调节硫酸盐的吸收和同化.事实上,硫酸盐的可利用性或推测的分子信号的大规模改变对硫酸盐的吸收和同化具有相同的影响.因此,对硫酸盐的限制增加了硫酸盐向根部的转运以及硫酸盐同化关键酶APR的活性.相应地,当硫酸盐水平增加时,这些参与硫代谢的组分的活化状态都会下调.然而,这种协调远远超出了代谢途径中间体对硫酸盐代谢的调节.虽然硫酸盐摄取很大程度上受SLIM1的作用控制,但该因子在APR的调节中没有作用[35].细胞分裂素以相反的方式影响硫酸盐的吸收和APR调节;而当硫酸盐的吸收被抑制时,APR实际上被诱导[46].此外,由胁迫引起的APR调节似乎远比在相同条件下调节硫酸盐摄取复杂得多.因此,植物进化出不同的方式和机制来实现对硫酸盐代谢的严格控制,其中一些取决于硫酸盐吸收和同化的协调性,一些取决于通路的单一组分[47].这对未来剖析这些分子机制是一个巨大的挑战.
参考文献:
[1] LEUSTEK T,MARTIN M N,BICK J A,et al.Pathways and regulation of sulfur metabolism revealed through molecular and genetic studies [J].Annual Review of Plant Physiology and Plant Molecular Biology,2000,51:141-165.
[2] SAITO K.Regulation of sulfate transport and synthesis of sulfurcontaining amino acids [J].Current Opinion in Plant Biology,2000,3(3):188-195.
[3] XIANG C B,WERNER B L,CHRISTENSEN E M,et al.The biological functions of glutathione revisited in Arabidopsis transgenic plants with altered glutathione levels [J].Plant Physiology,2001,126(2):564-574.
[4] TAKAHASHI H,KOPRIVA S,GIORDANO M,et al.Sulfur assimilation in photosynthetic organisms:molecular functions and regulations of transporters and assimilatory enzymes [J].Annual Review of Plant Biology,2011,62:157-184.
[5] LVAREZ C,BERMDEZ M A,ROMERO L C,et al.Cysteine homeostasis plays an essential role in plant immunity [J].The New Phytologist,2012,193(1):165-177.
[6] KOPRIVOVA A,SUTER M,DEN CAMP R O,et al.Regulation of sulfate assimilation by nitrogen in Arabidopsis [J].Plant Physiology,2000,122(3):737-746.
[7] BUCHNER P,TAKAHASHI H,HAWKESFORD M J.Plant sulphate transporters:coordination of uptake,intracellular and longdistance transport [J].Journal of Experimental Botany,2004,55(404):1765-1773.
[8] SMITH F W,EALING P M,HAWKESFORD M J,et al.Plant members of a family of sulfate transporters reveal functional subtypes [J].Proceedings of the National Academy of Sciences of the United States of America,1995,92(20):9373-9377.
[9] SHIBAGAKI N,ROSE A,MCDERMOTT J P,et al.Selenateresistant mutants of Arabidopsis thaliana identify Sultr1;2,a sulfate transporter required for efficient transport of sulfate into roots [J].The Plant Journal,2002,29(4):475-486.
[10] TAKAHASHI H,WATANABETAKAHASHI A,SMITH F W,et al.The roles of three functional sulphate transporters involved in uptake and translocation of sulphate in Arabidopsis thaliana [J].The Plant Journal,2000,23(2):171-182.
[11] KATAOKA T,WATANABETAKAHASHI A,HAYASHI N,et al.Vacuolar sulfate transporters are essential determinants controlling internal distribution of sulfate in Arabidopsis [J].The Plant Cell,2004,16(10):2693-2704.
[12] KATAOKA T,HAYASHI N,YAMAYA T,et al.Roottoshoot transport of sulfate in Arabidopsis.Evidence for the role of SULTR3;5 as a component of lowaffinity sulfate transport system in the root vasculature [J].Plant Physiology,2004,136(4):4198-4204.
[13] KRUSELL L,KRAUSE K,OTT T,et al.The sulfate transporter SST1 is crucial for symbiotic nitrogen fixation in Lotus japonicus root nodules [J].The Plant Cell,2005,17(5):1625-1636.
[14] CAO M J,WANG Z,WIRTZ M,et al.SULTR3;1 is a chloroplastlocalized sulfate transporter in Arabidopsis thaliana [J].The Plant Journal,2013,73(4):607-616.
[15] HELL R,JOST R,BERKOWITZ O,et al.Molecular and biochemical analysis of the enzymes of cysteine biosynthesis in the plant Arabidopsis thaliana [J].Amino Acids,2002,22(3):245-257.
[16] SANDA S,LEUSTEK T,THEISEN M J,et al.Recombinant Arabidopsis SQD1 converts UDPglucose and sulfite to the sulfolipid head group precursor UDPsulfoquinovose in vitro [J].Journal of Biological Chemistry,2001,276(6):3941-3946.
[17] MIKKELSEN M D,PETERSEN B L,OLSEN C E,et al.Biosynthesis and metabolic engineering of glucosinolates [J].Amino Acids,2002,22(3):279-295.
[18] MITHEN R.Glucosinolates:biochemistry,genetics and biological activity [J].Plant Growth Regulation,2001,34(1):91-103.
[19] BARRON D,VARIN L,IBRAHIM R K,et al.Sulphated flavonoids:an update [J].Phytochemistry,1988,27(8):2375-2395.
[20] VARIN L,MARSOLAIS F,RICHARD M,et al.Sulfation and sulfotransferases 6:biochemistry and molecular biology of plant sulfotransferases [J].The FASEB Journal,1997,11(7):517-525.
[21] GIDDA S K,MIERSCH O,LEVITIN A,et al.Biochemical and molecular characterization of a hydroxyjasmonate sulfotransferase from Arabidopsis thaliana [J].Journal of Biological Chemistry,2003,278(20):17895-17900.
[22] MNARD R,ALBAN S,DE RUFFRAY P,et al.β1,3 glucan sulfate,but not β1,3 glucan,induces the salicylic acid signaling pathway in tobacco and Arabidopsis [J].The Plant Cell,2004,16(11):3020-3032.
[23] KLEIN M,PAPENBROCK J.The multiprotein family of Arabidopsis sulphotransferases and their relatives in other plant species [J].Journal of Experimental Botany,2004,55(404):1809-1820.
[24] ROTTE C,LEUSTEK T.Differential subcellular localization and expression of ATP sulfurylase and 5′adenylylsulfate reductase during ontogenesis of Arabidopsis leaves indicates that cytosolic and plastid forms of ATP sulfurylase may have specialized functions [J].Plant Physiology,2000,124(2):715-724.
[25] HATZFELD Y,CATHALA N,GRIGNON C,et al.Effect of ATP sulfurylase overexpression in bright yellow 2 tobacco cells:Regulation of ATP sulfurylase and SO42- transport activities [J].Plant Physiology,1998,116(4):1307-1313.
[26] LOGAN H M,CATHALA N,GRIGNON C,et al.Cloning of a cDNA encoded by a member of the Arabidopsis thaliana ATP sulfurylase multigene family:expression studies in yeast and in relation to plant sulfur nutrition [J].Journal of Biological Chemistry,1996,271(21):12227-12233.
[27] BOHRER A S,YOSHIMOTO N,SEKIGUCHI A,et al.Alternative translational initiation of ATP sulfurylase underlying dual localization of sulfate assimilation pathways in plastids and cytosol in Arabidopsis thaliana [J].Frontiers in Plant Science,2015,5:750.
[28] HIRAI M Y,FUJIWARA T,AWAZUHARA M,et al.Global expression profiling of sulfurstarved Arabidopsis by DNA macroarray reveals the role of OacetylLserine as a general regulator of gene expression in response to sulfur nutrition [J].The Plant Journal,2003,33(4):651-663.
[29] HIRAI M Y,KLEIN M,FUJIKAWA Y,et al.Elucidation of genetogene and metabolitetogene networks in Arabidopsis by integration of metabolomics and transcriptomics [J].Journal of Biological Chemistry,2005,280(27):25590-25595.
[30] VAUCLARE P,KOPRIVA S,FELL D,et al.Flux control of sulphate assimilation in Arabidopsis thaliana:adenosine 5′phosphosulphate reductase is more susceptible than ATP sulphurylase to negative control by thiols [J].The Plant Journal,2002,31(6):729-740.
[31] OHKAMA N,TAKEI K,SAKAKIBARA H,et al.Regulation of sulfurresponsive gene expression by exogenously applied cytokinins in Arabidopsis thaliana [J].Plant and Cell Physiology,2002,43(12):1493-1501.
[32] BARROSO C,ROMERO L C,CEJUDO F J,et al.Saltspecific regulation of the cytosolic Oacetylserine(thiol)lyase gene from Arabidopsis thaliana is dependent on abscisic acid [J].Plant Molecular Biology,1999,40(4):729-736.
[33] FODOR J,GULLNER G,ADAM A L,et al.Local and systemic responses of antioxidants to tobacco mosaic virus infection and to salicylic acid in tobacco (Role in systemic acquired resistance) [J].Plant Physiology,1997,114(4):1443-1451.
[34] MOU Z L,FAN W H,DONG X N.Inducers of plant systemic acquired resistance regulate NPR1 function through redox changes [J].Cell,2003,113(7):935-944.
[35] MARUYAMANAKASHITA A,NAKAMURA Y,TOHGE T,et al.Arabidopsis SLIM1 is a central transcriptional regulator of plant sulfur response and metabolism [J].The Plant Cell,2006,18(11):3235-3251.
[36] FALKENBERG B,WITT I,ZANOR M I,et al.Transcription factors relevant to auxin signalling coordinate broadspectrum metabolic shifts including sulphur metabolism [J].Journal of Experimental Botany,2008,59(10):2831-2846.
[37] HIRAI M Y,SUGIYAMA K,SAWADA Y,et al.Omicsbased identification of Arabidopsis Myb transcription factors regulating aliphatic glucosinolate biosynthesis [J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(15):6478-6483.
[38] GIGOLASHVILI T,BERGER B,MOCK H P,et al.The transcription factor HIG1/MYB51 regulates indolic glucosinolate biosynthesis in Arabidopsis thaliana [J].The Plant Journal,2007,50(5):886-901.
[39] SKIRYCZ A,REICHELT M,BUROW M,et al.DOF transcription factor AtDof1.1 (OBP2) is part of a regulatory network controlling glucosinolate biosynthesis in Arabidopsis [J].The Plant Journal,2006,47(1):10-24.
[40] DROUX M.Plant serine acetyltransferase:new insights for regulation of sulphur metabolism in plant cells [J].Plant Physiology and Biochemistry,2003,41(6/7):619-627.
[41] JONESRHOADES M W,BARTEL D P.Computational identification of plant microRNAs and their targets,including a stressinduced miRNA [J].Molecular Cell,2004,14(6):787-799.
[42] BUHTZ A,SPRINGER F,CHAPPELL L,et al.Identification and characterization of small RNAs from the phloem of Brassica napus [J].The Plant Journal,2008,53(5):739-749.
[43] KAWASHIMA C G,YOSHIMOTO N,MARUYAMANAKASHITA A,et al.Sulphur starvation induces the expression of microRNA395 and one of its target genes but in different cell types [J].The Plant Journal,2009,57(2):313-321.
[44] LIANG G,YANG F X,YU D Q.MicroRNA395 mediates regulation of sulfate accumulation and allocation in Arabidopsis thaliana [J].The Plant Journal,2010,62(6):1046-1057.
[45] KAWASHIMA C G,MATTHEWMAN C A,HUANG S Q,et al.Interplay of SLIM1 and miR395 in the regulation of sulfate assimilation in Arabidopsis [J].The Plant Journal,2011,66(5):863-876.
[46] KOPRIVA S,MUGFORD S G,MATTHEWMAN C,et al.Plant sulfate assimilation genes:redundancy versus specialization [J].Plant Cell Reports,2009,28(12):1769-1780.
[47] KOPRIVOVA A,NORTH K A,KOPRIVA S.Complex signaling network in regulation of adenosine 5′phosphosulfate reductase by salt stress in Arabidopsis roots [J].Plant Physiology,2008,146(3):1408-1420.
(責任编辑:顾浩然)

