柚皮苷和柚皮素对枸橼酸喷托维林经大鼠肝微粒体代谢的影响
谢镗宁,吴灏,王永刚,彭维,苏薇薇,李沛波
(中山大学生命科学学院,广东 广州 510275)
柚皮苷属于二氢黄酮类化合物,化学名为7-[[2-O-(6-脱氧-α-L-鼠李糖基) -β-D-吡喃葡萄糖基]氧代]-2,3-二氢-5-羟基-2-(4-羟基苯基)-4H-1-苯并吡喃-4-酮。柚皮素是柚皮苷水解掉一分子葡萄糖和鼠李糖得到的苷元,柚皮苷口服后,大部分是在肠道内被肠道菌群脱糖基化代谢为柚皮素后经肠壁被吸收入血[1-2]。柚皮苷广泛存在于芸香科植物葡萄柚、桔、橙等水果植物及化橘红、骨碎补、枳实、枳壳、橘红、菝葜等中药中;在日常食用较多的橙汁及葡萄柚汁中也普遍含有柚皮苷[3]。尤其在葡萄柚汁中,柚皮苷的含量可达0.5 mg·mL-1[4]。
枸橼酸喷托维林是非成瘾性中枢镇咳药,1956年被合成后由比利时联合化学公司(Ucb)开发,国内于1962年开始生产。其镇咳作用与可待因相当,除对延髓的呼吸中枢有直接抑制作用外,还有轻度的阿托品样作用。临床适用于具有无痰干咳症状的疾病,急性支气管炎,慢性支气管炎及各种原因引起的咳嗽均可应用[5-6]。柚皮苷广泛存在于临床上用于治疗咳嗽、咯痰的中药材或中成药中[7-10],与枸橼酸喷托维林联合使用的可能性很大。因此,有必要对柚皮苷和柚皮素与枸橼酸喷托维林是否会发生相互作用进行研究,以提高用药的安全性。
细胞色素P450 (CYP450)酶是肝脏和肠中最为重要的Ⅰ相代谢酶,可催化多种内、外源物质的(包括大多数临床药物)代谢;CYP450酶具有可诱导性和可抑制性。因此,药物对CYP450酶活性的抑制或诱导是引发药物相互作用的常见机制。目前,关于柚皮苷和柚皮素是否会通过影响CYP450酶活性来影响枸橼酸喷托维林的代谢,尚未见文献报道。本实验采用体外温孵法评估柚皮苷和柚皮素对枸橼酸喷托维林经大鼠肝微粒体代谢的影响,为临床安全合理用药提供参考。
1 材料
1.1 药品与试剂 柚皮苷(由本团队委托广东环球制药有限公司生产,纯度>99%);柚皮素(Sigma公司,纯度>98%,批号:083K1328);枸橼酸喷托维林(中国生物制品检定所,含量测定,批号:100432-200401);曲安奈德(中国生物制品检定所,含量测定,批号:100055-200302);还原型辅酶Ⅱ四钠(NADPH,广州威佳生物科技有限公司,批号:2009/08)。
1.2 设备与仪器 DIONEX P680高效液相色谱仪(UVD 170U 紫外检测器、ASI-100自动进样器),Chromeleon Client Programm色谱处理软件(Dionex,美国);TU-19101双光束紫外可见分光光度计(北京普析通用公司);高速离心机(3K-18,Sigma公司);系列精密移液器(美国Rainin公司)。
1.3 实验动物 Wistar大鼠,7周龄,雄性,体重200~220 g,SPF 级,由广东省医学实验动物中心提供,动物合格证号:SCXK(粤)2008-0002。实验动物饲养于中山大学生命科学学院动物房,动物使用许可证号为SYXK(粤)2004-0020,人工光循环12 h/12 h,温度为(24±2.0)℃,湿度为55%±5%。动物实验流程遵循中山大学有关实验动物保护和使用的指南,并经中山大学生命科学学院动物伦理委员会批准。
2 方法
2.1 溶液的配制 柚皮苷和柚皮素标准贮备液:精密称取105 ℃干燥至恒重的柚皮苷对照品5.83 mg和柚皮素对照品2.86 mg,分别置于10 mL容量瓶中,加250 μL二甲基亚砜(DMSO)溶解,用0.1 mol·L-1Tris-KCl溶液定容,配制成浓度为1 mmol·L-1的母液,再分别精密吸取母液适量,置于10 mL容量瓶中,用0.1 mol·L-1Tris-KCl溶液稀释成浓度为100、10 μmol·L-1的标准贮备液,备用。喷托维林标准贮备液:精密称取真空干燥至恒重的喷托维林对照品5.26 mg,置于10 mL容量瓶中,用0.1 mol·L-1Tris-KCl溶解并定容,配制成浓度为1 mmol·L-1的母液,备用。曲安奈德内标溶液:精密称取真空干燥至恒重的曲安奈德对照品7.14 mg,置于10 mL容量瓶中,用50%甲醇溶解并定容,配制成浓度为0.714 mg·mL-1的溶液,备用。
2.2 大鼠肝微粒体的制备 取SD大鼠,禁食24 h,颈椎脱臼处死,迅速打开腹腔取出肝脏,用0~4 ℃生理盐水清洗至呈土黄色,吸干后称肝质量;取约1 g肝脏,加入3 mL匀浆液,于4 ℃条件下匀浆,匀浆液倾入预冷的离心管中,于10 500×g条件下离心30 min;取上清液与88 mmol·L-1CaCl2溶液混匀,使CaCl2终浓度为8.8 mmol·L-1,冰浴5 min后,于4 ℃和22 000 g条件下离心30 min;沉淀用重悬液重悬,采用BCA-100试剂盒测定肝微粒体蛋白含量,用Omura法测定CYP450酶的含量。
2.3 体外孵育条件确定 取制备好的大鼠肝微粒体,用重悬液稀释成1.0 mg·mL-1蛋白浓度的混悬液,取此混悬液150 μL,加入一定量的药物(底物)溶液混匀,于37 ℃预孵育5 min。用含NADPH的1%NaHCO3溶液20 μL(终浓度1 mmol·L-1)启动反应,终体积为250 μL,于37 ℃下孵育一定时间后,置冰浴中终止反应,置于-20 ℃冰箱中保存待测。
2.4 枸橼酸喷托维林测定方法学考察
2.4.1 色谱条件 色谱柱为大连依利特BDS C18柱(4.6 mm×250 mm,5 μm),流动相为乙腈-0.05 mmol·L-1庚烷磺酸钠(含0.3%三乙胺,pH 3.0)(45∶55),流速为1.0 mL·min-1,检测波长为210 nm。
2.4.2 样品处理 在样品中加入10 μL浓度为0.714 mg·mL-1的曲安奈德溶液后,加入200 μL甲醇,涡旋混合2 min后,离心10 min (12 000 rpm,4 ℃),精密吸取20 μL进样。
2.4.3 选择性研究 分别配制3种溶液各150 μL,其中,一份为失活后的肝微粒体,作为空白体系,一份为失活后的肝微粒体加入枸橼酸喷托维林及内标曲安奈德,一份为肝微粒体加入枸橼酸喷托维林,分别孵育后,按“2.4.2”项下方法处理并测定,考察大鼠肝微粒体中的杂质对药物的检测是否存在干扰。
2.4.4 标准曲线绘制 取枸橼酸喷托维林标准贮备液适量,加入灭活肝微粒体配制成浓度为5、25、50、75、100及125 μmol·L-1的150 μL标准曲线溶液,按“2.4.2”项下方法处理并测定,以待测物及内标峰面积之比为纵坐标,以浓度为横坐标,绘制标准曲线。
2.4.5 准确度及精密度试验 取肝微粒体和Tris-KCl溶液置于离心管中,分别加入枸橼酸喷托维林标准贮备液,配成浓度为10、50和100 μmol·L-1的质控样品溶液,平行6份,按“2.4.2”项下方法处理并测定,计算准确度及精密度。
2.4.6 回收率试验 取肝微粒体和Tris-KCl置于离心管中,分别加入枸橼酸喷托维林标准贮备液,配成浓度为10、50及100 μmol·L-1的溶液,平行6份,按“2.4.2”项下方法处理并测定。另配制枸橼酸喷托维林标准品溶液,通过二者的比值计算回收率。
2.5 代谢时间曲线研究 分别制备10、50及120 μmol·L-13个浓度的枸橼酸喷托维林溶液,按上述孵育方法孵育15、30、45、60及90 min后,按“2.4.2”项下方法处理后用高效液相色谱(HPLC)法测定剩余枸橼酸喷托维林的量,然后作出枸橼酸喷托维林的代谢时间-浓度曲线,以确定最佳孵育时间。
2.6 枸橼酸喷托维林在大鼠肝微粒体中的代谢动力学研究 分别制备浓度为10、20、40、60、80、100和120 μmol·L-1的枸橼酸喷托维林溶液,在肝微粒中孵育60 min后,按“2.4.2”项下操作,用HPLC测定剩余底物的量。根据Lineweaver-Burk方程式:1/V=Km/(Vmax×[S])+1/Vmax,以底物浓度的倒数1/[S]对反应速度的倒数1/V进行线性回归,截距的倒数即为最大反应速度(Vmax),斜率乘以Vmax即为米氏常数(Km)。
2.7 柚皮苷和柚皮素对枸橼酸喷托维林在大鼠肝微粒体中代谢的影响 采用一系列浓度的柚皮苷和柚皮素溶液(180、90、30、10、3.3、1.1、0.33及0.11 μmol·L-1)与枸橼酸喷托维林溶液进行共孵育60 min后,按“2.4.2”项下操作,用HPLC测定剩余枸橼酸喷托维林的量。同时设置空白对照,研究不同浓度的柚皮苷和柚皮素对枸橼酸喷托维林代谢的影响。
2.8 统计学分析 本实验数据用“均数±标准差”表示,采用SPSS统计软件进行统计学处理,P<0.05为有统计学差异。
3 结果
3.1 枸橼酸喷托维林测定方法学结果
3.1.1 选择性 如图1所示,在选定的色谱条件下,枸橼酸喷托维林的保留时间为7.0 min左右,空白体系在枸橼酸喷托维林及内标保留时间无杂质峰干扰,提示本HPLC检测方法具有良好的选择性。
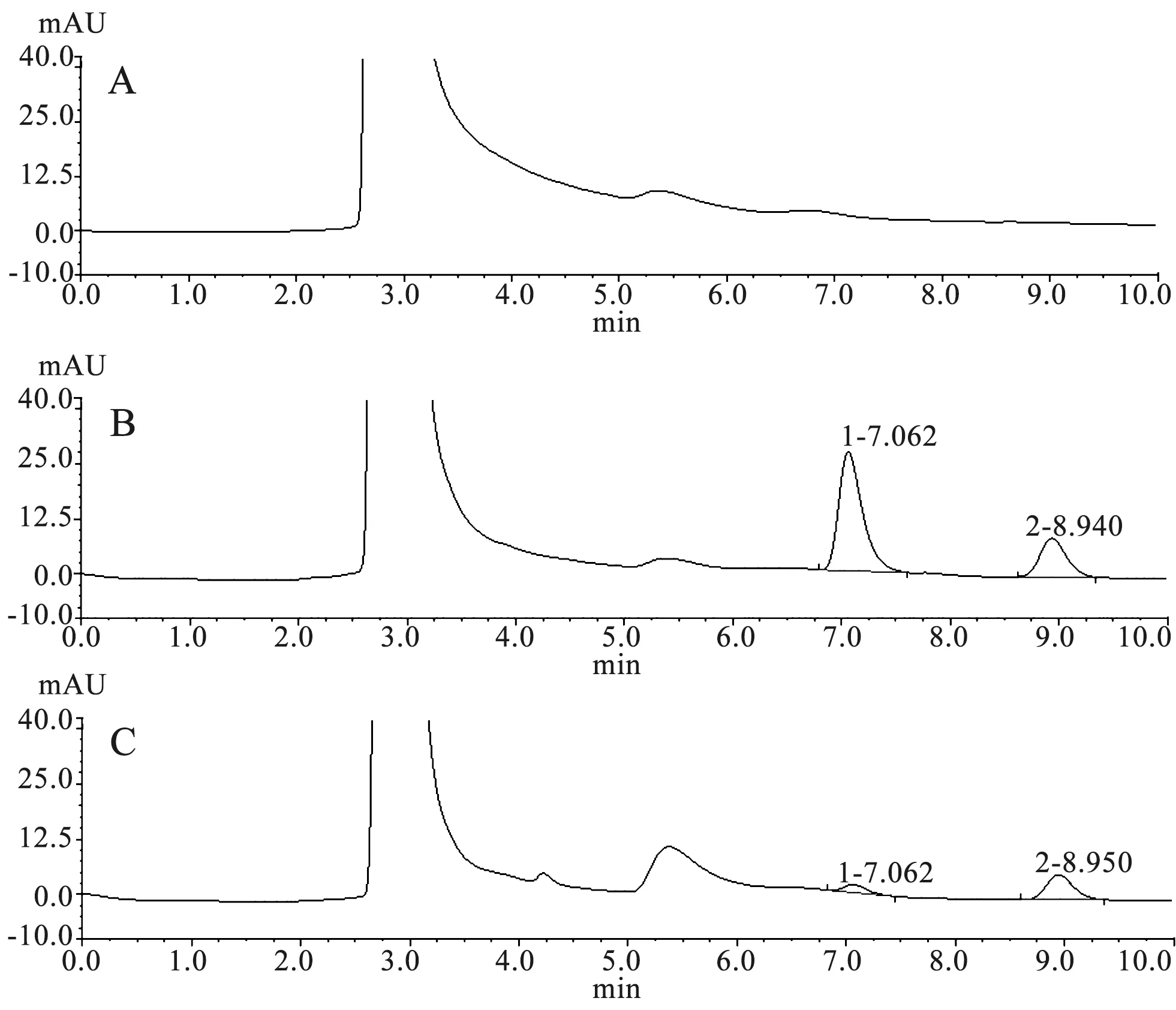
A.空白孵育体系图谱;B.空白孵育体系加入枸橼酸喷托维林和内标的图谱;C.肝微粒体体系中加入枸橼酸喷托维林和内标孵育后的图谱 1.枸橼酸喷托维林;2.内标
3.1.2 准确度、精密度和回收率试验 如表1所示,采用本条件下的HPLC法测定枸橼酸喷托维林样品,准确度及精密度试验的偏差值均小于±15%,回收率均在90.0%~110.0%范围内,符合生物样品分析方法的要求。说明该测定方法准确度、精密度、回收率良好,符合生物样品检测要求,适用于枸橼酸喷托维林的检测。

表1 准确度、精密度和回收率试验结果(n=6)
3.1.3 标准曲线和线性范围 结果显示,在5~125 μmol·L-1的浓度范围内,标准曲线方程为Y=0.031 5X-0.019 5,R2=0.999 8。说明在该线性范围内,枸橼酸喷托维林的浓度与色谱峰面积之间线性关系良好。
3.2 枸橼酸喷托维林代谢时间-浓度曲线研究 如表2所示,在方法学开发试验中,当孵育时间达到60 min,枸橼酸喷托维林的代谢已基本达到平台期,符合试验要求。因此,在方法学验证试验及样品测定试验中,选择60 min作为孵育体系的代谢时间。

表2 枸橼酸喷托维林代谢时间-浓度变化结果(n=3)
3.3 枸橼酸喷托维林酶动力学研究 根据Lineweaver-Burk方程式得到的曲线方程为Y=16 685X+575.21(X为底物浓度的倒数,Y为反应速度的倒数,R2=0.991),求得Vmax为1.74 nmol·(min·mg)-1,Km为29.00 μmol·L-1。因此,确定30 μmol·L-1作为枸橼酸喷托维林的代谢反应的底物浓度。
3.4 柚皮苷和柚皮素对枸橼酸喷托维林在大鼠肝微粒体中代谢的影响 柚皮苷和柚皮素对枸橼酸喷托维林在大鼠肝微粒体中代谢的影响结果见表3。以空白对照组代谢量为100%,计算柚皮苷和柚皮素对枸橼酸喷托维林经大鼠肝微粒体代谢的相对抑制率。经统计学分析,柚皮苷和柚皮素各剂量组的代谢量与空白对照组的代谢量无显著性差异(P>0.05)。说明柚皮苷和柚皮素浓度在(0.11~180) μmol·L-1范围内对枸橼酸喷托维林在大鼠肝微粒体中的代谢无明显影响。

表3 柚皮苷和柚皮素对枸橼酸喷托维林在大鼠肝微粒体中代谢的影响(n=3)
4 讨论
柚皮苷及其苷元柚皮素广泛存在于多种植物或中药中,近年来,越来越多的研究报道其各种药理活性,如,抗糖尿病、免疫调节、抗骨质疏松、抗氧化、抗炎、改善神经功能障碍、改善糖脂代谢紊乱、抗动脉粥样硬化、抗癌等药理作用[11-15]。在我国,随着中西医结合的深入发展,中西药物并用的用药方式日趋普遍。因此,研究柚皮苷及其苷元柚皮素与临床常用药物之间的相互作用是十分必要的。
枸橼酸喷托维林是非成瘾性中枢镇咳药,临床用于具有无痰干咳症状的疾病,急性支气管炎、慢性支气管炎及各种原因引起的咳嗽可应用[5]。枸橼酸喷托维林也是多种复方止咳祛痰药的主要成分[16-18]。虽然枸橼酸喷托维林在临床应用时间已超过60年,但是,关于其药代动力学的研究报道依然很少。目前,未见文献报道枸橼酸喷托维林是被何种肝药酶亚型所代谢。
本实验采用体外温孵法评估柚皮苷和柚皮素对枸橼酸喷托维林经大鼠肝微粒体代谢的影响,研究结果表明,在浓度为(0.11~180) μmol·L-1的浓度范围内,柚皮苷和柚皮素均未对枸橼酸喷托维林经大鼠肝微粒体代谢产生显著影响,提示柚皮苷和柚皮素不影响枸橼酸喷托维林在大鼠肝微粒体中的代谢。

