五味子乙素通过抑制TLR4-MyD88信号通路减轻脂多糖诱导的小鼠巨噬细胞凋亡
朱翔鸿,3 杨贞 钱颖 李松涛 窦晓兵
1.浙江中医药大学生命科学学院 杭州 310053 2.浙江中医药大学分子医学研究所
3.浙江中医药大学滨江学院 4.浙江中医药大学第二临床医学院
5.浙江中医药大学基础医学院、公共卫生学院
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)已逐渐成为全球慢性肝病的首要原因,非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)是NAFLD进展中的关键环节[1],全球约有24%的成人患NAFLD,其中大约25%为NASH[2]。脂多糖(lipopolysaccharide,LPS)是 NAFLD 进展为 NASH的主要影响因素之一,其通过促进肝脏巨噬细胞分泌肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和其他炎症因子[3],从而促进NASH的发生发展。
目前中医药已成为治疗NASH的重要选择之一,在降低炎症指标水平、维持机体内环境平衡方面具有明显的优势[4]。扶正化瘀的中药复方具有益精养肝扶正、活血化瘀的功效[5],常被用于NAFLD/NASH的临床治疗。扶正化瘀复方中五味子主要发挥保肝解毒的作用,而五味子乙素(schisandrin B,Sch B)是五味子的主要成分,研究证实其具有抗炎、抗肿瘤、清除自由基等作用[6],但Sch B对NAFLD/NASH的作用尚不明确,本研究通过LPS诱导建立小鼠巨噬细胞炎症损伤模型,探究Sch B对LPS诱导的巨噬细胞炎症损伤的影响及其相关分子机制。
1 材料和方法
1.1 细胞 小鼠单核巨噬细胞白血病细胞RAW 264.7购自美国模式培养物集存库(American Type Culture Collection,ATCC)。
1.2 主要试剂和仪器 Sch B、Toll样受体 4(Toll like receptor 4,TLR4)抑制剂、DMEM培养基、噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)购于 Sigma公司(批号:61281、614316、D5796、11465007001);胎牛血清购于Biological Industries公司(批号:04-001-1ACS);乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒购于Thermo公司(批号:TR20015);BCA 蛋白浓度检测试剂盒购于普利莱公司(批号:P1511);TNF-α、白细胞介素-6(interleukin-6,IL-6)酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)检测试剂盒购于武汉博士德生物工程有限公司(批号:EK0527、EK0411);所有引物由上海生工生物工程股份有限公司合成。酶标仪购于美国MD公司;7500 Fast荧光定量PCR仪为美国ABI公司产品。
1.3 方法
1.3.1 细胞培养和分组 RAW 264.7细胞采用含10%胎牛血清的DMEM培养基,放置在37℃、5%CO2的培养箱中培养。将细胞接种于24孔板,待细胞密度达到70%对细胞进行药物处理。设置空白对照组、不同浓度Sch B组和TLR4抑制剂组,分别以25、50、100μmol·L-1Sch B 或 0.4μg·mL-1TLR4 抑制剂预处理细胞2h,而后加入LPS干预8h。
1.3.2 细胞损伤检测 细胞分组及药物处理方案同1.3.1,各给药组分别收集细胞培养基10μL加入96孔板中,再加入LDH工作液40μL,37℃孵育30min,加入终止液50μL,酶标仪于440nm处检测吸光度(optical density,OD)值,细胞的损伤程度以各给药组与空白对照组OD值的比值表示。
1.3.3 MTT检测细胞存活率 收集细胞,调整细胞密度为1×104个/mL,接种于96孔板中,细胞分组及药物处理方案同1.3.1,弃去培养基,向96孔板中加入MTT溶液,孵育4h后弃去上清液,加入二甲基亚砜(dimethyl sulfoxide,DMSO)并振荡充分溶解,酶标仪于570nm处检测OD值,计算细胞存活率。
1.3.4 炎症因子测定 细胞分组及药物处理方案同1.3.1,弃去培养基,以PBS漂洗后加入RIPA裂解液,冰上孵育30min,收集细胞裂解液放入Ep管中,以ELISA试剂盒检测细胞质中TNF-α、IL-6含量,并以BCA试剂盒检测蛋白浓度校准。
1.3.5 荧光定量PCR检测TLR4、髓样分化因子88(myeloid differentiation factor88,MyD88) 和 TNF-α的mRNA表达 收集细胞,以PBS漂洗3次后用Trizol法提取细胞总RNA,于4℃下12 000r/min离心5min,弃去上清液后至通风橱中干燥,将总RNA溶于适量预冷DEPC水中,测定RNA浓度并逆转录为cDNA。采用实时荧光定量PCR检测TLR4、MyD88和TNF-α的mRNA表达并以β-actin为内参进行校正。引物序列见表1。
1.4 统计学分析 采用SPSS 22.0统计软件进行统计学分析。两组间比较采用独立样本t检验;多组间比较,先进行方差齐性检验,方差齐时采用单因素方差分析,方差不齐则单独分离采用独立样本t检验。以P<0.05为差异有统计学意义。
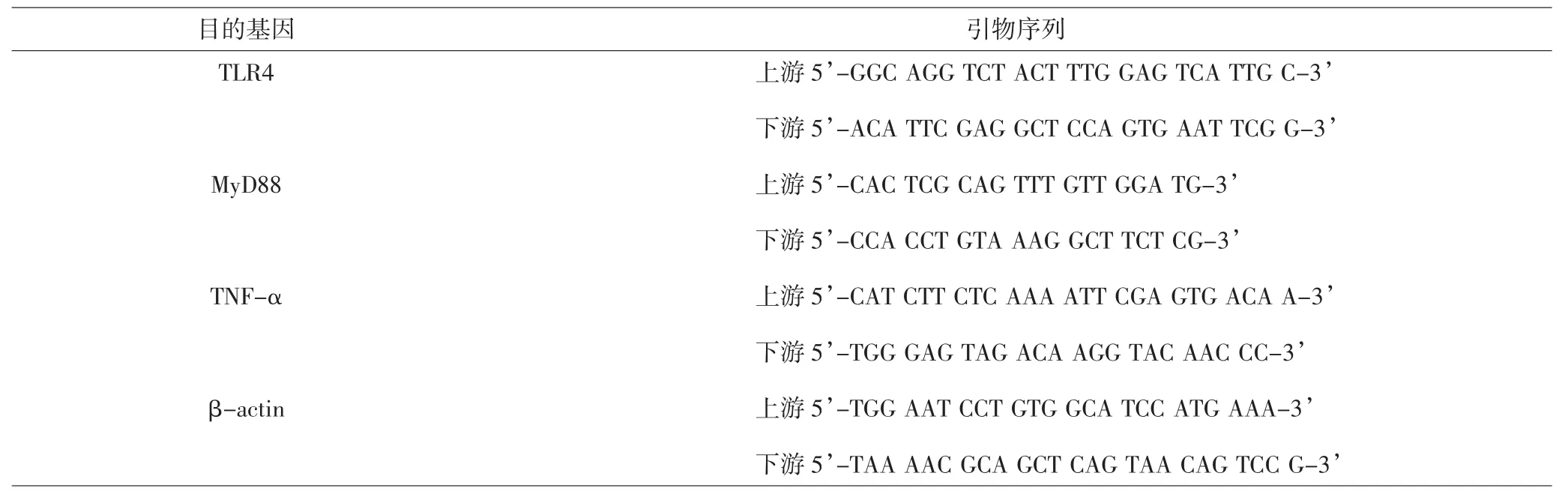
表1 引物序列Tab.1 Primer sequences
2 结果
2.1 LPS诱导炎症损伤模型建立 分别以25、50、100ng·mL-1LPS 干预 8h 后,与空白对照组(0ng·mL-1)比较,结果提示,100ng·mL-1LPS干预后,细胞培养基中LDH水平和细胞内炎症因子TNF-α含量均显著增加(P<0.05)。见图1。表明LPS可以诱导细胞炎症反应及细胞损伤,在后续研究中选择100ng·mL-1的LPS作为炎症损伤的诱导剂量。

图1 LPS诱导细胞损伤Fig.1 LPS induced cell injury
2.2 各组细胞损伤和细胞存活率比较 分别采用0.4μg·mL-1TLR4 抑制剂和 25、50μmol·L-1Sch B 预处理细胞2h,再以100ng·mL-1LPS干预8h,检测培养基中LDH水平,结果表明LPS导致LDH水平升高,细胞存活率下降(P<0.05),而高浓度的Sch B能显著减轻LPS诱导的细胞损伤(P<0.05)。见图2A。MTT检测提示,LPS导致细胞存活率下降(P<0.05),高浓度的Sch B能够提高细胞存活率(P<0.05)。见图2B。

图2 各组细胞损伤和细胞存活率比较Fig.2 Comparison of cell injury and cell survival rate in each group
2.3 各组细胞炎症因子含量比较 分别采用0.4μg·mL-1TLR4 抑制剂和 25、50、100μmol·L-1Sch B 预处理细胞2h,然后以LPS干预8h。ELISA检测提示,LPS诱导细胞内 TNF-α、IL-6含量上调(P<0.05),而Sch B 能下调 TNF-α、IL-6的含量(P<0.05)。见图 3。

图3 各组细胞炎症因子含量比较Fig.3 Comparison of content of inflammatory cytokines in each group
2.4 各组细胞TLR4-MyD88信号通路基因表达比较分别采用 0.4μg·mL-1TLR4 抑制剂和 25、50、100μmol·L-1Sch B 预处理细胞 2h,然后以 LPS 干预8h。荧光定量PCR检测提示,LPS能够提升TLR4、MyD88、TNF-α 的 mRNA 表达水平(P<0.05),而 Sch B能显著下调 TLR4、MyD88、TNF-α的 mRNA 表达水平(P<0.05),且与剂量相关。见图4。
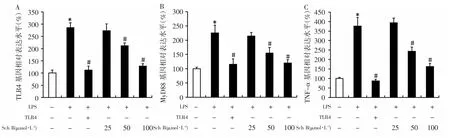
图4 各组细胞TLR4-MyD88信号通路基因表达比较Fig.4 Comparison of gene expression of TLR4-MyD88 signaling pathway in each group
3 讨论
中医认为,NAFLD的疾病表现虚实夹杂,应以防为先,在扶正化瘀的基础上综合用药,而NAFLD/NASH其关键病机在于正气不足、热毒内陷、癖热互结,虚、热、癖是本病发生发展的主要病机基础[7],预防之时当以益气养阴、活血祛癖为主。扶正化瘀复方由丹参、绞股蓝、桃仁、松花粉、虫草菌丝、五味子6味中药组成,Sch B是方剂中五味子的主要活性成分,具有抑制炎症和抗氧化的作用[5],但是其具体作用机制尚不清楚,因此本研究建立了LPS诱导的细胞炎症损伤模型,探究Sch B对LPS诱导的细胞炎症损伤的影响及其相关分子机制。结果显示,Sch B能够显著改善细胞损伤,并降低炎症因子的表达。
研究证实,LPS能够激活TLR4,导致机体产生强烈免疫反应,在机体免疫和炎症发生过程中起到关键作用,但过度免疫不利于机体修复[8]。TLR4通过激活MyD88依赖性途径,可诱导核因子-κB(nuclear factor-κB,NF-κB)表达,从而促进炎症因子 TNF-α、IL-6等的分泌[9],并大量释放活性氧(reactive oxygen species,ROS),进一步加重炎症反应,引起肝脏细胞损伤[10]。现有研究表明,TLR4-MyD88信号通路是改善细胞炎症的有效途径,MyD88作为TLR4最主要的下游信号分子,在炎症反应中起重要作用,通过抑制TLR4-MyD88信号通路能减轻LPS诱导的细胞炎症反应[11]。在本研究中通过TLR4抑制剂同样证实了这个结论。本研究还发现,LPS能够增加细胞炎症因子释放,而Sch B能显著抑制LPS的作用,Sch B还能够抑制TLR4及其下游基因MyD88的表达,因此笔者推测Sch B能够通过抑制TLR4-MyD88信号通路发挥其对细胞炎症损伤的保护作用。
综上所述,LPS通过TLR4-MyD88依赖的机制诱导小鼠巨噬细胞损伤,而Sch B通过调控TLR4-MyD88信号通路抑制LPS诱导的炎症因子表达,从而减轻LPS诱导的细胞损伤。本研究结果初步提示,Sch B可能作为防治NASH的潜在药物。

