高尿酸血症大鼠的血清脂肪酸代谢特征及祛浊通痹方干预研究
谭祖教 李倩倩 周佳
1.浙江中医药大学基础医学院 杭州 310053 2.浙江中医药大学附属第二医院
尿酸是嘌呤代谢的最终产物,嘌呤代谢紊乱导致体内尿酸生成增多,形成高尿酸血症,尿酸盐堆积会进一步引发痛风,严重影响患者的生活质量。黄嘌呤氧化还原酶(xanthine oxidoreductase,XOR)是嘌呤代谢的关键酶之一。别嘌醇能有效抑制XOR,阻断黄嘌呤、次黄嘌呤代谢为尿酸,从而抑制尿酸的合成[1],是目前临床上应用范围最广的降尿酸药物之一,但别嘌醇可能引起别嘌醇过敏综合征和严重皮肤不良反应,严重时可能危及患者生命[2]。
痛风属中医“痹症”范畴,课题组前期研究认为痛风的发病主要与肝郁脾虚、浊瘀等有关,从而提出祛浊通痹是高尿酸血症和痛风的重要治则,并结合临床实践基础确立了袪浊通痹方[3]。该方以土茯苓、川萆薢解毒除湿、祛风通痹为君药,薏苡仁、玉米须、泽泻、葎草利水渗湿、泻热通淋为臣药,佐以桑寄生、豨莶草补益肝肾、通利关节,以片姜黄、延胡索、佛手疏肝理气止痛为使药,意在发挥其疏肝运脾、通瘀泄浊之效。临床研究表明,该方可有效降低尿酸水平,减轻关节肿胀程度,缓解痛风发作[4]。动物研究证实,祛浊通痹方对XOR有一定的抑制作用[5],但由于中药复方成分复杂、作用靶点多,目前关于祛浊通痹方治疗痛风的机制仍未明确。
高尿酸血症与脂质代谢紊乱密切相关[6]。研究表明,尿酸通过激活碳水化合物反应元件结合蛋白(carbonhydrate response elementbinding protein,ChREBP),使ChREBP与碳水化合物结合生成乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)和脂肪酸合成酶(fatty acid synthase,FAS),并最终合成脂肪[7]。FAS参与了脂肪酸合成的整个过程,是脂肪酸代谢的关键酶,FAS表达异常将造成脂肪酸代谢紊乱[8]。尿酸水平升高正反馈调节FAS表达,或将导致一系列脂肪酸代谢异常。本研究拟采用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用技术全面系统地分析高尿酸血症大鼠体内脂肪酸代谢谱的变化,从脂肪酸代谢的角度进一步探讨别嘌醇和中药祛浊通痹方治疗痛风的作用机制。
1 材料和方法
1.1 主要实验材料
1.1.1 实验动物 健康雄性SD大鼠20只,8周龄,体质量(240±30)g,由浙江省医学科学院提供[实验动物生产许可证号:SCXK(浙)2008-0033]。
1.1.2 主要试剂 生药土茯苓、薏苡仁、川萆薢、玉米须、泽泻、葎草、桑寄生、豨莶草、片姜黄、延胡索、佛手均购于浙江中医药大学饮片厂;色谱级甲醇购于德国Merck公司(批号:10964207831);正己烷购于美国A-vantor公司(批号:0000094377);十二酸-12,12,12-D3购于瑞典 Larodan公司(批号:5053:2);三氟化硼/甲醇(boron trifluoride/methanol,BF3/MeOH)溶液购于美国 Sigma-Aldrich公司(批号:BCBW3188);别嘌醇为重庆科瑞制药产品(0.1g/片,国药准字号:H50020455);酵母粉购于英国OXOID公司(批号:1167448);高脂饲料购于南通特洛菲饲料科技有限公司(批号:20181204)。
1.1.3 主要实验仪器 Agilent 7890/5975C GC-MS联用仪为美国Agilent公司产品;CentriVap低温冷冻离心浓缩仪购于美国Labconco公司;TBA-40FR全自动生化分析仪购于日本东芝三广医疗株式会社。
1.2 实验方法
1.2.1 药物制备 祛浊通痹方由土茯苓60g、薏苡仁30g、川萆薢 30g、玉米须 15g、泽泻 15g、葎草 15g、桑寄生15g、豨莶草18g、片姜黄12g、延胡索18g、佛手1 2g组成,生药量共240g,加入10倍量的蒸馏水浸泡1h后煎煮1h,将滤液于50℃减压蒸馏,制备成浓度为2.4g·mL-1的祛浊通痹方提取液。别嘌醇以0.2%羧甲基纤维素钠配制成浓度为1.0mg·mL-1的混悬液备用。
1.2.2 饲料配制 将酵母粉以10%的含量均匀拌入粉碎的大鼠高脂饲料中,重新压粒成型即为含10%酵母提取物的高脂饲料。
1.2.3 实验动物分组及处理 20只雄性SD大鼠适应性喂养7d后随机分为4组,每组5只,组别如下:正常(N)组、模型(M)组、别嘌醇(T1)组及祛浊通痹方(T2)组。N组给予正常饮食,其余3组给予高脂饮食。除N组和M组外,其余2组分别从高脂饮食第3周开始灌胃给药,1次/d,持续3周,T1组给予10mg/kg别嘌醇混悬液灌胃(成人剂量的6倍),T2组给予10mL/kg祛浊通痹方提取液灌胃[5],N组和M组给予等体积蒸馏水灌胃。所有大鼠每3d称重一次,按体质量计算给药剂量。
1.2.4 血尿酸检测 造模前、造模2周及末次给药24h后,以眼眶采血法采集大鼠全血,静置1h后2 000r/min离心10min,分离血清,-80℃保存。使用TBA-40FR全自动生化分析仪检测血清中尿酸水平。
1.2.5 脂肪酸提取和衍生 药物干预3周后,抽取大鼠血样 20μL,加入 50μg·mL-1内标(十二酸-12,12,12-D3)20μL,混匀后再加入 0.5mol·L-1NaOH/MeOH 200μL,90℃反应 5min,然后加入 10%BF3/MeOH溶液200μL,90℃反应5min。冷却后分别加入饱和氯化钠溶液和正己烷萃取甲酯化脂肪酸各200μL,取上层冻干。以50μL正己烷溶解后上机分析。
1.2.6 GC-MS分析 采用DB-5MS石英毛细管柱(30m×0.25mm×0.25μm,美国 J&W 公司产品)进行分离。进样体积为1μL,分流比为5:1;载气为氦气(99.9996%),流速为1.2mL/min。柱温箱升温程序:初始60℃保持1min后,以20℃/min升温至200℃,保持3min,然后以5℃/min升温至280℃并保持5min。进样口温度设为280℃,传输线温度设为280℃,电子轰击离子源温度为230℃。溶剂延迟时间为3.5min,质谱扫描范围m/z 50~500。分析过程中随机安排样本进样顺序。
1.3 统计学分析 利用MSD工作站,对比脂肪酸数据库,对脂肪酸进行识别和积分,得到由质荷比、保留时间及对应峰面积组成的数据矩阵,峰面积经内标校正。应用SPSS 18.0统计软件进行统计学分析,多组计量资料组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血尿酸水平比较 造模前各组大鼠血尿酸水平无统计学差异(P>0.05)。见图1A。造模2周后,与N组比较,M组、T1组和T2组大鼠血尿酸水平均显著升高(P<0.05)。见图1B。由此证明以含10%酵母提取物的高脂饲料喂养可成功诱导大鼠高尿酸血症模型。药物干预3周后,与M组比较,T1组和T2组血尿酸水平均显著下降(P<0.05),且与N组血尿酸水平无统计学差异(P>0.05)。见图1C。说明别嘌醇与祛浊通痹方均能有效降低血尿酸。

图1 各组大鼠血尿酸水平比较Fig.1 Comparison of serum uric acid level in each group
2.2 造模和药物对高尿酸血症大鼠脂肪酸代谢的影响 药物干预3周后,采用GC-MS对各组大鼠血样进行检测,一共检测到31种脂肪酸,包括10种饱和脂肪酸、9种单不饱和脂肪酸和12种多不饱和脂肪酸。单因素方差分析结果显示,与N组比较,M组单不饱和脂肪酸总量显著下降(P<0.05)。见图2-1A。进一步比较每种脂肪酸的含量变化后发现,M组中饱和脂肪酸——十六烷酸(棕榈酸)和单不饱和脂肪酸——十六碳烯酸(棕榈油酸)及十八碳烯酸(油酸)相对含量显著低于 N 组(P<0.05)。见图 2-1B、C、D。表明高尿酸血症大鼠存在多种脂肪酸代谢的异常,尤其是单不饱和脂肪酸含量下降。
别嘌醇和祛浊通痹方干预后,高尿酸血症大鼠体内下调的3种脂肪酸含量均回升,与N组比较无统计学差异(P>0.05)。见图 2-1B、C、D。此外,别嘌醇干预后,T1组十八碳三烯酸(亚麻酸)和二十四碳烯酸(神经酸)含量显著低于N组(P<0.05),而T2组亚麻酸和神经酸的含量与N组比较无统计学差异(P>0.05),其中神经酸含量高于 T1组(P<0.05)。见图2-2。

图2 -1造模和药物干预后含量发生变化的脂肪酸Fig.2-1 Content changed fatty acids after modeling and drugs intervention
2.3 造模或药物干预对脂肪酸延长酶的影响 脂肪酸延长酶是脂肪酸代谢的关键酶,通过对比产物脂肪酸与前体脂肪酸的比值(C18:1/C16:1)可估算脂肪酸延长酶活性[9]。本研究发现M组大鼠体内C18:1/C16:1的比值显著高于N组(P<0.05),M组中脂肪酸延长酶活性可能增强;而药物干预后,C18:1/C16:1的比值下降,与N组比较无统计学差异(P>0.05)。见图3。推测别嘌醇和祛浊通痹方均可影响脂肪酸延长酶的活性。
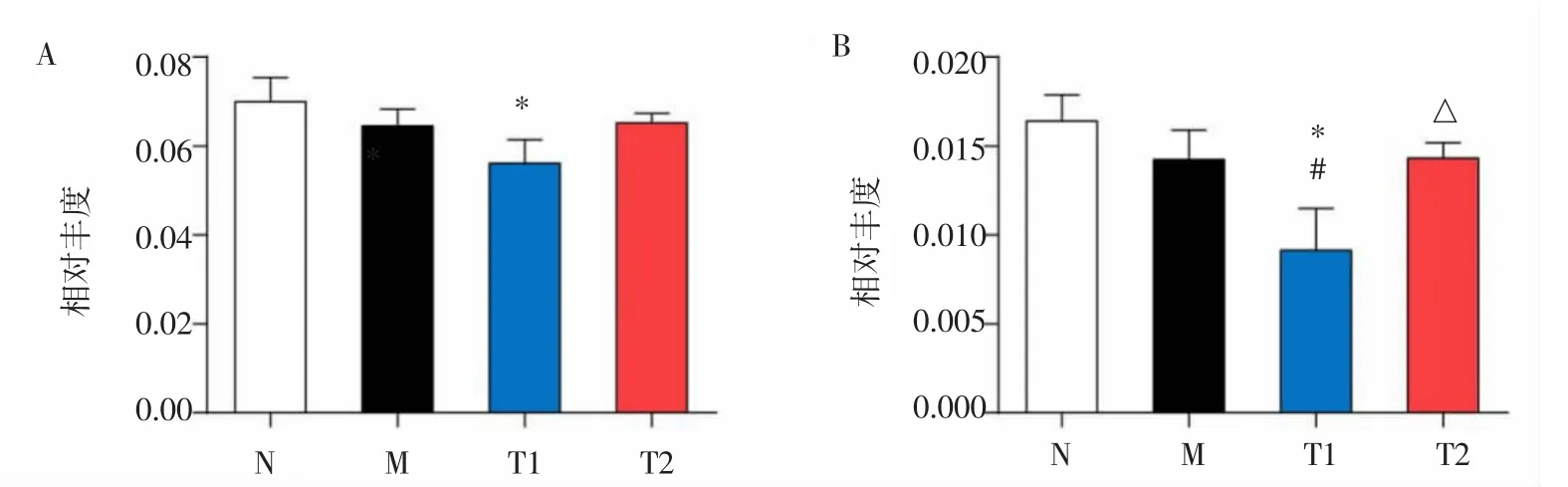
图2 -2造模和药物干预后含量发生变化的脂肪酸Fig.2-2 Content changed fatty acids after modeling and drugs intervention

图3 各组C18:1/C16:1比值比较Fig.3 Comparison of C18:1/C16:1 ratio in each group
3 讨论
肥胖是造成高尿酸血症的重要原因之一,体质量指数(body mass index,BMI)与高尿酸血症显著相关[10-11]。高尿酸血症患者常伴有高脂血症和脂质代谢紊乱,而脂肪酸代谢是脂质代谢的重要环节。目前研究表明,尿酸水平升高能够正反馈调节FAS表达,进一步造成脂肪酸代谢异常和脂肪沉积[7-8]。别嘌醇是目前常用的降尿酸药物之一,但可引起别嘌醇过敏综合征和严重皮肤不良反应,严重时可能危及患者生命[2]。痛风属中医的痹症范畴,课题组前期在临床实践的基础上确立了袪浊通痹方[3],该方由土茯苓60g、薏苡仁 30g、川萆薢 30g、玉米须 15g、泽泻 15g、葎草 15g、桑寄生 15g、豨莶草 18g、片姜黄 12g、延胡索18g、佛手12g组成,临床研究证明该方有良好的降尿酸效果[4]。本实验中以含10%酵母提取物的高脂饲料构建高尿酸血症大鼠模型,发现别嘌醇或祛浊通痹方干预后均可显著降低血尿酸水平,再次证明两种药物都有很好的降尿酸作用。
本研究采用GC-MS技术系统地分析高尿酸血症大鼠体内脂肪酸代谢谱的变化,探讨别嘌醇和中药祛浊通痹方对脂肪酸代谢的干预作用。图4总结了造模及药物干预后脂肪酸代谢的改变。M组大鼠体内多种脂肪酸下降,尤其是单不饱和脂肪酸(不饱和脂肪酸总量、棕榈酸、棕榈油酸、油酸等)均下降。单不饱和脂肪酸具有降血糖、调节血脂水平、降低心血管疾病风险等作用[12-13],其含量在M组中整体下调提示高尿酸血症大鼠存在较高的心脑血管疾病风险。别嘌醇和祛浊通痹方干预后,上述单不饱和脂肪酸含量均增高,表明祛浊通痹方与别嘌醇均能改善高尿酸血症大鼠体内脂肪酸代谢紊乱。
脂肪酸的合成代谢涉及多种代谢酶,如脂肪酸延长酶和去饱和酶,这些酶活性的异常与肥胖、高脂血症、高血压和高尿酸血症等密切相关。高尿酸血症大鼠C18:1/C16:1比值显著上调,说明高脂饮食刺激了脂肪酸延长酶活性,延长酶活性增强可进一步促进体内甘油三酯含量的增加[14],进而为黄嘌呤、次黄嘌呤氧化提供条件。经过别嘌醇或祛浊通痹方干预后,C18:1/C16:1比值显著下降,提示药物可能通过影响脂肪酸延长酶参与脂肪酸代谢,但其在降尿酸中的作用仍需进一步研究。
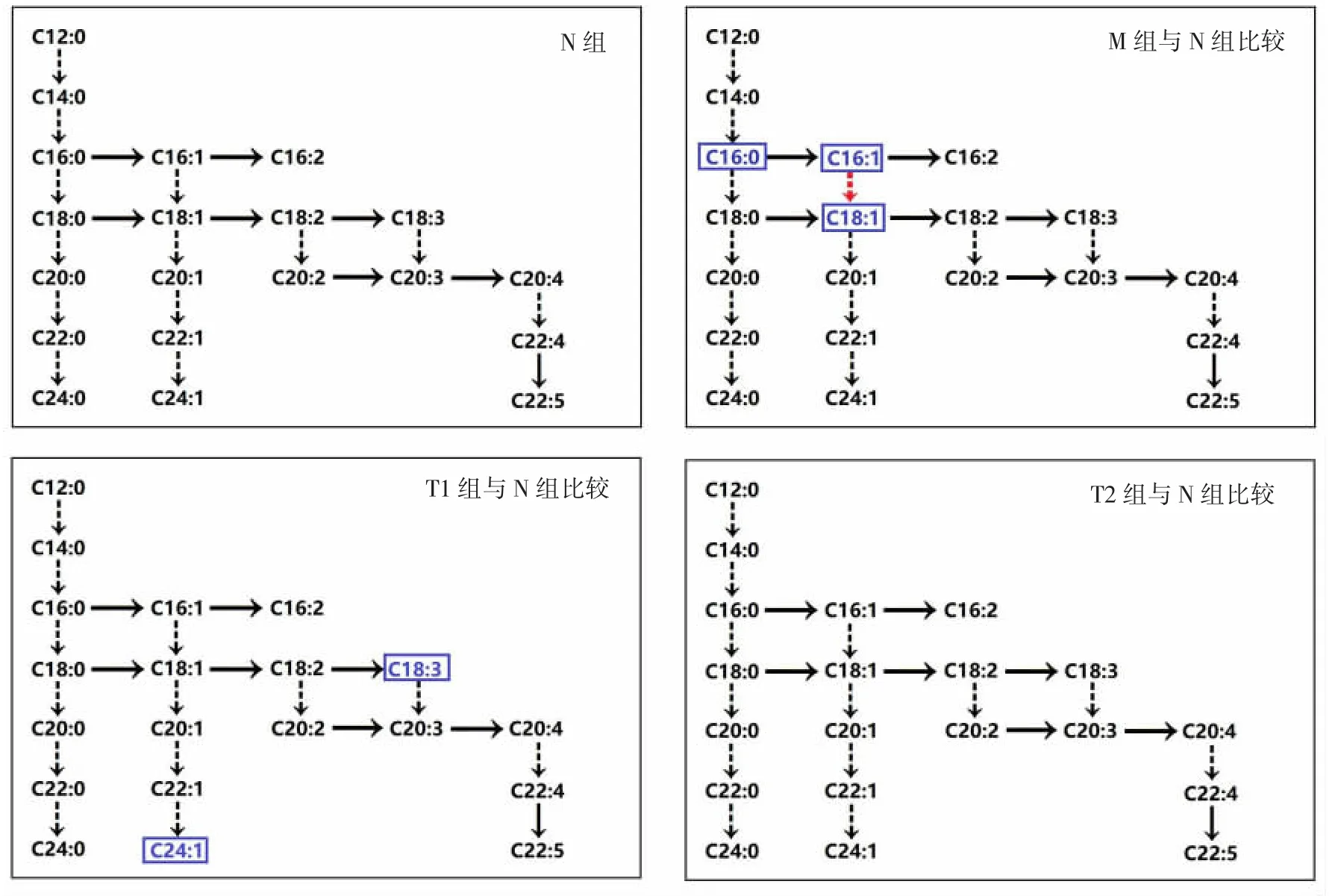
图4 造模及药物干预后脂肪酸代谢差异总结Fig.4 Summary of the differences of fatty acid metabolism after modeling and drug intervention
祛浊通痹方重用土茯苓、川萆薢为君,意在解毒除湿、祛风通痹;臣以薏苡仁、玉米须、泽泻、葎草,利水渗湿、泻热通淋;佐以桑寄生、豨莶草,补益肝肾、通利关节;以片姜黄、延胡索、佛手疏肝理气止痛为使,共达疏肝运脾、通瘀泄浊之效。现代药理学研究表明,方中单味药如土茯苓、薏苡仁、玉米须等中含有丰富的棕榈酸、油酸、亚麻酸等,能够从多个途径参与脂质代谢调节[15-19]。由此推测祛浊通痹方可能通过干预脂肪酸代谢,影响嘌呤代谢。
此外,本研究发现别嘌醇引起了亚麻酸和神经酸含量减少,而祛浊通痹方干预后这些脂肪酸含量没有明显变化。亚麻酸是人体必需脂肪酸,可在体内代谢为二十二碳六烯酸(docosahexenoic acid,DHA)和二十碳五烯酸(eicosapentaenoic acid,EPA),人体缺乏亚麻酸,会出现免疫力降低、记忆力减退、动脉粥样硬化等症[20]。神经酸可迅速分解清除血液内多余的甘油三酯和胆固醇,抑制脂类吸收,清除血液内的自由基、降低血液黏稠度[21]。笔者推测,祛浊通痹方可能选择性地影响脂肪酸代谢,其作用与别嘌醇存在差异。
脂质代谢紊乱与高尿酸血症发生有密切关联,脂肪酸代谢是脂质代谢的重要环节。本研究利用GC-MS联用技术全面分析了高尿酸血症大鼠脂肪酸代谢谱,并比较了别嘌醇和祛浊通痹方对脂肪酸代谢的影响,结果提示高尿酸血症大鼠存在脂肪酸代谢异常,尤其是单不饱和脂肪酸含量下调明显;别嘌醇和祛浊通痹方均 可改善高尿酸血症大鼠的脂肪酸代谢;祛浊通痹方除了纠正高尿酸血症相关的异常脂肪酸代谢外,对其他脂肪酸无影响,不良反应少于别嘌醇,但其有效成分和具体作用机制仍需进一步研究。

