响应面法优化纤维素酶提取三叶青多糖的工艺研究
何 文,李瀚鑫,Khudoyberdiev Ilkhomjon,王晰雯,叶春林
(浙江科技学院 生物与化学工程学院,杭州 310023)
三叶青(radix tetrastigmatis hemsleyani),又名蛇附子、石老鼠、石猴子、石抱子等,为葡萄科崖爬藤属植物三叶崖爬藤[1]。它主要分布于中国浙江、安徽、江西、云南、贵州等地,具有清热解毒、消肿散结、活血化瘀等功效[2]。三叶青中含有多种有效的化学活性成分,多糖便是其中之一。研究表明,三叶青多糖具有复杂的生物活性和功能,如降血糖、抗氧化、抗肿瘤、抗肝损伤、调节免疫等[3]。目前研究人员提取三叶青多糖的方法大多为传统的水提醇沉法、酸碱提取法、索氏提取法等[4],这些传统的提取方法普遍存在提取温度高、耗时长、效率低、溶剂消耗大且多糖的空间结构易被破坏等缺点[5-7]。
酶法提取多糖是一种新的提取方法,它是通过生物酶对中药植物细胞壁的破坏作用,使细胞内的多糖成分得到释放,从而达到提取目的[5],常用的生物酶有蛋白酶、纤维素酶、果胶酶等[8]。此法提取条件温和,对多糖结构破坏性较小,而且具有时间短、效率高、能耗低等优点[5]。响应面法是一种综合试验设计和数学建模的优化方法,具有试验次数少、周期短、精密度高、预测性能好等优点,能研究几种因素间的交互作用,被越来越多地应用于工艺优化中[9]。本文基于酶法在提取中药多糖时的优点,选用纤维素酶提取三叶青多糖,利用响应面法优化其提取工艺参数,考察各工艺参数对多糖提取率的影响,以得到纤维素酶法提取三叶青多糖的最佳工艺条件,以期为三叶青多糖的进一步开发利用提供参考。
1 材料与仪器
1.1 材 料
纤维素酶(BR,国药集团化学试剂有限公司,批号20180309);葡萄糖(AR,天津市大茂化学试剂厂);盐酸(AR,上海凌峰化学试剂有限公司);硫酸(AR,上海凌峰化学试剂有限公司);苯酚(AR,杭州双林化工试剂厂);1,1-二苯基苦基苯肼(DPPH,AR,北京冬歌生物科技有限公司);无水乙醇(AR,永华化学科技有限公司);FeSO4·7H2O(AR,天津市大茂化学试剂厂);水杨酸(AR,上海凌峰化学试剂有限公司);30%H2O2溶液(AR,杭州高晶精细化工有限公司);三叶青块根(浙江丽水三叶青珍稀植物研究所,产地浙江丽水)。
1.2 仪 器
高速多功能粉碎机(永康市天祺盛世工贸有限公司,CS-700);电子天平(北京赛多利斯仪器系统有限公司,BS224S型);循环水式真空泵(巩义市予华仪器有限公司,SHZ-DⅢ型);电热恒温水浴锅(杭州蓝天化验仪器厂,DKS-24型);752紫外可见分光光度计(上海菁华科技仪器有限公司);冰箱(博西华家用电器有限公司,BCD-212型);数显鼓风干燥箱(上海博迅实业有限公司医疗设备厂,9070MBE型);pH计(上海佑科仪器仪表有限公司,PHS-3C型)。
2 试验方法
2.1 标准曲线的建立
2.1.1 标准溶液的制备
准确称取干燥至恒重的葡萄糖50 mg于250 mL容量瓶中,加去离子水溶解并稀释至刻度,摇匀,配得葡萄糖标准溶液(0.2 mg/mL)。
2.1.2 最大吸收波长的确定
吸取1.0 mL的葡萄糖标准溶液,置于10 mL具塞试管中,加去离子水至2.0 mL,加6.0%苯酚溶液1.0 mL后,立即加入5.0 mL浓硫酸混匀,静止10 min,摇匀,室温放置20 min。同时取2.0 mL去离子水作为空白对照。在分光光度计上测定波长450~550 nm处的吸光度,确定其最大吸收波长[10]。根据试验结果,吸收波长为492 nm时,样品溶液的吸光度最大,故本试验选取的吸收波长为492 nm。
2.1.3 葡萄糖标准曲线的绘制
精确量取葡萄糖标准溶液0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL,置于10 mL具塞试管中,加去离子水至2.0 mL,加6.0%苯酚溶液1.0 mL后,立即加入5.0 mL浓硫酸混匀,静止10 min,摇匀,室温放置20 min。同时取2.0 mL去离子水作为空白对照,按上述方法操作,于最大吸收波长处测其吸光度,并绘制葡萄糖标准曲线[11]。
2.2 纤维素酶法提取三叶青多糖的工艺流程
将三叶青块根用粉碎机粉碎,准确称取三叶青粉末5.0 g及适量的纤维素酶,加入一定量的稀酸液并结合pH计调节溶液pH值为5,在一定温度条件下提取三叶青多糖。一段时间后将其置于90 ℃水浴锅中灭活5 min,再经过抽滤得到滤液,将滤液于250 mL容量瓶中定容,以用于接下来多糖提取率的测定[12-13]。
2.3 三叶青多糖提取率的测定
三叶青多糖提取率的测定采用苯酚-硫酸法[14]。从250 mL容量瓶中取1.0 mL试液于10 mL容量瓶中并定容。再从10 mL容量瓶中精密移取0.5 mL按2.1.3的方法测定样品吸光度,并按式(1)计算三叶青多糖的提取率:
Y=[(C×V×D)/M]×100%。
(1)
式(1)中:Y为多糖提取率;C为由标准曲线方程求得的多糖质量浓度,mg/mL;V为待测液体积,mL;D为稀释倍数;M为样品质量,mg。
2.4 单因素试验设计
在酶法提取三叶青多糖的过程中,影响多糖提取率的主要因素有酶加量、酶解时间、酶解温度、pH、水料比(体积∶质量,mL/g)、提取次数等[15]。本试验选择酶加量、酶解温度、酶解时间、水料比这4个因素分别进行单因素试验。通过多次的预试验,对各单因素条件的固定提取条件进行了设置,具体见表1。

表1 单因素试验设计Table 1 Single factor experimental design
3 试验结果与分析
3.1 标准曲线的回归方程
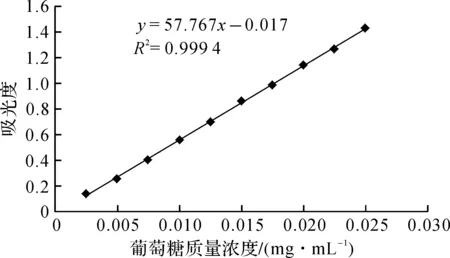
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
以吸光度y值为纵坐标,葡萄糖质量浓度x为横坐标,制作葡萄糖标准曲线,如图1所示。标准曲线的回归方程为:y=57.767x-0.017,R2=0.999 4,表明吸光度在葡萄糖标准溶液质量浓度为0.005~0.03 mg/mL范围内线性关系较好。
3.2 单因素试验结果及分析
按上述工艺流程及单因素试验,得出各因素对三叶青多糖提取率的影响结果。
3.2.1 酶加量对三叶青多糖提取率的影响
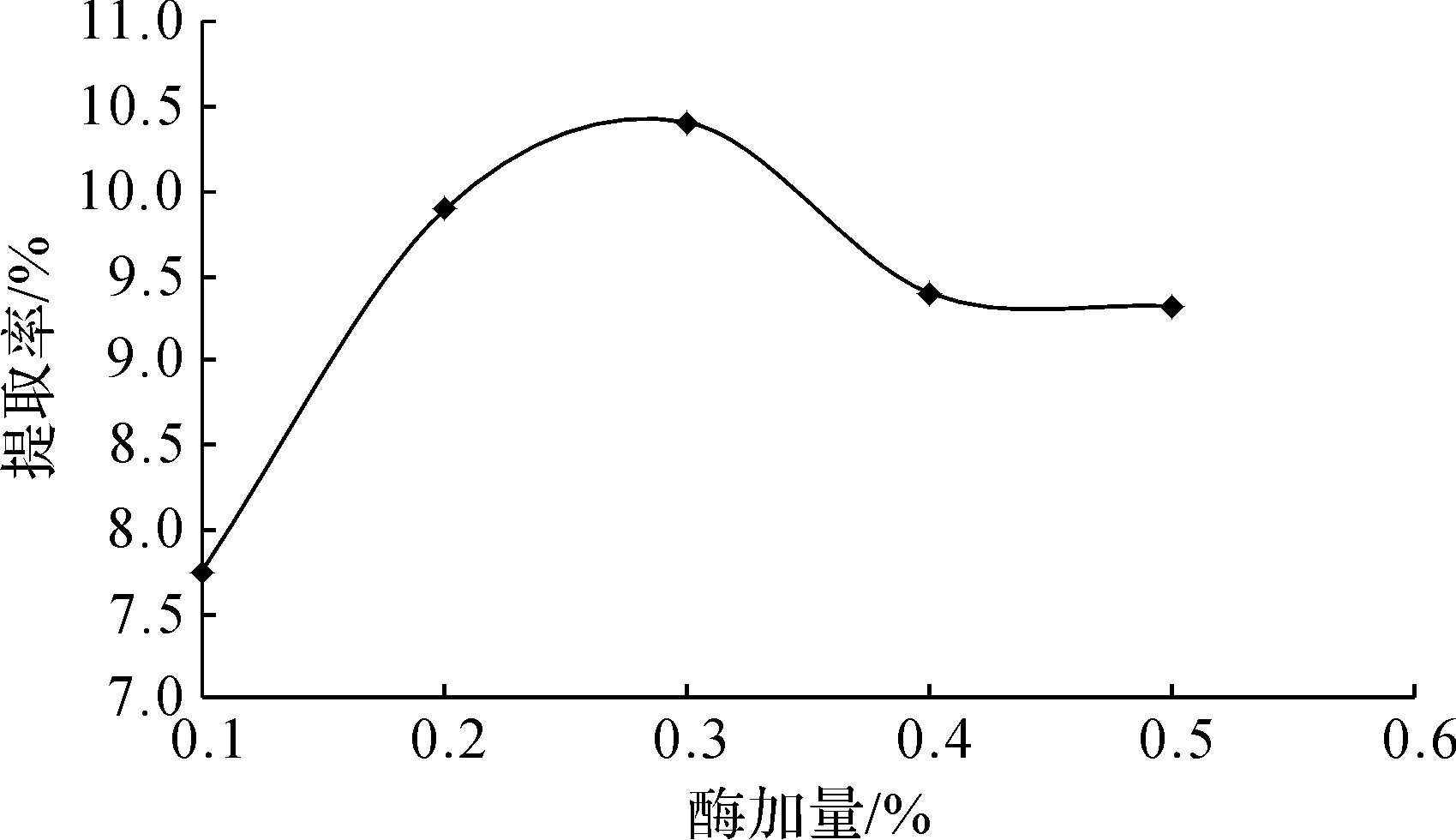
图2 酶加量对三叶青多糖提取率的影响Fig.2 Effect of enzyme dosage on extraction yield of polysaccharide from radix tetrastigmatis hemsleyani
如图2所示,随着酶加量的增加,三叶青多糖提取率增大,这一阶段影响三叶青提取率的主要因素是酶含量。当酶加量达到0.3%时,三叶青多糖提取率达到最大;之后再增大酶加量,三叶青多糖提取率反而有所降低。这是因为此时影响三叶青多糖提取率的主要因素是底物的量,此时酶的用量已达到饱和,没有多余的底物再有机会与纤维素酶反应;而且酶含量过高,也可能会抑制酶的作用。因此,酶加量取0.3%。
3.2.2 酶解温度对三叶青多糖提取率的影响
如图3所示,随着温度的升高三叶青多糖的提取率不断增大,当温度达到60 ℃时多糖提取率达到最大值,随后便呈下降趋势。温度对酶促反应的影响具有两面性,当温度较低时,随着温度的升高,活化分子数量增加,酶促反应速率加快,此时多糖提取率升高;当达到最适温度后,继续升高温度,导致酶蛋白变性失活,酶促反应速率变慢,多糖提取率随之降低。因此,酶解温度选60 ℃。
3.2.3 酶解时间对三叶青多糖提取率的影响
如图4所示,随着酶解时间的增加,三叶青多糖提取率明显增大,当达到60 min时,多糖提取率达到最大值,说明此时酶和底物已经充分反应。随后出现下降趋势,可能的原因有两种:一是由于酶解时间过长导致多糖结构发生改变使得测得的提取率降低;二是整个酶解反应过程中一些非多糖类可溶性物质不断析出,干扰了多糖的测定,也导致多糖提取率降低。因此,酶解时间选60 min。
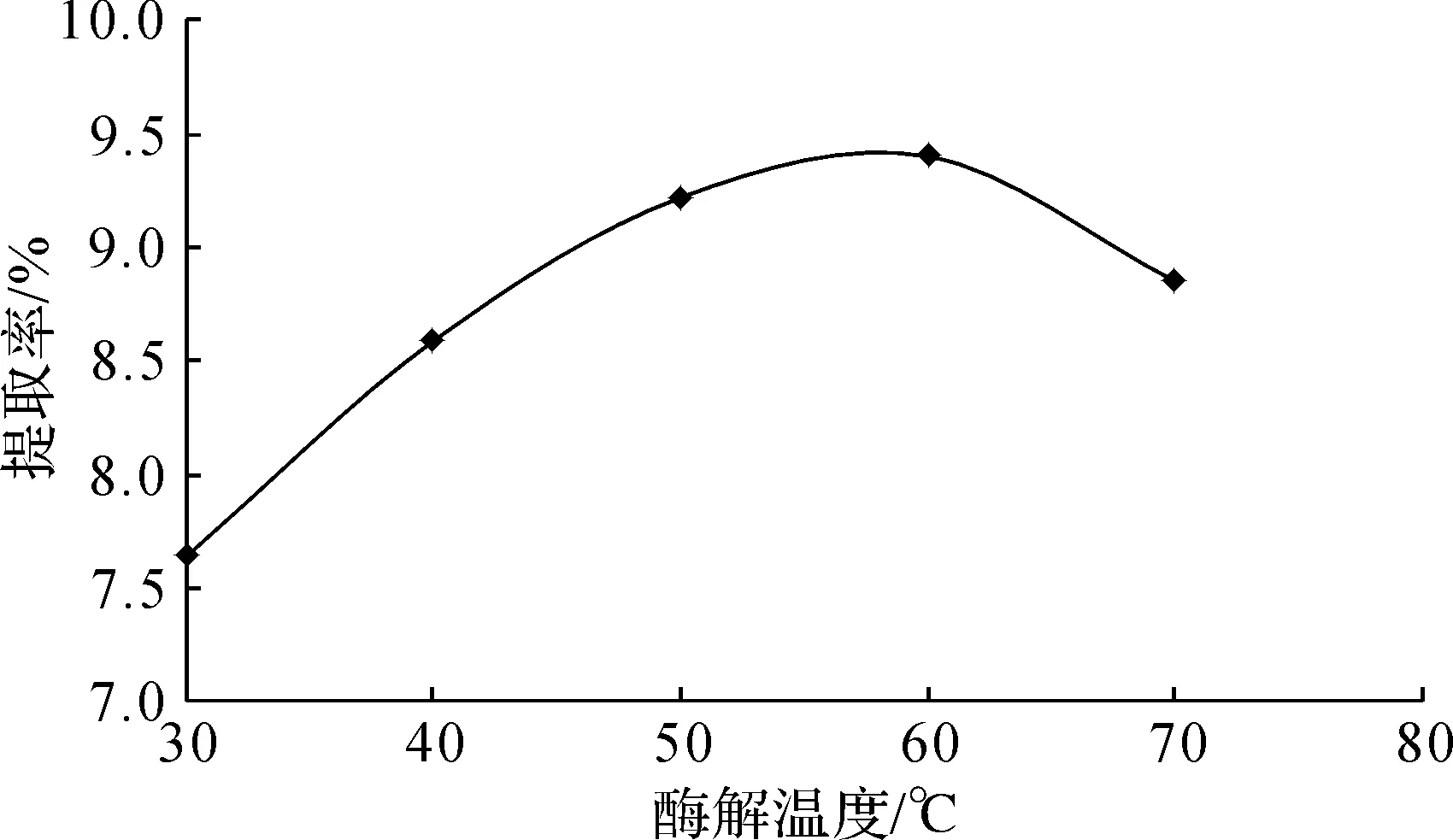
图3 酶解温度对三叶青多糖提取率的影响Fig.3 Effect of extraction temperature on extraction yield of polysaccharide from radix tetrastigmatis hemsleyani

图4 酶解时间对三叶青多糖提取率的影响Fig.4 Effect of extraction time on extraction yield of polysaccharide from radix tetrastigmatis hemsleyani
3.2.4 水料比对三叶青多糖提取率的影响
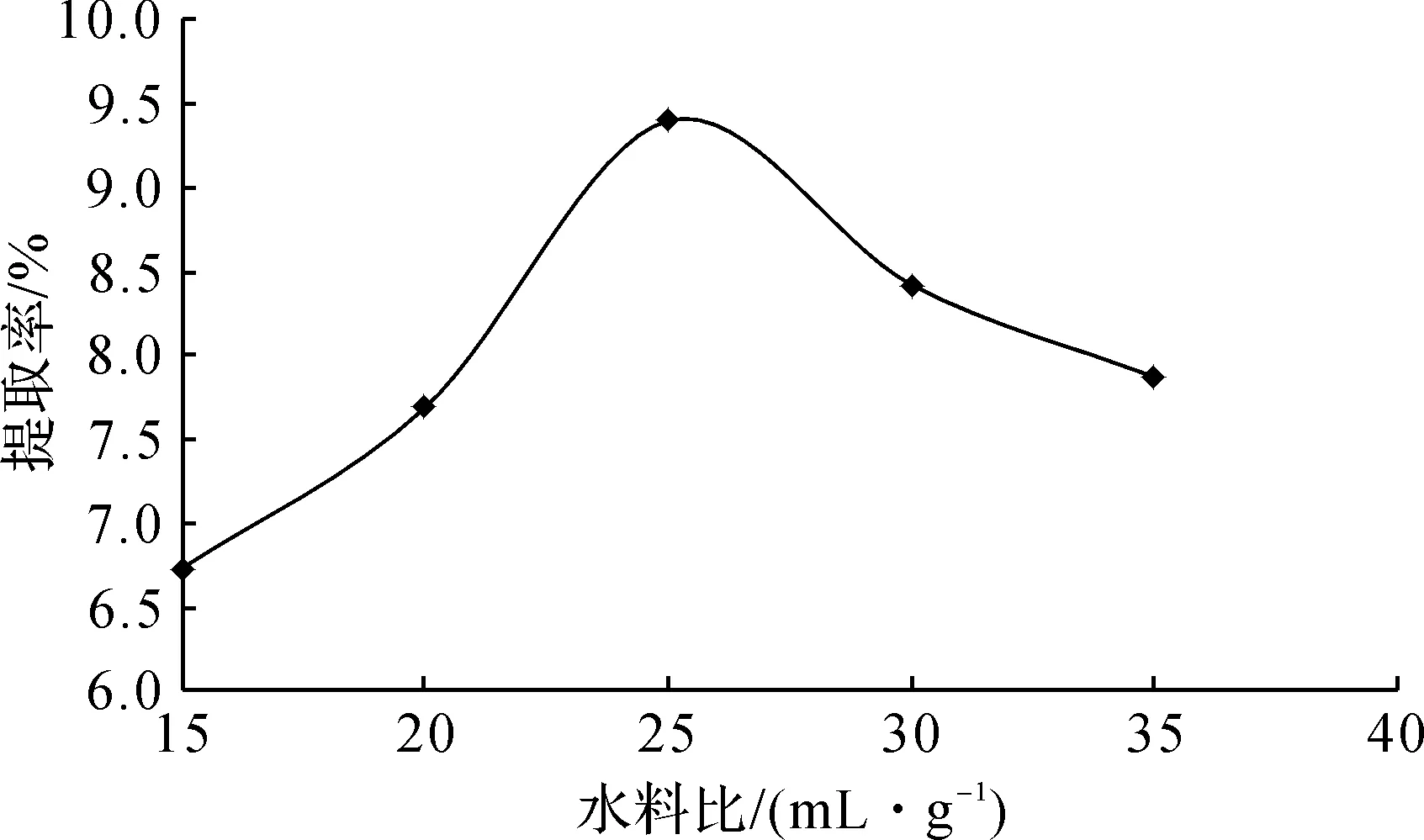
图5 水料比对三叶青多糖提取率的影响Fig.5 Effect of water to material ratio on extraction yield of polysaccharide from radix tetrastigmatis hemsleyani
如图5所示,当水料比为15∶1~25∶1时,随着水料比的增大,三叶青多糖提取率显著增大。当水料比超过25∶1时,多糖提取率逐渐降低,这是因为水料比过高导致底物浓度和酶浓度均降低,酶促反应速率减慢,多糖提取率随之降低。因此,水料比取25∶1。
4 响应面法优化三叶青多糖提取工艺
4.1 响应面试验设计
在单因素试验结果的基础上,应用Box-Behnken中心组合试验设计原理,以酶加量A、酶解温度B、酶解时间C、水料比D为自变量,以-1、0、1代表自变量水平,设计四因素三水平的响应面分析试验,具体因素与水平见表2。

表2 三叶青多糖提取因素与水平Table 2 Factors and levels of polysaccharide extraction from radix tetrastigmatis hemsleyani
4.2 响应面优化试验结果与分析
4.2.1 响应面试验方案及结果
根据表2的设计进行了29次试验,具体方案及结果见表3。
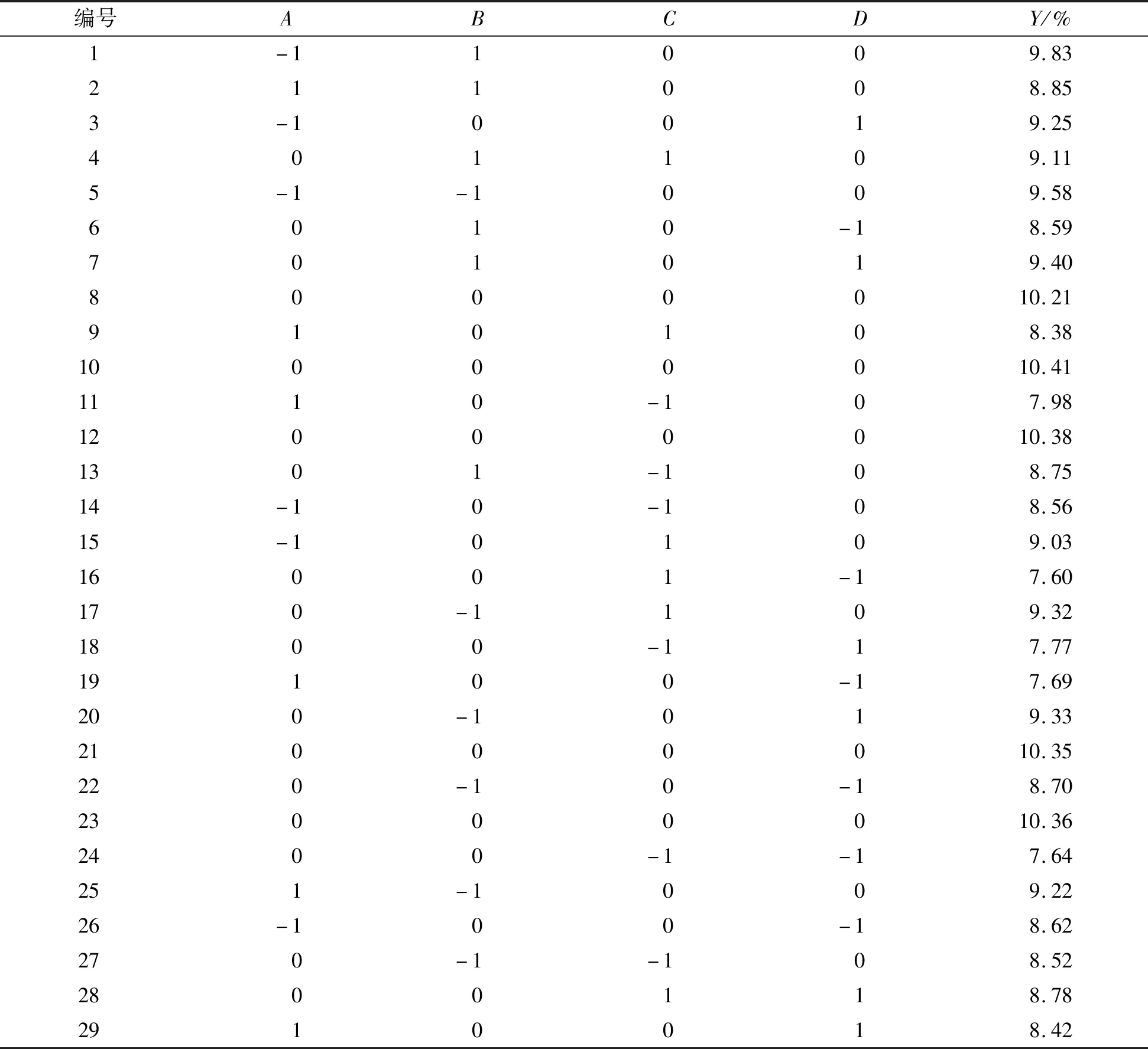
表3 响应面试验方案及结果Table 3 Scheme and results of response surface experiment
对表3试验数据进行回归分析,得到三叶青多糖提取率的二次多项回归方程为:
(2)
4.2.2 模型方差分析
采用Design-Expert 8.0.6软件对表3的数据进行回归分析,方差分析结果见表4。
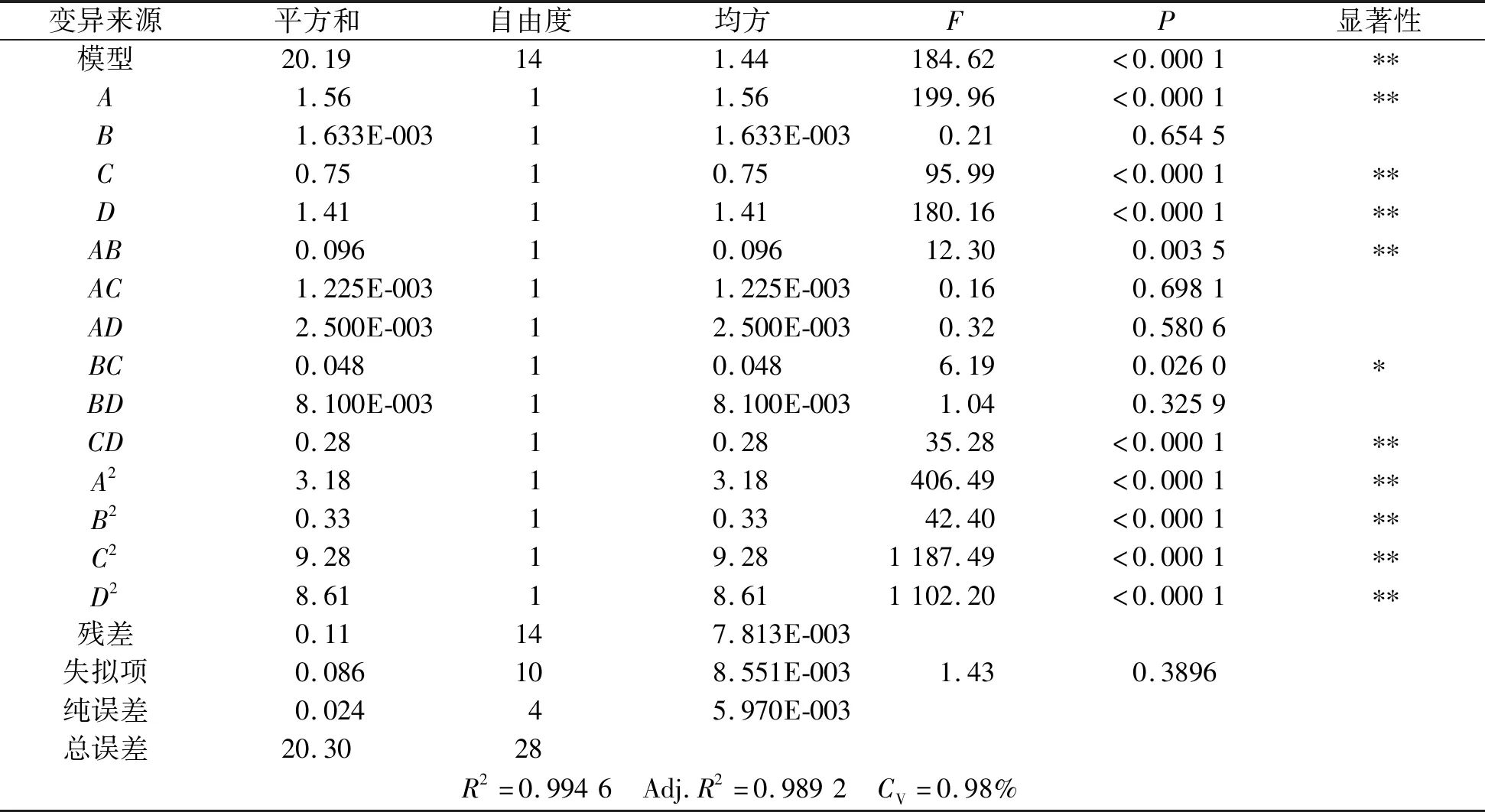
表4 方差分析表Table 4 Analysis of variance
注:*表示P<0.05,差异显著;**表示P<0.01,差异极显著。
表4中,该回归模型的P值小于0.000 1,说明模型极其显著。失拟项P值(0.389 6)大于0.05,说明失拟项检验不显著,该模型的模拟很精确。由该回归模型的总决定系数R2为0.994 6可知,预测值和真实值之间具有高度的相关性;由回归模型的调整决定系数Adj.R2为0.989 2可知,该模型拟合程度较好,试验误差小;CV为变异系数,表示试验的精确度,其值越小,试验可靠性越高,此试验CV为0.98%,较低,说明试验操作可靠。综合以上分析,该模型与实际情况拟合很好,可用于分析和预测三叶青多糖提取率的实际情况。从表中还可以看出,一次项A、C、D和二次项AB、CD、A2、B2、C2、D2都对三叶青多糖提取率影响极显著,而二次项BC影响显著。在选取的因素水平范围内,各因素对三叶青多糖提取率的影响大小次序为:酶加量>水料比>酶解时间>酶解温度。
4.2.3 响应面图分析
图6为各因素交互影响的响应面图,从图中可以较为直观地看出单因素对三叶青多糖提取率的影响以及单因素之间交互影响的强弱关系。图中因素的变化曲线越陡,则其对多糖提取率的影响越大;若两因素之间的等高线呈椭圆形,则说明两因素之间存在着较强的交互作用,呈圆形则说明交互较弱。从图中还可以看出,两因素之间的等高线均呈椭圆形,说明两因素之间均有着较强的交互作用。变化最为剧烈的是酶加量曲线,这说明酶加量对多糖提取率的影响最大;变化较为剧烈的是水料比曲线和酶解时间曲线,说明这两种因素对多糖提取率的影响较大,但不如酶加量;而变化最不明显的是酶解温度曲线,表示此因素随着水平的变化,对多糖提取率的影响最不明显。以上结论跟方差分析表中的数据完全吻合。
4.3 验证试验
对式(2)求一阶偏导数,并使之等于0,即:
(3)
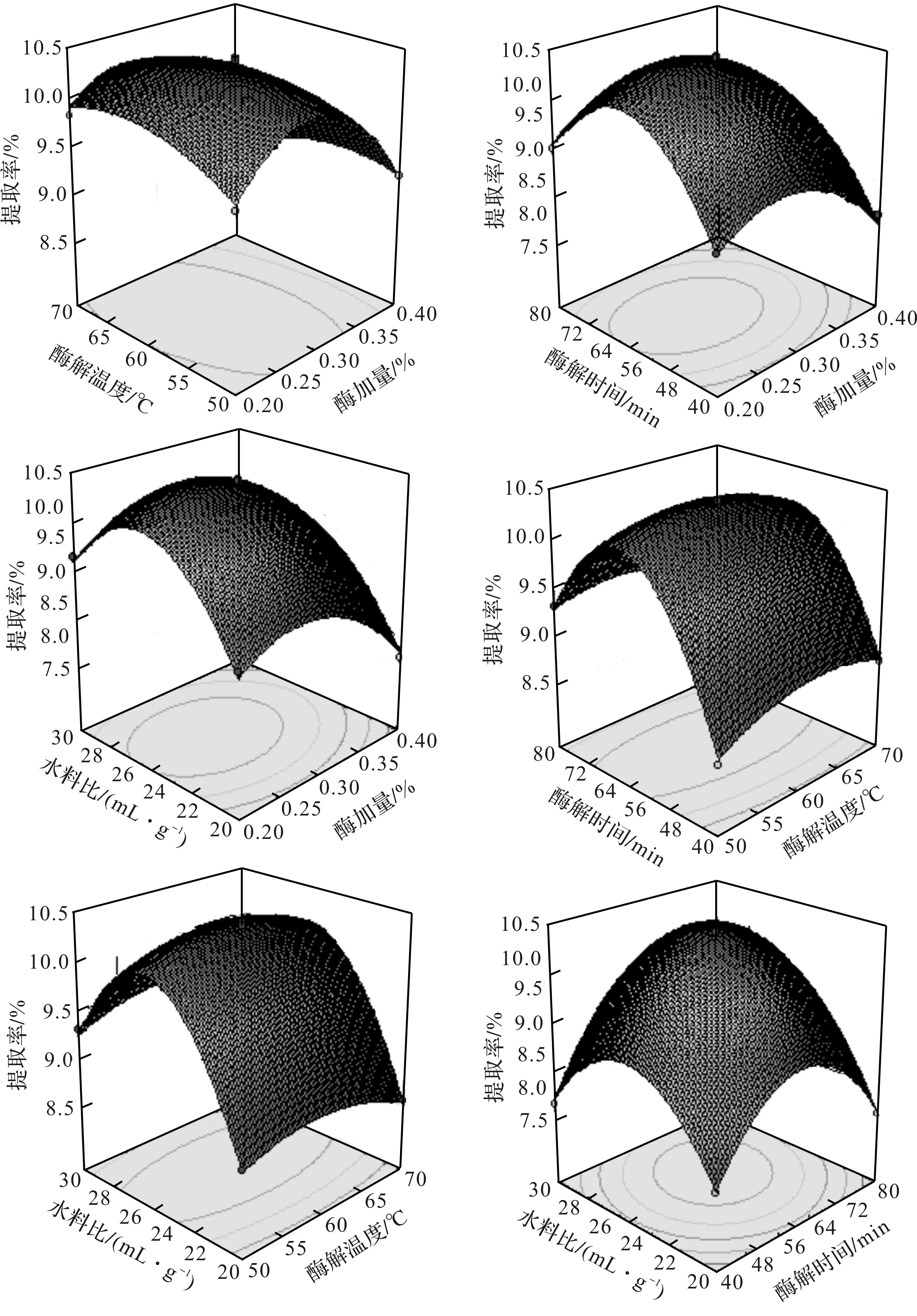
图6 不同因素组合对多糖提取率的影响Fig.6 Effects of different factors on extraction rate of polysaccharide
由式(3)计算可得:A=-0.261 7,B=0.051 6,C=0.121 0,D=0.159 7。再经过换算得到最佳提取条件为:酶加量0.273 8%,酶解温度60.516 ℃,酶解时间62.42 min,水料比25.798 5∶1,理论上在此条件下可得到的三叶青多糖提取率是10.43%。考虑到实际操作的可行性,最终修改为:酶加量0.274%,酶解温度60.5 ℃,酶解时间62.4 min,水料比25.8∶1。称取3份三叶青粉末,均按上述所得的最佳提取条件进行酶法提取多糖,试验结果见表5。
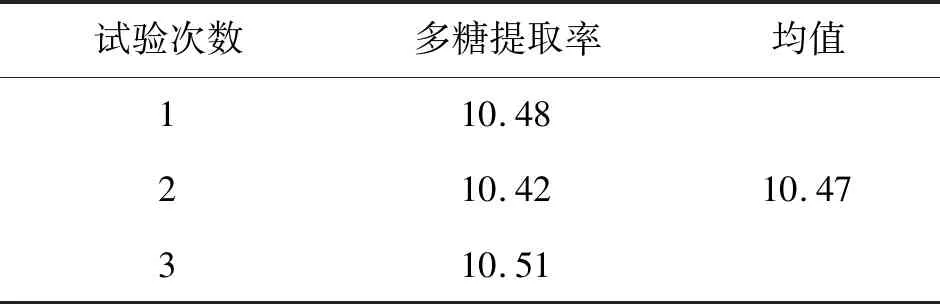
表5 最佳提取条件下的多糖提取率Table 5 Extraction rate of polysaccharide under the optimum extraction conditions %
3次平行试验得到的实际提取率均值为10.47%,与理论最佳提取率10.43%相比,相对误差为0.38%,说明运用响应面法优化得到的工艺条件准确可靠,能够客观真实地反应各因素对三叶青多糖提取率的影响。
5 结 语
本文采用纤维素酶法提取三叶青中的多糖,考察了酶加量、酶解温度、酶解时间及水料比4个因素对多糖提取率的影响。通过单因素试验和响应面试验设计,明确了各因素对三叶青多糖提取率的影响大小次序为:酶加量>水料比>酶解时间>酶解温度。最佳提取工艺条件为:酶加量0.274%,酶解温度60.5 ℃,酶解时间62.4 min,水料比25.8∶1,此条件下的多糖实际提取率为10.47%。相比文献[16-17],酶法提取三叶青多糖用时较短,提取率却更高。本试验得出的三叶青多糖提取优化工艺可为研究与开发三叶青多糖提供试验基础。

