二十二碳六烯酸微藻油乳状液稳定性的测定方法和影响因素
梁井瑞,李 伟,王 剑,王 飞,王占一,冯晓慧,杜 健*
(枣庄学院食品科学与制药工程学院,山东 枣庄 277160)
二十二碳六烯酸(docosahexaenoic acid,DHA)是一种人体必需的多不饱和脂肪酸,具有益智健脑等作用,常作为婴幼儿配方奶粉和食品添加剂[1-4]。来源于微藻的DHA因结构简单、易吸收等优点被广泛利用[5-8],但易氧化变质的特点严重限制了其在食品生产中的应用[3,9-10],常用的解决方式是将DHA以微胶囊包埋的方式添加在产品中,以提高其氧化稳定性[11-13]。
微胶囊包埋是利用壁材制成的连续薄膜将芯材(液滴状的DHA油脂)包裹成微米到毫米级微小粒子的过程[14]。微胶囊化技术较多,主要有复合凝聚技术、喷雾技术、共挤出技术以及真空冷冻干燥技术等,技术的选择主要取决于壁材与芯材的物理化学性质和微粒尺寸等。另外,一些前沿技术如微流控技术和分子包埋技术也已应用于活性物质的包埋中[15]。喷雾干燥技术因成本低廉、工艺简单、易于产业化的特点而被广泛采用[16-17]。
喷雾干燥法制备的微胶囊产品品质不仅取决于喷雾干燥工艺,还与乳状液的稳定性紧密相关[18-19]。DHA乳状液是一种典型的水包油(O/W)型食品,属于热力学不稳定体系[20-21]。乳状液稳定性与界面张力、油-水界面膜、液滴粒径和连续相黏度等密切相关[22]。微胶囊化过程中壁材的组成、结构和芯材用量(液滴粒径)等都会明显影响乳状液的稳定性,进而影响微胶囊化效率和微胶囊颗粒的理化性质及贮存期[16,23]。常用乳状液稳定性的测定方法有光学法、电荷分布法、流变法、界面吸附法、微观结构法和直观观察法等。但是流变法、界面吸附法和微观结构法存在操作复杂、仪器昂贵或破坏乳状液原有结构等缺点[24]。本实验选用DHA微藻油为原料,研究其在微胶囊化过程中乳状液稳定性和影响因素。
1 材料与方法
1.1 材料与试剂
DHA微藻油(DHA质量分数大于38%) 江苏天凯生物科技有限公司。
辛烯基琥珀酸酯化淀粉(octenyl succinic anhydride modified starch,OSAS)、麦芽糊精(均为食品级)郑州成果添加剂有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 上海绪雅实业有限公司;重铬酸钾、乙醚(均为分析纯) 上海凌峰化学试剂有限公司;乙醇(分析纯) 上海九亿化学试剂有限公司;石油醚(沸程30~60 ℃) 北京长海化工厂;氨水(分析纯) 上海化学试剂有限公司。
1.2 仪器与设备
DJM50L实验型胶体磨 上海东华高压均质机厂;HP-60-60型高压均质机 上海科学技术大学机电厂;YC-015实验型喷雾干燥器 上海雅程仪器设备有限公司;Lambda 25紫外-可见分光光度计 美国珀金埃尔默仪器有限公司;DDS-11C电导率仪 上海精科有限公司;DM1000显微镜 德国Leica公司;Quanta FEG 250扫描电子显微镜 美国FEI公司。
1.3 方法
1.3.1 乳状液制备
为研究壁材组成对乳状液稳定性的影响,设定OSAS在壁材中的质量分数为20%~100%(以20%为梯度);为研究壁材组成对微胶囊性质的影响,设定OSAS在壁材中的质量分数为0~100%(以10%为梯度);与麦芽糊精进行复配后与水混合。40 ℃水浴搅拌10 min。加入质量分数20% DHA微藻油,在40 ℃水浴中继续搅拌5 min后取出。立即将预乳液倒入胶体磨中研磨2 min后取出,倒入高压均质机中进行两步均质,压力分别为30 MPa和5 MPa,均质完成后得到乳状液。
为研究芯材质量对乳状液稳定性的影响,以优化后的OSAS与麦芽糊精配比进行复配,设定DHA微藻油的质量分数为10%~50%(以10%为梯度),按照上述操作制备乳状液。
1.3.2 乳状液稳定性的测定
1.3.2.1 透射光浊度法测定
在时间/外力作用下,乳状液液滴粒径发生变化,透光率也会随之发生变化,以此来衡量乳状液的稳定性。采用0.2 mol/L的重铬酸钾溶液作为参照,利用紫外-可见分光光度计在固定波长下,选取已制备的乳状液,测定其在时间/外力作用前后透光率的变化,来确定乳状液的稳定性,乳状液稳定性参数TESI按公式(1)计算。

式中:T0为初始乳状液透光率;T为时间/外力作用后透光率。
1.3.2.2 电导率法测定
在25 ℃下,利用电导率仪测量乳状液的电导率。乳状液稳定性参数κESI按公式(2)计算。

式中:κ0为初始乳状液的电导率/(S/m);κ为时间/外力作用后的电导率/(S/m)。
1.3.2.3 静置分层法测定
制备好的乳状液置于10 mL(V)具塞比色管(高度H)中,放置于25 ℃水浴保温24 h,在比色管中读取未分层的乳状液高度h(体积V’),根据所得的结果,则乳状液稳定性参数hESI按公式(3)计算。
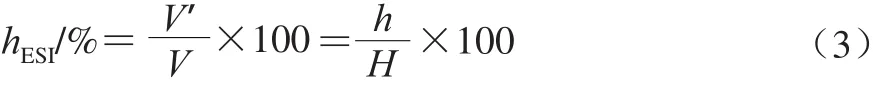
1.3.3 显微镜观察
将制备好的乳状液在25 ℃室温条件下煤油液封保存,每隔一段时间取一定量样品,使用0.1 g/100 mL SDS溶液稀释500 倍体积,显微镜放大125 倍观察乳状液中液滴的变化情况。乳状液是热力学不稳定体系,一段时间后会发生分层、沉降、聚结、絮凝等失稳现象。显微镜下可以很明显地观察到相应的现象。
设定微胶囊壁材中OSAS的质量分数分别为40%和100%,芯材(DHA微藻油)质量分数为20%,固形物质量分数为25%。以此配方进行乳化和微胶囊化之后,进行扫描电子显微镜观察。在扫描电子显微镜样品台上贴上一层双面胶,将少许微胶囊产品撒在双面胶上,吹去多余的粉末,样品喷金,加速电压为15 kV,观察时间尽量短,避免电子束造成的微胶囊产品损伤。
1.3.4 微胶囊的制备
选择OSAS和麦芽糊精形成的复合材料为壁材,将其按不同比例进行乳化,随后进行喷雾干燥包埋DHA微藻油。喷雾干燥过程中控制进风温度180 ℃、出风温度(80±5)℃、风机频率65 Hz。
1.3.5 微胶囊产品的品质检测
1.3.5.1 微胶囊总油质量分数检测
总油质量分数定义为每100 g DHA微胶囊含有的总油脂质量。称取约3 g(m1)DHA微胶囊产品,放置于干燥的三角瓶中,加入20 mL 60 ℃的热水,使样品在三角瓶中充分分散,加入氨水2.50 mL,混合均匀,然后依次加入乙醇、石油醚、乙醚各10 mL,振荡之后,转入分液漏斗中静置,等待其分层后,收集下层液体,用10 mL石油醚萃取2~3 次,滤液合并,置于恒质量的圆底烧瓶(m2)中,45 ℃旋转蒸发除去有机溶剂,65 ℃烘箱中烘至恒质量,置于干燥器中冷却,称质量(m3)。总油质量分数(ωt)计算如公式(4)所示。
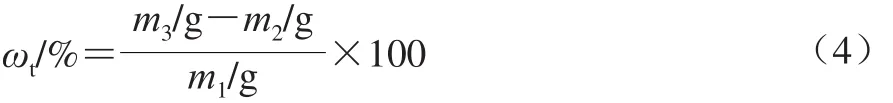
1.3.5.2 DHA微胶囊表面油的提取
表面油质量分数定义为每100 g DHA微胶囊表面吸附的油脂质量。准确称取3 g(m1)的DHA微胶囊产品至干燥的三角瓶中,加入30 mL石油醚,室温振荡1 min,充分萃取,下层液体再用10 mL石油醚洗涤2~3 次,滤液合并,置于恒质量的圆底烧瓶(m2)中,45 ℃旋转蒸发除去有机溶剂,65 ℃烘箱中烘至恒质量,置于干燥器中冷却,称质量(m3)。表面油质量分数(ωs)计算如公式(5)所示。
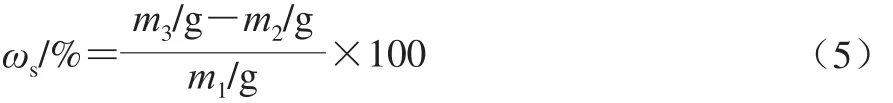
1.3.5.3 浸出油的提取
浸出油指在微胶囊化过程中未能包裹完全或贮藏过程中渗漏出的油脂。准确称取3 g(m1)的DHA微胶囊产品至干燥的三角瓶中,加入30 mL石油醚,室温振荡60 min,充分萃取,下层液体再用10 mL石油醚洗涤2~3 次,滤液合并,置于恒质量的圆底烧瓶(m2)中,45 ℃旋转蒸发除去有机溶剂,65 ℃烘箱中烘至恒质量,置于干燥器中冷却,称质量(m3)。浸出油质量分数(ωe)计算如公式(6)所示。
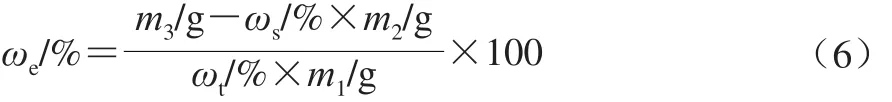
1.3.5.4 微胶囊化产品效果评价
通常用微胶囊化效率(包埋率)来评价微胶囊化效果,计算如公式(7)所示。
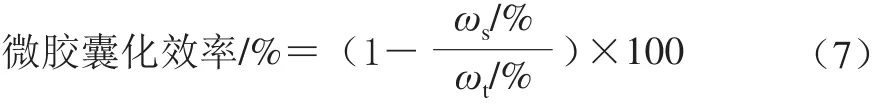
1.3.6 油脂过氧化值的测定
1.3.6.1 微胶囊中油脂的提取
准确称取10 g微胶囊样品置于500 mL具塞三角瓶中,加入50 mL蒸馏水,搅拌溶解;加入50 mL乙醇、30 mL乙醚以及30 mL石油醚,振荡2 min,转入分液漏斗,静置分层;取下层液体,用20 mL石油醚萃取2 次,合并滤液,转移至已恒质量的250 mL圆底烧瓶中;使用旋转蒸发仪45 ℃下蒸干,即得到微胶囊中的油脂。
1.3.6.2 过氧化值的测定
参考GB/T 5009.37—2003《食用植物油卫生标准的分析方法》。将破壁提取的油脂(m)置于250 mL碘瓶中,加入30 mL三氯甲烷-冰醋酸(2∶3,V/V)混合液,使得试样完全溶解;加入1 mL饱和碘化钾溶液,紧密塞好瓶盖,轻轻振摇0.5 min,然后在暗处放置3 min;取出后加入100 mL水,摇匀,立即用硫代硫酸钠标准滴定溶液滴定,至淡黄色时,加1 mL淀粉指示液,继续滴定至蓝色消失为终点;在同样条件下用水和Na2S2O3标准滴定溶液做空白实验,试样过氧化值(peroxide value,POV)按式(8)计算,单位为每千克油脂中含有的过氧化物的质量当量(meq/kg)。
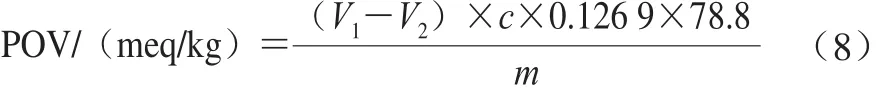
式中:m为提取的总油脂的质量/kg;V1为试样消耗硫代硫酸钠标准滴定溶液体积/mL;V2为试剂空白消耗硫代硫酸钠标准滴定溶液体积/mL;c为硫代硫酸钠标准滴定溶液的浓度/(mol/L);0.126 9为与1.00 mL Na2S2O3标准滴定溶液(c(Na2S2O3)=1.000 mol/L)相当的碘的质量/g;78.8为换算因子。
1.4 数据处理与分析
采用Microsoft Excel 2013软件处理并分析数据,以 ±s表示,采用Origin 8.6软件作图。
2 结果与分析
2.1 检测参数对乳状液稳定性的影响
2.1.1 稀释试剂对乳状液稳定性的影响
乳状液原液浓度过高,必须经过一定程度的稀释才能达到透光测量的要求。SDS对乳状液有静电排斥作用,有快速稳定的效果[25]。为检验SDS作为稀释试剂的效果,将制备好的乳状液(固形物质量分数25%)用0.1 g/100 mL SDS溶液和水分别稀释500 倍,结果如图1所示。
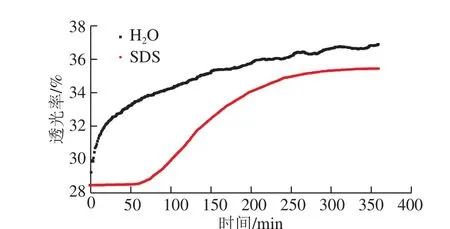
图1 SDS对乳状液稳定性的影响Fig. 1 Effect of SDS on emulsion stability
乳状液经水稀释之后,透光率增加明显,尤其在稀释的初期(25 min内),乳状液的透光率从28.4%增加到32.4%。可见,经水稀释之后,乳状液稳定性明显下降。而乳状液经0.1 g/100 mL SDS稀释之后,在一段时间内(60 min)透光率基本维持不变,SDS对乳状液的稳定性有非常明显的提升。这是因为在乳状液中,由于静电排斥作用的存在,SDS可以迅速“冻结”乳状液的粒径分布[22]。因此,SDS可以作为乳状液的稳定剂,使乳状液在测量期间性质基本保持不变。
2.1.2 稀释倍数对乳状液稳定性的影响
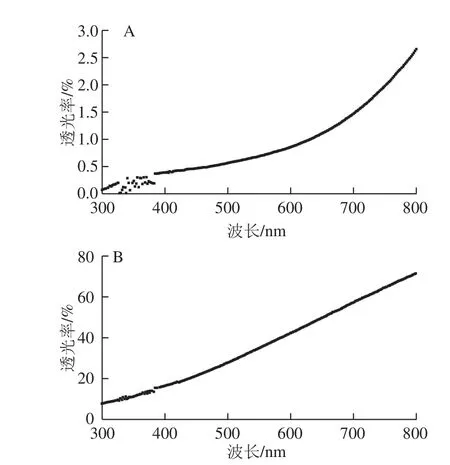
图2 稀释100 倍(A)和500 倍(B)体积乳状液的透光率Fig. 2 Transmittance of emulsion after dilution by 100 (A) and 500 (B) times
制备好的乳状液(固形物质量分数25%)用0.1 g/100 mL的SDS溶液分别稀释100 倍和500 倍,进行全波长扫描,检测稀释后乳状液的透光率。
如图2所示,乳状液经100 倍稀释之后,透光率在较低波长处(300~400 nm)的波动较为明显,且在全波长扫描范围内(300~800 nm),透光率都小于3%,说明乳状液的透光度非常低,无法进行测定。
用0.1 g/100 mL SDS溶液稀释500 倍之后,乳状液的透光率得到明显提升,在650 nm波长处的透光率达到50%,可以满足检测要求。在全波长扫描范围内,透光率基本没有波动,稳定性较高。而且,测定波长选在550~650 nm之间可以同时满足仪器灵敏度要求,后续测定乳状液稳定性的实验均选取600 nm波长处进行乳状液透光率的检测。
2.1.3 检测时间对乳状液稳定性的影响
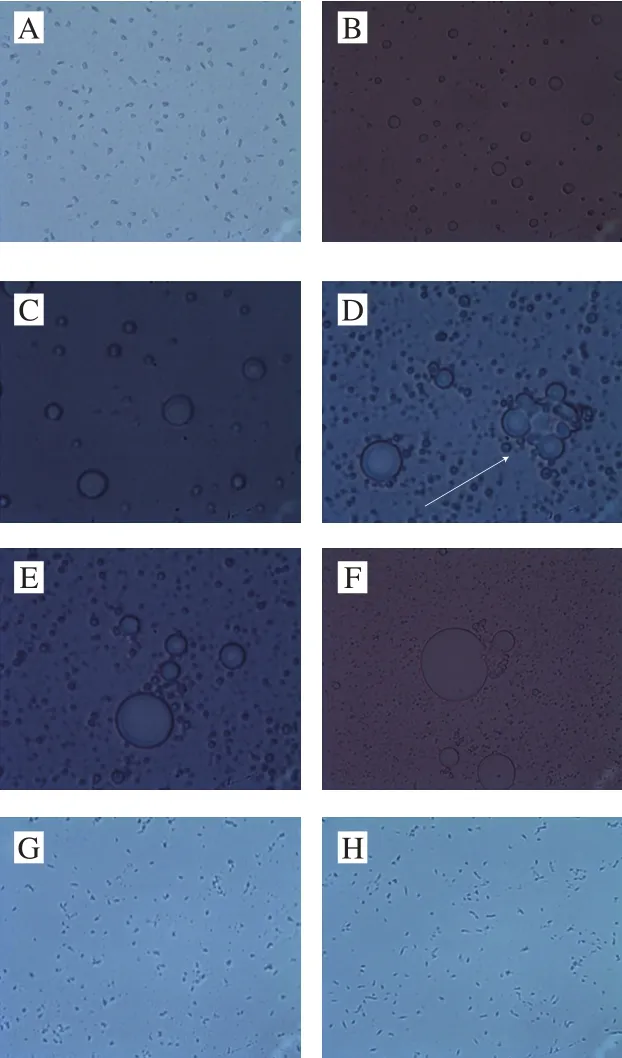
图3 乳状液在制备0(A)、1(B)、2(C)、4(D)、6(E)、12(F)、24 h(G)和36 h(H)时的显微镜图像(×125)Fig. 3 Microphotographs of emulsion examined at 0 (A), 1 (B), 2 (C),4 (D), 6 (E), 12 (F), 24 (G) and 36 h (H) (× 125)
采用显微镜观察的方法分析检测时间对乳状液稳定性的影响。在乳状液制备的过程中,微胶囊的配方为:OSAS与麦芽糊精的质量比2∶3,DHA微藻油质量分数20%,固形物质量分数25%。将以此为配方制备的乳状液在显微镜下放大125 倍,每隔一段时间进行观察,结果如图3所示。
乳状液是热力学不稳定体系,在制备完成之后,乳状液就开始发生聚集沉降分层等破坏性变化(图3A)。在乳状液制备完成的初期(6 h之内),聚集分层进行得非常迅速,图中可见明显的变化。在制备完成的前2 h之内,显微镜图像明显可见大小不均匀的油滴出现(图3B、C)。在制备完成的第4小时,如箭头所指,显微镜下明显可见小油滴的聚集(图3D)。在第6小时仍能观察到由小油滴到大油滴的聚集现象,但是小油滴的数量已经明显少于第4小时时的(图3E)。在乳状液制备的第12小时,小油滴在显微镜视野内基本不可见(图3F)。在第24小时体系基本到达分层后的亚稳态(图3G),24 h之后,乳状液的变化不明显(图3H)。故设定测定透光率等的时间为0 h(乳状液制备完成)和24 h(分层后的亚稳态时期),用0、24 h两个时间点的透光率的变化趋势来衡量乳状液的稳定性。
2.2 微胶囊配方对乳状液稳定性影响
2.2.1 壁材对乳状液稳定性的影响
壁材的组成和结构决定了微胶囊产品的保护和控制释放的效率,选择最合适的壁材是开发微胶囊的重要步骤[26]。据报道,没有一种单独的材料能够具备理想壁材的所有特性,复合壁材能够明显提高微胶囊化效率[27]。OSAS是由淀粉链上的羟基与烯基琥珀酸酐(octenyl succnic anhydride,OSA)酯化形成的(图4)。用其进行微胶囊化制成的产品安全性高,已经广泛用于美欧和亚太的很多国家。麦芽糊精具有在高固体浓度下黏度低、溶解性高、抗氧化性强、成本较低等优点,也广泛用作微胶囊化的壁材[28]。
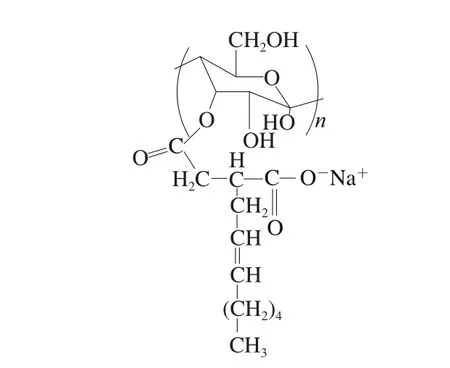
图4 OSAS结构图Fig. 4 Chemical structure of octenyl succnic anhydride starch
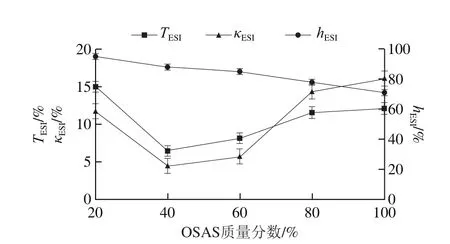
图5 复配壁材组成对乳状液稳定性的影响Fig. 5 Effect of wall material composition on emulsion stability
由图5可知,在乳状液稳定性的检测方法中,透光率的变化与电导率的变化基本一致。随着OSAS质量分数增加,稳定性参数呈先下降后再上升的趋势。当OSAS质量分数从20%提高到40%时,透光率从15.0%下降到6.4%,乳状液稳定性得到明显提升。这是由于在淀粉分子中引入了疏水性的OSA基团,使其具有了两亲性,能够在O/W界面形成较厚的吸附层,从而阻止油滴在乳液中重新聚结,增加乳化体系的稳定性。OSAS质量分数从20%提高到40%时,吸附在油-水界面的OSAS质量分数也相应增加,形成的黏弹性的界面膜更稳定。另外,OSAS属于高分子乳化剂,同时具有乳化和增稠的作用。如Stokes定律所述,乳状液的分层和沉降速率与乳状液的黏度成反比,与两相间的密度差成正比。OSAS质量分数从20%提高到40%时,体系黏度增加,乳状液分层/沉降速率下降,减少了油滴的聚结,从而使乳状液的稳定性得到提升。
当OSAS质量分数提高到80%时,透光率提高至11.6%,乳状液稳定性较初始下降(图5)。这是由于OSAS质量分数过高,未吸附的疏水基团与已吸附的基团发生交联,导致絮凝聚结,继而沉降分层。在OSAS中,葡萄糖单元上的羟基在水中容易形成氢键,这会造成淀粉分子重新聚集成致密不溶的淀粉分子微晶束,导致沉淀出现。此外,液滴表面覆盖不紧密,邻近液滴之间的OSAS链也会发生搭桥现象,致使沉淀发生[29]。因此,当OSAS质量分数升高至一定程度,乳状液的稳定性会明显下降。
与透射光浊度法和电导率法不同,静置分层法测定hESI一直呈现下降的趋势,可能由于方法本身较粗糙所致。由于测试体系(10 mL)过小,分层界面不清晰,导致测量误差较大;而且,乳状液体系属高浓度体系,部分壁材不溶,交联聚结分层。当OSAS的质量分数提高时,导致静置分层体积提高,稳定性参数下降。
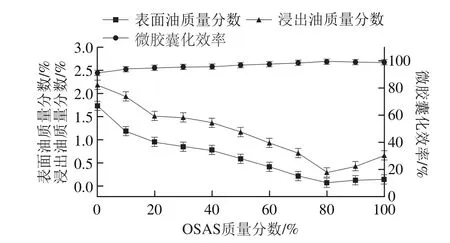
图6 复配壁材组成对微胶囊性质的影响Fig. 6 Effect of wall material composition on emulsion stability
将上述实验各乳状液喷雾干燥后得到的微胶囊的性质,如表面油质量分数、浸出油质量分数和微胶囊化效率进行检测分析,得到壁材和辅材的添加比例对微胶囊性质的影响,如图6所示。表面油是指附着在微胶囊产品表面的油脂,因为一些因素未被包埋在微胶囊囊壁内。由于在微胶囊表面,这部分油脂完全跟空气接触,非常容易氧化,稳定性明显低于原料DHA油,所以,提升微胶囊化效率和降低表面油质量分数是微胶囊化的目标。另外,微胶囊中可能存在一些缺陷,如空隙、裂缝和破损等因素会造成油脂渗漏,造成外界的氧气进入微胶囊内部,氧化囊内的油脂。一般微胶囊的缺陷可以通过量化的浸出油质量分数来表示,浸出油质量分数可以通过有机溶剂浸提有缺陷的微胶囊获得。
如图6所示,当OSAS质量分数为20%时,微胶囊表面油质量分数和浸出油质量分数分别为0.9%和1.5%,产品性质已达到行业标准(SC/T 3505—2006《鱼油微胶囊》)的要求,此时微胶囊化效率达到95.1%。随着OSAS质量分数的增加,微胶囊的表面油、浸出油质量分数均有所降低,微胶囊化效率不断增加。当OSAS质量分数为80%时,微胶囊表面油和浸出油质量分数达到最低,分别仅有0.093%和0.32%。当OSAS质量分数大于80%时,表面油、浸出油质量分数略有增加,但仍然能够满足SC/T 3505—2006的要求。

图7 不同壁材组成的DHA微藻油微胶囊化的超微结构Fig. 7 Ultrastructure of microencapsulated DHA-enriched microalgae oil with different wall materials
由图7可知,微胶囊化后圆形液滴表面形成一层囊膜,最终形成近球形的产品。壁材中OSAS质量分数为40%,即m(OSAS):m(麦芽糊精)为2∶3时,微胶囊化后形成的产品表面比较光滑,外观无明显的缺陷,包埋效果较好(图7A)。当仅使用OSAS作为壁材时,微胶囊化产品表面的褶皱均明显增多,包埋效果变差。可见,壁材中OSAS含量明显影响微胶囊化的包埋效果和微胶囊产品品质。
综合考虑OSAS和麦芽糊精的比例对乳状液体系稳定性和微胶囊产品性质的影响,以及其成本,将微胶囊配方中壁材基本确定为m(OSAS)∶m(麦芽糊精)为2∶3。
2.2.2 芯材对乳状液稳定性的影响
按m(OSAS)∶m(麦芽糊精)为2∶3,以不同质量分数的微藻油为芯材进行乳化和喷雾干燥微胶囊化。微藻油质量分数对乳状液稳定性的影响如图8所示。
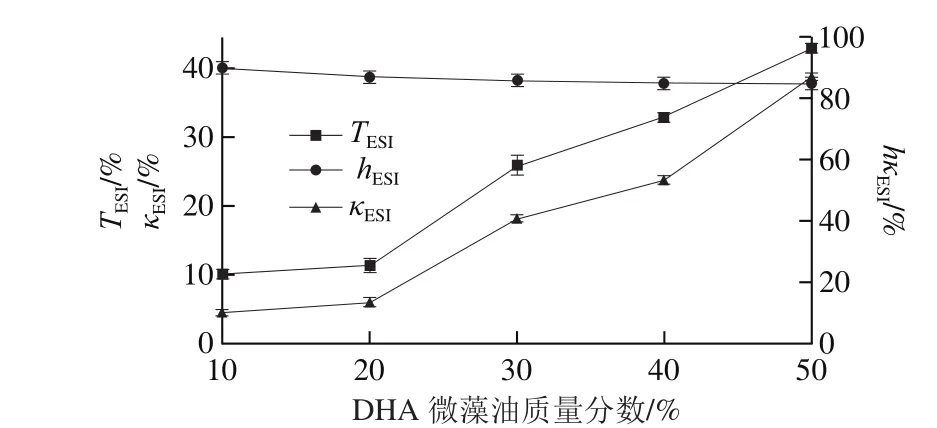
图8 DHA微藻油质量分数对乳状液稳定性的影响Fig. 8 Effect of DHA-enriched oil concentration on the stability of microencapusules
由图8可知,微藻油质量分数从10%提高至20%时,透光率稳定性参数从10.2%提高到11.4%,电导率稳定性参数从5.2%提高到6.9%,可见乳状液稳定性变化不明显。但是微藻油质量分数高于20%时,透光率和电导率稳定性参数都明显提高,体系的稳定性急剧下降,可见芯材的质量分数极大地影响乳状液的稳定性。这是因为在乳化剂含量维持不变的情况下,乳状液的总界面面积也会随油质量分数增加而增加,造成界面层厚度下降,降低乳状液的稳定性。而且芯材的增加会加快局部小油滴聚结,造成乳状液稳定性下降。
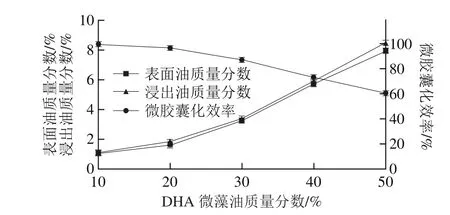
图9 DHA微藻油用量对微胶囊性质的影响Fig. 9 Effect of DHA-enriched oil concentration on properties of microencapusules
微藻油质量分数对微胶囊性质的影响如图9所示,提高芯材的质量分数,会造成微胶囊的表面油和浸出油质量分数明显提高,微胶囊化效率下降。而且,随着微藻油质量分数的提高,表面油和浸出油质量分数提升以及微胶囊化效率下降更为明显。这是由于芯材质量分数增加,喷雾干燥后制备的微胶囊壁厚度和致密度会随之降低。当水分蒸发,这些水分很容易透过不够致密的囊壁到达壁外。而且,囊壁太薄,微胶囊容易干裂,导致芯材外漏,使产品表面油和浸出油质量分数升高,微胶囊化效率降低。
根据以上结果,OSAS和麦芽糊精包埋DHA微藻油体系芯材质量分数低于20%,得到的微胶囊产品可以达到SC/T 3505—2006的要求。
2.2.3 固形物质量分数的影响
根据上述结果,将壁材中OSAS与麦芽糊精的质量比确定为2∶3,芯材(DHA微藻油)质量分数为20%。以此条件进行乳化和微胶囊化之后,分析固形物质量分数对乳状液稳定性的影响,如图10所示。
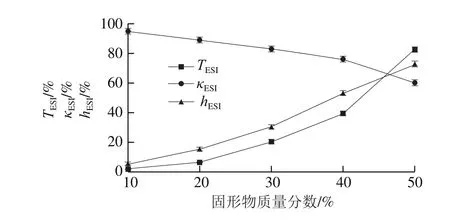
图10 固形物质量分数对乳状液稳定性的影响Fig. 10 Effect of total solid content on emulsion stability
随着总固形物质量分数的增加,透光率与电导率稳定性参数明显提高,说明乳状液的稳定性下降。这是由于提高了总固形物质量分数,OSAS相对用量升高,未吸附的斥水基与已吸附的基团发生交联,导致絮凝聚结,从而发生沉降分层,明显降低乳状液的稳定性。
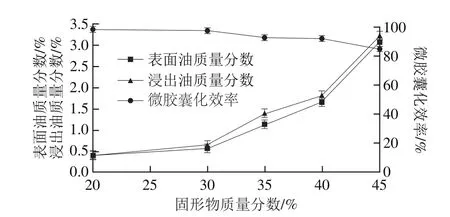
图11 固形物质量分数对微胶囊性质的影响Fig. 11 Effect of total solid content on properties of microencapusules
固形物质量分数对微胶囊性质的影响见图11,当固形物质量分数低于30%时,表面油、浸出油质量分数及微胶囊化效率变化均较小;但当固形物质量分数高于30%时,表面油、浸出油质量分数明显增加,微胶囊化效率明显下降。固形物质量分数过低,喷雾干燥时,需要蒸发掉较多的水分,导致能耗需求较高;适当提高固形物质量分数,可以减小芯材的损失,提高微胶囊化油脂的微胶囊化效率。固形物质量分数增加会造成微胶囊产品颗粒增大、比表面积降低,使得其与光、热、氧、水分等外界不良因素的直接作用面积减小,从而使得微胶囊的稳定性得到提高,但是,固形物质量分数过高导致乳状液黏度过高、流动性差,两相均质效果差,物料在未雾化前停滞时间较长,使得低沸点芯材的损失增加,且容易造成喷雾干燥设备喷嘴堵塞,微胶囊干燥困难,包埋率下降等问题。故在保证微胶囊生产工艺的情况下,适当提高固形物质量分数有利于提高微胶囊产品的质量。
OSAS乳液是典型的“高浓低黏”流体,喷雾干燥固形物质量分数可高达45%。根据以上结果,结合SC/T 3505—2006要求分析可知,固形物质量分数低于33%得到的微胶囊产品品质可以达到标准要求,且DHA含量和微胶囊产品品质较高。
2.3 微胶囊化对DHA微藻油氧化稳定性的影响
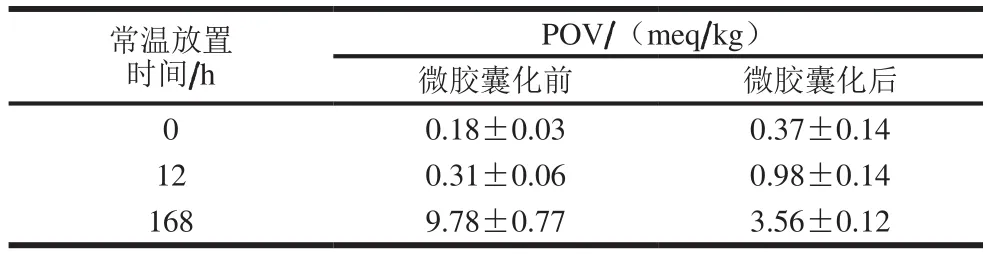
表1 微胶囊化前后DHA微藻油的POVTable 1 Peroxide values of DHA-enriched microalgae oil before and after microencapsulation
从表1中可知,经过微胶囊化后,DHA微藻油的POV为0.37 meq/kg,略高于微胶囊化前的油脂(0.18 meq/kg)。较低的POV也为延长微胶囊的货架期提供了一个有利的先决条件。贮存初期(12 h),所有样品的POV均有小幅上升,证明其氧化稳定性小幅降低,微胶囊化后油脂的POV上升更为明显。这是由于经过微胶囊化之后,未被包埋的表面油脂表面积大幅增加,微胶囊表面油快速氧化,导致其氧化稳定性下降[30]。经过7 d(168 h)的贮存后,微胶囊化前后POV分别为9.78 meq/kg与3.56 meq/kg,这是由于微胶囊可以有效地防止氧气的渗透,从而明显抑制了油脂的氧化。可见,DHA微藻油的微胶囊化能够有效地提高油脂的氧化稳定性,延长油脂的贮存期。
3 结 论
本研究建立了透射光浊度法作为乳状液稳定性的评价体系。采用0.1 g/100 mL SDS溶液将乳状液稀释500 倍体积作为稳定剂,测定波长为600 nm,考察乳状液制备后0 h和24 h透光率变化的差异,以此为依据可以快速准确地衡量乳状液体系的稳定性。
本实验探究了微胶囊配方中壁材、芯材和固形物对乳状液稳定性和微胶囊性质的影响。壁材中选用OSAS和麦芽糊精复配,在实验选定的范围内,随着OSAS在壁材中比例的提高,对乳状液的稳定性和微胶囊产品品质的影响呈现先增大后减小的趋势;DHA微藻油和总固形物质量分数过高都会降低乳状液的稳定性和微胶囊产品品质。结合SC/T 3505—2006规定,初步确定了DHA微藻油微胶囊化的配方。通过其贮存期内氧化稳定性的分析发现,DHA微藻油经过微胶囊化后,贮存期稳定性能够得到明显提高。这一研究对于简单高效地检测乳状液稳定性和开发高质量DHA微藻油微胶囊具有一定的指导意义。

